克罗恩病预后不良预测因素的研究
杨荣萍 高 翔 何 瑶 陈白莉 肖英莲 陈旻湖 胡品津*
中山大学附属第一医院消化内科1(510080) 广东医学院附属南山医院消化内科2
克罗恩病(CD)患者的临床过程差异较大,通常表现为缓解与复发交替,部分患者临床过程缓和,甚至终生无活动,而部分患者复发频繁,严重影响生存质量,甚至最终因并发症而需接受手术治疗[1]。随着内科治疗的研究进展,目前药物治疗,如抗肿瘤坏死因子-α(TNF-α)单抗[2]或早期应用免疫抑制剂[3]能诱导黏膜愈合,进而可能改变CD的自然病程,但生物制剂长期应用的安全性仍存在诸多争议,免疫抑制剂需权衡效益-风险比。因此,探讨预测CD自然病程或预后不良的因素,及早甄别高危患者并行更积极的治疗,似乎是更为合理的治疗选择。有研究发现CD确诊时临床特征对其自然病程有预测价值,欧洲共识意见亦推荐在制定初治方案时应将患者确诊时的临床特征考虑在内[4]。我国CD的临床特征和自然病程与西方有一定差异[5],国外的研究结果是否适用于国人尚不可知。本研究通过对首次确诊CD的病例行回顾性分析,旨在分析我国CD患者确诊时的临床特征并研究其对CD预后的预测价值。
对象与方法
一、研究对象
选取2003年1月~2010年12月中山大学附属第一医院门诊或住院首次确诊为CD并有完整随访资料的连续病例为研究对象,CD的诊断标准参考中华医学会消化病学分会制定的标准[6]。排除标准为确诊时以及随访过程中资料不完整或失访者,其中包括未完善小肠相关检查(小肠CT成像、小肠钡剂造影、小肠镜、胶囊内镜)者。
二、研究方法
1.随访和数据提取:通过翻阅存档资料,收集患者的人口学资料、确诊时临床特征资料以及随访期间病情变化、处理、转归等。临床分型参照蒙特利尔分型标准[7]。 确诊年龄:A1型,<17岁;A2型,17~40岁;A3型,>40岁。病变部位的分型依据结肠镜及其活检和至少1项小肠检查(小肠钡剂造影、胶囊内镜、小肠镜、小肠CT成像)结果等,分为回肠末端型(L1)、结肠型(L2)、回结肠型(L3)、上消化道型(L4)(不含 L1~L3),若同时累及上消化道和L1~L3,归为L1~L3。肠切除患者的病变部位追溯至手术前依据上述标准判定。疾病行为分为非狭窄非穿透型(B1型)、狭窄型(B2型)和穿透型(B3型),病程中任何时候出现腹腔内瘘管、炎性包块和(或)脓肿即为B3型,肛周病变(P)对疾病行为变量进行补充。
2.相关定义:预后不良定义为随访3年内至少出现下列一种情况:并发症、肠切除手术或因CD死亡,并发症主要包括肠梗阻、腹腔脓肿、肠瘘、肠穿孔、消化道大出血、复杂肛瘘等。非预后不良定义为随访满3年完全未发生上述3种情况。在分析影响预后不良影响因素时,将确诊后3个月内出现上述3项预后不良症状之任一项者予以剔除。
三、统计学分析
应用SPSS 16.0统计软件,计量资料以中位数(第25百分位数,第75百分位数)表示,计量资料的比较采用Mann-Whitney U检验(非正态分布)或t检验(正态分布),计数资料的比较采用Fisher’s精确概率法或χ2检验,双侧检验P<0.05为差异有统计学意义。
采用末次观察结转法(last observation being carried forward,LOCF)估算本组CD的预后不良率,即首先假设随访未满3年尚未发生本研究定义的预后不良事件的患者在随访至3年时均发生预后不良事件,计算预后不良率及其95%CI,所得上限为本组预后不良率95%CI的上限;再假设随访未满3年尚未发生预后不良事件的患者在随访至3年时均未发生预后不良事件,计算预后不良率及其95%CI,所得下限为本组预后不良率95%CI的下限。在分析预后不良预测因素时,通过单因素分析筛选出影响预后的因素,将P<0.1的变量进一步引入backward stepwise多因素Logistic回归模型进行分析。
结 果
一、一般资料
纳入符合标准的首次确诊连续CD患者共275例,中位随访时间为2年(1,4),最长随访时间为8年;男 177 例,女 98 例,男女比为 1.8∶1;初发年龄为 26 岁(19,34),确诊年龄为 28 岁(21,37),确诊年龄呈单峰分布,高峰为18~35岁;确诊时29例(10.5%)有吸烟史,均为男性患者;1例(0.4%)患者有IBD阳性家族史。
二、临床表现
CD患者确诊时的临床症状为腹痛245例(89.1%)、体质量下降 165例(60.0%)、腹泻 155例(56.4%)、发热 92例(33.5%)、贫血 70例(25.5%)。共81例(29.5%)患者伴随肠外表现,其中59例(21.5%)口腔溃疡,30 例(10.9%)关节疼痛,12 例(4.4%)皮肤病变,3例(1.1%)眼病,18例(6.5%)同时出现两种以上肠外表现。62例(22.5%)患者在初诊时或初诊前有肛周病变史。初诊时99例(36.0%)患者需应用系统作用的糖皮质激素,68例(24.7%)需应用免疫抑制剂治疗。
三、临床分型
确诊年龄:A1型 31例(11.3%),A2型 202例(73.5%),A3型 42例(15.3%);病变部位:L1型 58例(21.1%)(17例伴随上消化道病变),L2型33例(12.0%)(5例伴随上消化道病变),L3型 162例(58.9%)(40例伴随上消化道病变),L4型 22例(8.0%);疾病行为:B1型 217例(78.9%),B2型 32例(11.6%),B3型 26例(9.5%),62例(22.5%)伴随肛周病变,各疾病行为亚型中伴随肛周病变的比例分别为21.2%、18.8%、38.5%,但差异无统计学意义(P=0.123)。
四、预后不良率的估算
共97例CD患者完成3年随访,其中预后不良39例(40.2%);随访未满3年的178例患者中60例(33.7%)为预后不良。99例预后不良患者中,37例(37.4%)发生并发症但未行肠切除术,其中肠瘘9例、复杂肛瘘9例、腹腔脓肿8例、肠梗阻7例、消化道大出血4例;60例(60.6%)行肠切除术;2例(2.0%)死亡。
预后不良率95%CI上限值的估算:假设178例随访未满3年未发生预后不良事件的患者在随访至3年时均发生预后不良事件,本组预后不良率为 78.9%(217/275),95%CI:74.1%~83.7%。 预后不良率95%CI下限值的估算:假设178例随访未满3年未发生预后不良事件的患者在随访至3年时均未发生预后不良事件,则本组预后不良率为36.0%(99/275),95%CI:30.3%~41.7%。 因此, 估算本组CD的预后不良率的95%CI为30.3%~83.7%。
五、预后不良的单因素和多因素分析
34例CD患者在确诊3个月内发生预后不良事件,予以剔除,共241例患者纳入分析。
首先假设随访未满3年尚未发生预后不良事件的患者在随访至3年时均发生预后不良事件,则预后不良患者为183例,非预后不良患者58例。单因素分析示预后不良患者中确诊年龄A3型、复杂疾病行为(B2型或B3型)的比例明显高于非预后不良患者(见表1),进一步Logistic回归分析显示确诊年龄 A3 型(OR=6.743,95%CI:1.293~35.156,P=0.024)是CD预后不良的预测因素。
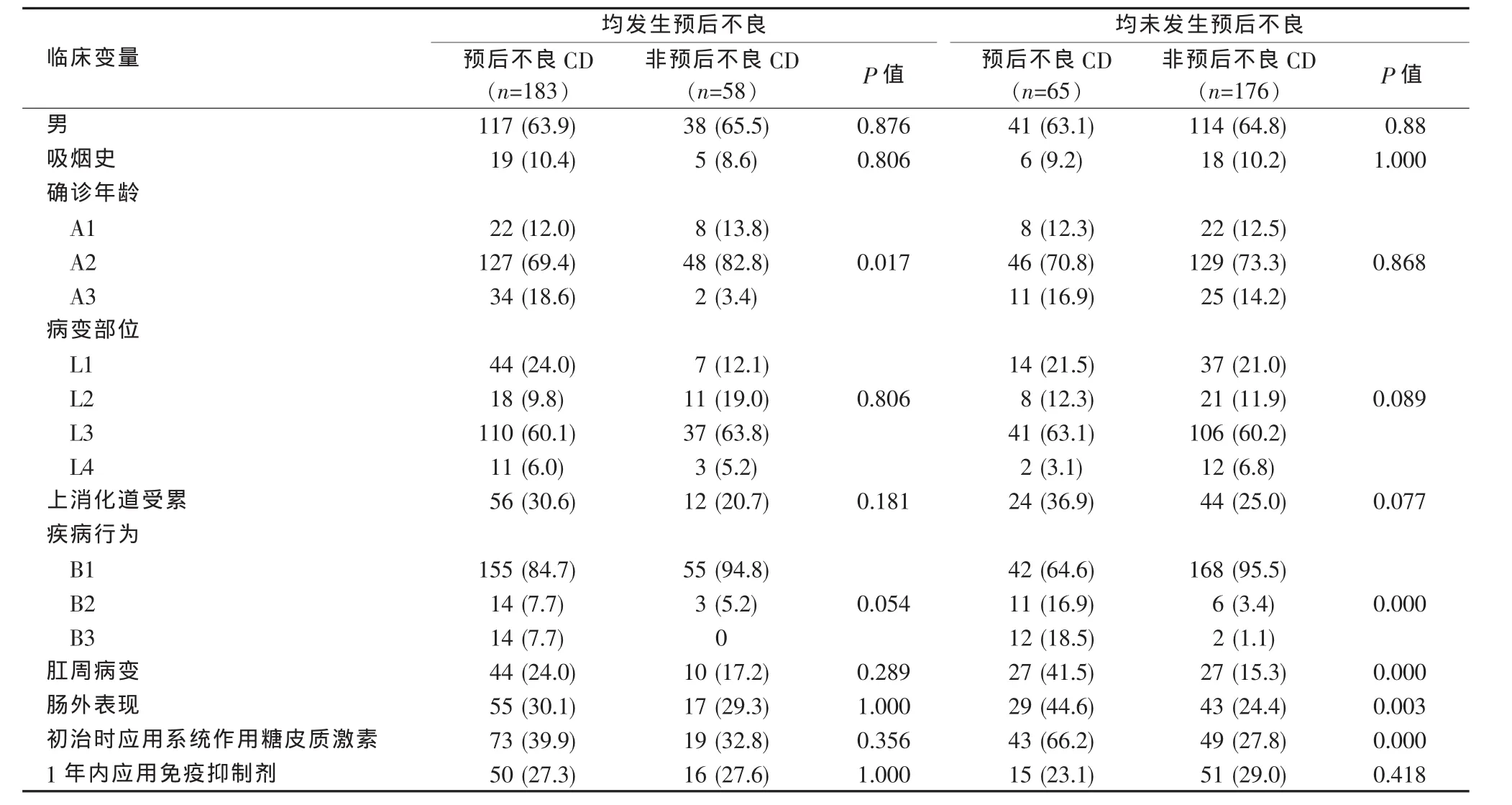
表1 CD患者预后不良预测因素的单因素分析n(%)
再假设随访未满3年尚未发生预后不良事件的患者在随访至3年时均未发生预后不良事件,则预后不良患者为65例,非预后不良患者176例。单因素分析显示预后不良患者中上消化道受累、复杂疾病行为(B2型或B3型)、伴随肛周病变、肠外表现、初治时需应用系统作用糖皮质激素的比例均高于非预后不良患者,而病变部位L4的比例低于非预后不良患者(见表1),进一步Logistic回归分析显示确诊时复杂疾病行为B2型(OR=9.761,95%CI:2.831~33.653,P<0.001)或 B3 型(OR=44.387,95%CI:8.266~238.343,P<0.001)、伴随肛周病变(OR=3.645,95%CI:1.645~8.081,P=0.001)以及初治时需应用系统作用糖皮质激素(OR=5.775,95%CI:2.741~12.169,P<0.001)是CD预后不良的预测因素。
在随访时间超过3年的97例患者以及随访时间未满3年的60例预后不良CD患者中,分别有38例、65例、44例、9例和1例患者同时存在上述4个预测因素(确诊年龄A3型、疾病行为B2型或B3型、肛周病变、初治应用激素)中的0个、1个、2个、3个和4个,各组预后不良率分别为18.4%、67.7%、86.4%、100%和100%,同时存在1个、2个、3个、4个预测因素的CD患者的预后不良率明显高于无预测因素的患者。
讨 论
CD是一种原因未明的肠道非特异性炎症性疾病,不同地区、不同人种的发病率和临床特征均存在差异,提示其发病可能与遗传、环境等因素有关。CD的表型特征对自然病程有预测价值,因此了解本地区CD临床特征与预后的关系可能对制定治疗方案有一定的参考价值。
本研究共纳入资料完整的275例CD连续病例,为目前国内较大样本的单中心研究。本研究结果再次证实东西方CD患者的临床特征存在明显差异,主要表现为:①性别比例不同:来自日本[8]、韩国[9]以及香港[5]的多项研究均证实,亚洲CD患者以男性多见,男女比为 2.2∶1~2.8∶1,本研究中亦以男性CD患者多见,男女比为1.8∶1,与西方研究[10]报道的女性CD略多不同;②病变部位的分布不同:西方CD患者以L2型为主要病变部位,且近年该比例呈明显上升趋势,达52%[11],而本组CD以L3型为主,L2型仅占12.0%,与日本、韩国文献[8,9]结果相似(分别为16.1%、12.3%)。本组单独累及上消化道(L4型)的比例较高(8.0%),更有22.5%伴有上消化道病变,显著高于西方研究[10],与Leong等[5]报道的香港患者相似;③家族聚集性低:本研究中仅0.4%的患者有IBD 家族史。 日本[12]、韩国[13]、香港[5]、新加坡[14]研究亦显示仅0~9.5%的CD患者有IBD阳性家族史,明显低于Monsén等[15]在白种人中的研究结果(13.4%)。家族史分布差异可能与NOD2/CARD15基因在不同种族中的分布差异有关[16,17];但有研究推测其可能与亚洲地区CD患病率低有关,随着患病率的增加,家族聚集性亦可能随之增加[9]。
目前尚未就“预后不良”或“致残性(disabling)”CD的定义达成共识。一项对1188例CD的回顾性分析[18]将致残性CD定义为确诊5年内需反复使用激素(2次以上)或激素依赖、需免疫抑制剂治疗、住院治疗、持续出现致残性症状、出现并发症、需手术治疗等,与致残性CD相关的确诊时因素为首次发作需激素治疗、年龄<40岁和伴随肛周病变。Loly等[19]的研究对预后不良采用更严格的标准即“严重疾病”(severe disease),定义为确诊 5 年内发生复杂性肛瘘、结肠切除、2段或以上小肠切除、造瘘术等。发现在确诊时与“严重疾病”相关的因素为狭窄和体质量下降(>5 kg)。目前国外研究比较接受的预后不良CD的预测因素为确诊时年龄轻(<40岁)、首次发作需激素治疗、伴随肛周病变、狭窄型疾病行为,并建议对这部分患者在确诊初期即宜采用更为积极的内科治疗[20]。本研究以并发症、手术和死亡等客观指标作为定义预后不良的标准。鉴于本组患者平均随访时间约为3年,故以3年作为预后不良的观察时限。本研究中30.3%~83.7%的CD患者预后不良,剔除确诊3个月内发生预后不良事件的患者后(鉴于这部分患者在确诊初期即表现为进展型,很可能是CD的亚型之一),Logistic回归分析显示,确诊年龄A3型、疾病行为B2型或B3型、伴随肛周病变以及初治时需应用系统作用糖皮质激素可能是预后不良的独立高危因素,且存在的危险因素越多,对预后不良的预测价值越高。与国外报道[18,19]相似,提示对国人CD预后不良的预测可参照目前国外的相关指标。
此外,本研究存在的不足主要为:①回顾性研究;②样本量仍偏小且随访期偏短;③研究对象仅为单个医疗中心而非社区人群。识别预测CD预后不良的高危因素仍是目前研究的热点和难点,更多设计严谨、大样本长期随访研究有望提供更多、更可靠的资料。
1 Cosnes J,Cattan S,Blain A,et al.Long-term evolution of disease behavior of Crohn’s disease[J].Inflamm Bowel Dis,2002,8(4):244-250.
2 Feagan BG,Panaccione R,Sandborn WJ,et al.Effects of adalimumab therapy on incidence of hospitalization and surgery in Crohn’s disease:results from the CHARM study[J].Gastroenterology,2008,135(5):1493-1499.
3 Vernier-Massouille G,Balde M,Salleron J,et al.Natural history of pediatric Crohn’s disease:a population-based cohort study[J].Gastroenterology,2008,135(4):1106-1113.
4 Van Assche G,Dignass A,Panes J,et al.The second European evidence-based consensus on the diagnosis and management of Crohn’s disease:Definitions and diagnosis[J].J Crohns Colitis,2010,4(1):7-27.
5 Leong RW,Lau JY,Sung JJ.The epidemiology and phenotype of Crohn’s disease in the Chinese population[J].Inflamm Bowel Dis,2004,10(5):646-651.
6 中华医学会消化病学分会.对我国炎症性肠病诊断治疗规范的共识意见[J].胃肠病学,2007,12(8):488-495.
7 Silverberg MS,Satsangi J,Ahmad T,et al.Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease:Report of a Working Party of the 2005 Montreal World Congress of Gastroenterology[J].Can J Gastroenterol,2005,19 Suppl A:5-36.
8 Oriuchi T,Hiwatashi N,Kinouchi Y,et al.Clinical course and longterm prognosis of Japanese patients with Crohn’s disease:predictive factors,rates of operation,and mortality[J].J Gastroenterol,2003,38(10):942-953.
9 Yang SK,Yun S,Kim JH,et al.Epidemiology of inflammatory bowel disease in the Songpa-Kangdong district,Seoul,Korea,1986-2005:a KASID study[J].Inflamm Bowel Dis,2008,14(4):542-549.
10 Freeman HJ.Application of the Montreal classification for Crohn’s disease to a single clinician database of 1015 patients[J].Can J Gastroenterol,2007,21(6):363-366.
11 Lapidus A.Crohn’s disease in Stockholm County during 1990-2001:an epidemiological update[J].World J Gastroenterol,2006,12(1):75-81.
12 Ishige T, Tomomasa T, Takebayashi T, et al.Inflammatory bowel disease in children:epidemiological analysis of the nationwide IBD registry in Japan[J].J Gastroenterol,2010,45(9):911-917.
13 Park JB,Yang SK,Byeon JS,et al.Familial occurrence of inflammatory bowel disease in Korea[J].Inflamm Bowel Dis,2006,12(12):1146-1151.
14 Lee YM,Fock K,See SJ,et al.Racial differences in the prevalence of ulcerative colitis and Crohn’s disease in Singapore[J].J Gastroenterol Hepatol,2000,15(6):622-625.
15 Monsén U,Bernell O,Johansson C,et al.Prevalence of inflammatory bowel disease among relatives of patients with Crohn’s disease[J].Scand J Gastroenterol,1991,26(3):302-306.
16 Hugot JP,Chamaillard M,Zouali H,et al.Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn’s disease[J].Nature,2001,411(6837):599-603.
17 Leong RW,Armuzzi A,Ahmad T,et al.NOD2/CARD15 gene polymorphisms and Crohn’s disease in the Chinese population[J].Aliment Pharmacol Ther,2003,17(12):1465-1470.
18 Beaugerie L,Seksik P,Nion-Larmurier I,et al.Predictors of Crohn’s disease[J].Gastroenterology,2006,130(3):650-656.
19 Loly C,Belaiche J,Louis E.Predictors of severe Crohn’s disease[J].Scand J Gastroenterol,2008,43(8):948-954.20 Dignass A,Van Assche G,Lindsay JO,et al.The second European evidence-based consensus on the diagnosis and management of Crohn’s disease:Current management[J].J Crohns Colitis,2010,4(1):28-62.

