肠内营养对重症COPD患者疗效和心功能的影响
张 静,张国良,王殿华,王昌惠,宋小莲
(1.上海市第二人民医院ICU,上海 200011;2.同济大学附属第十人民医院呼吸内科,上海 200072)
慢性阻塞性肺病(chronic obstructive pulmonary diseases,COPD)是一种以不完全可逆性气流阻塞为特征的人类常见慢性疾病,在目前世界范围内死亡原因中排第4位[1]。COPD主要累及肺,但也可引起全身的不良反应,营养不良是其常见并发症,同时,COPD重症患者心脏功能亦常受损。据报道,在COPD发展过程中,营养不良的发病率为24% ~71%,几乎50%住院患者有明显的营养不良,当病情加重行机械通气时,此比例会更高达60%以上[2]。但临床医师,特别是ICU工作人员对此认识仍不充分。本研究对2008年1月至2010年8月部分入住上海市第二人民医院ICU的COPD并营养不良的无创机械通气治疗患者进行营养干预和观察,报道如下。
1 资料与方法
1.1 一般资料
选择2008年1月至2010年8月入住我院ICU病房的COPD急性加重期患者72例,均符合2007年中华医学会修订的COPD诊治指南的Ⅲ-Ⅳ级COPD诊断标准[3],无合并内分泌及代谢疾病,无使用激素,无活动性结核、肿瘤等影响机体代谢和营养状况的疾病。入院动脉血气分析提示静息状态下低氧血症和CO2潴留(paO2<7.98 kPa,paCO2>6.65 kPa),需无创呼吸机辅助通气。营养不良的诊断标准为体质量指数BMI<18.5 kg/m2。所有研究对象均知情同意。
1.2 治疗方法
剔除极危重患者,经患者及家属知情同意,随机分为早期肠内营养治疗组(A组)和自主进食对照组(B组)。B组34例,男18例,女l6例,年龄(69±9)岁,采用常规积极治疗(包括抗感染、氧疗、解痉平喘祛痰等),A组38例,男21例,女17例,年龄(71±10)岁,在上述常规治疗的基础上,经鼻饲给予早期肠内营养支持,依据Harris-Benedict方程计算基础热能消耗,再乘以校正系数1.5即为呼吸衰竭进行机械通气患者的基础能量供应值,其中脂肪提供热占25%~35%,蛋白质占20% ~25%,其余为碳水化合物提供,热氮比值为100~150∶1,另外合理补充维生素、膳食纤维、微量元素及电解质;血清白蛋白低于30 g/L则予以补偿人血白蛋白10 g×2支。治疗期为2周。两组患者在年龄,病程,病情及营养状态等方面均无显著性差异(P >0.05)。
1.3 监测项目
(1)常规测量以下项目。①身高及体质量:根据身高和年龄查得理想体质量(IBW)并计算实际体质量占理想值的百分比(IBW%);②肱三头肌皮褶厚度(TSF,mm):用皮褶厚度计(国家体委研究所监制)测量患者右手肩峰与尺骨鹰嘴连线中点,于该点上方2 cm处,测定者以左手拇指与食指将皮肤连同皮下脂肪捏起呈皱褶,捏起处两边的皮肤须对称,然后用皮褶厚度计测定;③上臂肌周径(MAMC,cm):在右上臂后中轴线标记中点,用皮卷尺测量上臂周径(MAC),MAMC(cm)=MAC(cm)-0.314×TSF(mm)。(2)检测血清白蛋白(ALB,g/L)、前白蛋白(pro-ALB,mg/L)及外周血淋巴细胞总数(TLC)。(3)观察治疗前后paO2和paCO2情况;以上项目在两组患者入院当天和营养治疗结束后(A组)或病情稳定1周后(B组)各检1次。(4)入院时及治疗1周、2周后分别抽取清晨空腹血,检测患者血清C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、脑钠肽(BNP)及脑钠肽前体(pro-BNP)等指标的水平。(5)记录患者住院天数及无创通气时间。
1.4 统计学处理
2 结 果
2.1 临床疗效
两组患者中,A组营养不良者占78.9%(30/38),B组营养不良者占76.5%(26/34),两者无明显差异(P>0.05),两组总计营养不良者占77.8%(56/72)。
A组患者营养支持治疗后均未发生胃肠不耐受症状如腹胀、腹泻等。
A组38例患者在综合治疗+营养支持治疗后全部成功撤机(100%),机械通气时间为(8.5±2.6)d,全部病情恢复出院,平均住院时间(13.5±2.4)d;B组患者有30例成功撤机(88.3%),病情稳定出院,4例死亡,机械通气时间为(12.3±3.4)d,平均住院(17.5 ±3.1)d。A 组成功撤机例数比B组多,差异有统计学意义(χ2=4.734,P=0.03),A 组机械通气时间(t= -23.03,P <0.01)及平均住院天数(t=-26.4,P<0.01)明显短于B组,差异有统计学意义。
2.2 两组患者营养参数的变化
A组治疗后IBW%、TSF和MAMC明显增加(P <0.05),对照组无明显增加(P >0.05);治疗后A组患者血清白蛋白、前白蛋白水平较营养亦有显著性升高(表1)。
表1 两组COPD患者治疗前后营养参数的变化Tab.1 Comparison of nutritional parameters in patients with COPD before and after therapy ()
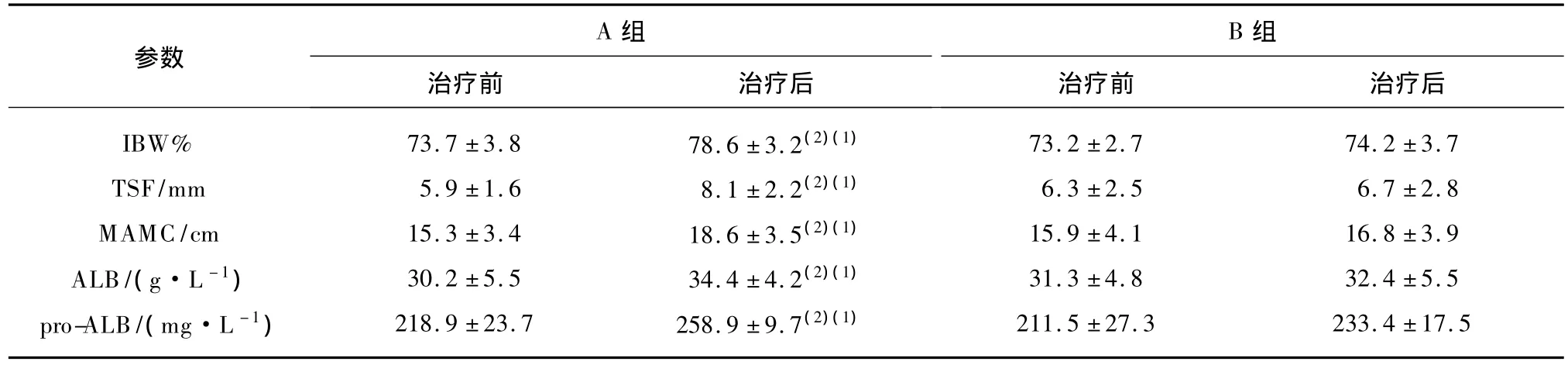
表1 两组COPD患者治疗前后营养参数的变化Tab.1 Comparison of nutritional parameters in patients with COPD before and after therapy ()
与本组治疗前比较,(1)P <0.05;与 B 组比较,(2)P <0.05
A 组B 组参数治疗前 治疗后IBW% 73.7 ±3.8 78.6 ±3.2(2)(1) 73.2 ±2.7 74.2 ±3.7 TSF/mm 5.9 ±1.6 8.1 ±2.2(2)(1) 6.3 ±2.5 6.7 ±2.8 MAMC/cm 15.3 ±3.4 18.6 ±3.5(2)(1) 15.9 ±4.1 16.8 ±3.9 ALB/(g·L -1) 30.2 ±5.5 34.4 ±4.2(2)(1) 31.3 ±4.8 32.4 ±5.5 pro-ALB/(mg·L -1) 218.9 ±23.7 258.9 ±9.7(2)(1) 211.5 ±27.3 233.4 ±17.5治疗前 治疗后
2.3 TLC和血气检查
治疗后A组TLC高于B组,差异有统计学意义(P<0.05)。入院时两组患者动脉血paO2、paCO2无明显差异(P>0.05);机械通气等治疗后,A、B组的paO2、paCO2有显著改善(P <0.05),且 A 组改善情况较B组更佳(P<0.05),见表2。A、B组恢复至paO2>7.98 kPa和 paCO2< 6.65 kPa 时间为7.2、11.8 d(除外死亡4 例)。
表2 两组COPD患者治疗前后TLC、paO2和paCO2的变化Tab.2 Comparison of TLC,paO2and paCO2in patients with COPD before and after therapy ()

表2 两组COPD患者治疗前后TLC、paO2和paCO2的变化Tab.2 Comparison of TLC,paO2and paCO2in patients with COPD before and after therapy ()
与本组治疗前比较,(1)P <0.05;与 B 组比较,(2)P <0.05
A 组B 组项目治疗前 治疗后TLC/(个·ml-1) 1373.2 ±288.4 1881.9 ±302.4(1)(2) 1418.4 ±265.7 1577.2 ±315.6 paO2/kPa 7.7 ±2.5 12.1 ±4.2(1)(2) 7.5 ±1.9 10.4 ±4.2(1)paCO2/kPa 8.2 ±1.6 5.8 ±2.3(1)(2) 8.4 ±2.8 6.5 ±4.2(1)治疗前 治疗后
2.4 炎症和心功能指标
治疗前后两组患者血清 CRP、TNF-α、BNP及pro-BNP等指标的变化见表3。治疗1周后,两组上述指标均有所下降(P<0.01),但A组下降更为明显,组间差异有统计学意义(P<0.01);2周后,两组各观察指标差异无统计学意义(P>0.05)。
表3 两组COPD患者治疗前后炎症和心功能指标的变化Tab.3 Comparison of inflammatory and heart functional parameters in patients with COPD before and after therapy()

表3 两组COPD患者治疗前后炎症和心功能指标的变化Tab.3 Comparison of inflammatory and heart functional parameters in patients with COPD before and after therapy()
与本组治疗前比较,(1)P <0.01;与 B 组比较,(2)P <0.01
?
3 讨 论
COPD是一种慢性疾病,多数患者伴有不同程度的营养不良及心功能不全,急性加重期的重症患者伴随呼吸衰竭,营养不良及心功能不全更呈进行性加重,严重影响呼吸功能。本研究中,总计营养不良者占77.8%,比例略高于文献报道[3],可能因为入组的患者均为重症;入院时所有患者的血清BNP及pro-BNP也明显高于正常范围,提示该患者群普遍存在心功能不全状况。
COPD患者合并营养不良的主要原因在于摄入减少,胃肠缺氧状态下吸收功能障碍,及呼吸功耗增加。而COPD伴随营养不良的患者更易因餐后低氧血症而致热能与营养摄入减少,长期以往会加重营养状况的恶化[4]。COPD合并营养不良将导致患者体质量下降,骨骼肌代谢和结构改变,使呼吸肌群包括膈肌重量减少、呼吸肌易疲劳,从而降低肺通气功能,造成患者易对呼吸机依赖;营养不良也可严重损害机体的防御和免疫功能,已成为不依赖于气道梗阻程度COPD加重的独立危险因素[5]。营养不良、呼吸道感染、呼吸衰竭和心功能不全等往往互为因果,形成恶性循环,有效的营养干预有利于改善患者的预后。本研究中,营养支持组患者治疗后营养参数明显改善,与对照组相比,其撤机成功率、血气指标改善、机械通气时间和平均住院日显著性降低,与文献报道类似。而且,随着营养状况的好转,营养支持组患者 TLC亦增高,提示其免疫功能有所恢复。
目前,国内外虽有部分研究证实营养支持能改善COPD患者营养状况和免疫功能,但关于营养治疗对COPD患者炎性指标和心功能指标的改善报道甚少。理论上,营养支持有利于通气和气道黏膜防御功能的恢复,可进一步降低COPD炎症反应,打破感染、呼衰和心力衰竭相互影响的恶性循环。本研究观察了营养支持对COPD患者发病过程中强有力促炎因子TNF-α及 CRP的影响。结果显示,随着治疗进行,治疗组患者较之未行营养干预的对照组患者,TNF-α及CRP更早出现降低趋势,而BNP及pro-BNP亦随之降低,提示心功能相应改善,最终缩短病程与住院时间。本研究认为,营养支持对心功能的影响,得益于水电解质平衡紊乱的及时纠正、免疫功能增强、感染的及时控制及肺功能改善后心脏负荷减低等因素。
COPD患者营养补充的方法包括胃肠外营养和胃肠营养,各有其优缺点。静脉营养支持快速、直接而有效,但长期肠外营养可出现肠黏膜萎缩,肠黏膜屏障功能受损,细菌内毒素移位,而且某些营养素如谷氨酰胺、膳食纤维等在静脉剂型中受到制作和生理上限制。适量补充谷氨酰胺对COPD加重期患者的营养状况、免疫功能和肺功能则有显著改善[6]。合理的肠内营养配方则有利于此类物质的补充,从而有益维护肠道的正常功能和正常菌群,防止肠黏膜萎缩及预防应激性溃疡出血[7]。此外,重症COPD患者常合并心功能不全,补液量受限,肠内营养由此更为安全。因此,本研究采用经胃管鼻饲,无创安全,更符合生理状态,所以患者接受程度及治疗效果良好,保证营养供给的同时均未发生胃肠不耐受症状。
COPD患者体内常呈高分解状态,其营养不良多为蛋白-能量型,直接影响呼吸肌功能,因此,为改善呼吸肌功能及增强机体免疫力,补充足够的蛋白质比热量更为重要。由于过多葡萄糖可致机体产生更多的CO2,从而加重呼吸负担,适当提高脂肪供能是一种COPD患者营养支持策略,且提供必需脂肪酸有助于合成表面活性物质,降低呼吸功耗。一般认为蛋白质、脂肪和碳水化合物的理想供能比例为15%~20%、30% ~35%、50%,以保证足够的蛋白质供合成代谢和肌肉功能修复。严重通气障碍的患者应以高蛋白、高脂肪和低碳水化合物为宜[8-9]。
总之,营养支持在需要无创机械通气的重症COPD加重期患者的整体综合治疗中是十分重要的环节,合理有效的营养干预对COPD患者的炎症控制、心功能改善和疾病康复中有重要意义。本研究显示,重症需接受无创通气的COPD患者进行肠内营养可提高患者的营养状况,改善免疫状况和心功能指标,提高无创通气效率,从而改善预后。本研究中,营养支持疗效较好,可能与剔除了极危重例,同时可能由于患者在COPD急性加重期营养下降较快,经治疗后短期内恢复所致。
[1]Rabe KF,Hurd S,Anzueto A,et al.Global strategy for the diagnosis, management, and prevention ofchronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2007,176(6):532-555.
[2]Ezzell L, Jensen GL.Malnutrition in chronic obstructive pulmonary disease[J].Am J Clin Nutr,2000,72(6):1415-1416.
[3]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
[4]董欢霁,罗勇,徐卫国,等.慢性阻塞性肺疾病患者营养与餐后低氧的关系[J].上海交通大学学报:医学版,2006,24(5):535-537.
[5]Schols AM,Broekhuizen R,Weling-Schepers CA,et a1.Body composition and mortality in chronic obstructive pulmonary disease[J].Am J Clin Nutr,2005,82(1):53-59.
[6]周琪,邱丽君,汪维乐,等.谷氨酰胺对COPD合并营养不良患者内皮细胞功能的影响[J].上海第二医科大学学报,2004,24(5):368-370.
[7]陈胜芳,崔春黎.持续非卧床腹膜透析患者营养状况评价[J].同济大学学报:医学版,2010,31(1):49-52.
[8]Celli BR,Macnee W.Standards for the diagnosis and treatment of patients with COPD:a summary of the ATS/ERS position paper[J].Eur Respir J,2004,23(6):932-946.
[9]蔡炯,刘有英,熊金萍,等.外科术后患者的营养支持[J].同济大学学报:医学版,2007,28(2):71-73.

