miR-127和miR-136在转基因克隆绵羊胎盘中的表达分析及其靶基因的鉴定
胡圣伟,倪 伟,陈创夫,赛务加甫,务热力·哈孜,郭吉星
(1.石河子大学 动物科技学院,新疆 石河子 832000;2.石河子大学 生命科学学院,新疆 石河子 832000)
目前,通过体细胞核移植技术己经成功培 育 出 绵 羊[1]、牛[2]、山 羊[3]、猪[4]、大鼠[5]、骡子[6]和狗[7]等多种哺乳动物,尤其是在利用该技术成功获得具有一定性状的转基因克隆绵羊、牛和猪后,显示出这一技术诱人的应用前景。但是,体细胞克隆动物在孕期流产率较高,只有少数能发育到妊娠末期或成年,即使存活的克隆动物也存在一些健康和器官发育异常的问题。研究发现很多克隆动物的发育异常都与其胎盘发育缺陷相关[8]。克隆绵羊胎盘发育缺陷导致大量胚胎在妊娠阶段发育停滞或流失,胎盘表现出子叶数量减少和血管系统发育缺陷等问题[9]。因此,胎盘发育缺陷是导致克隆动物效率低下的重要原因之一。然而,目前克隆动物胎盘发育异常的分子机制尚不清楚。
MicroRNA(miRNA)是近几年在真核生物中发现的一类内源性的具有调控功能的非编码RNA分子,其在转录和转录后水平上调控基因的表达[10]。miRNA参与细胞的增殖、分化和凋亡等过程,在胚胎和胎盘发育过程中发挥重要的调控作用[11]。miR-127和miR-136是两个位于印记基因retrotransposon-like(Rtl1)的GC岛附近的miRNA,而Rtl1是一个在胎盘发育过程中起到重要调控作用的关键基因[12]。Cui等[13]发现,在克隆小鼠囊胚中 miR-127的表达量及其启动子甲基化水平显著异常,证实miR-127在体细胞克隆小鼠胚胎中未被正确重编程。推测miR-127的不完全重编程可能导致克隆动物胎盘发育缺陷。然而,miR-127和miR-136是否在克隆动物胎盘中异常表达及其作用机制还未见报道。
在本研究中,运用荧光定量PCR比较了miR-127和miR-136分别在死亡克隆绵羊和普通对照绵羊胎盘中的相对表达量,并运用EGFP荧光报告系统鉴定miR-127和miR-136的靶基因,分析了靶基因在克隆胎盘中的表达情况。结果表明,在克隆绵羊胎盘中miR-127和miR-136基因表达量显著高于对照绵羊胎盘中的表达量,miR-127和miR-136模拟物可显著降低Rtl1-EGFP融合基因在细胞中的表达,初步证实Rtl1是miR-127和miR-136的靶基因,并且在克隆绵羊胎盘中的表达量降低了3/5。这些发现为从microRNA角度揭示克隆动物胎盘发育异常的分子机制奠定了基础。
1 材料和方法
1.1 材料与试剂
1.1.1 实验材料
绵羊卵巢采集于乌鲁木齐市屠宰场,4 h内于20~25℃生理盐水中送回实验室用于收集绵羊卵母细胞。以40 d的细毛羊胎儿成纤维细胞为核移植的供体细胞。用于对照组的正常受精产生的绵羊胎盘来自石河子大学实验场。
1.1.2 主要试剂
Taq DNA聚合酶、dNTP,凝胶回收纯化试剂盒、质粒小量制备纯化试剂盒和Genomic DNA Kit购自北京 TianGen公司;DNA marker,SYBR Green,PrimeScript II 1st Strand cDNA Synthesis Kit购自takara公司;小RNA分离试剂、荧光定量PCR试剂盒购自Ambion公司。DMEM/F12、胎牛血清购自Gibco公司;miR-127 minics、miR-136 minics和荧光定量PCR引物由Ambion公司合成。
1.2 方法
1.2.1 转基因克隆绵羊的生产
靶向绵羊肌肉生长抑制素的shRNA表达载体构建、转染及阳性细胞的筛选[14,15]。卵母细胞的采集与体外成熟培养、体细胞核移植程序[16,17]。2010 年,本研究组共获得 2只肌肉生长抑制素基因敲的转基因克隆绵羊。其中1只在出生后即死亡,另一只存活23 d后死亡。选取死亡的2只转基因绵羊的胎盘作为实验组(D1和D2)。该组羔羊都表现有不同程度的发育异常。D1存在呼吸问题,胎盘肥大;D2为死胎,胎盘肥大,剖解未见器官异常。另外采集2只普通健康的细毛羊胎盘作为对照组。转基因绵羊通过PCR和Southern blotting鉴定(另文发表)。
1.2.2 miR-127和miR-136的荧光定量PCR
采用stem-loop qRT-PCR定量分析microRNA的表达量[18]。收集克隆绵羊及对照组绵羊胎盘组织,分别提取总RNA,分别以反转录引物(5’-GCG CGT GAG CAG GCT GGA GAA ATT AAC CAC GCG CAG CCAA-3’)和(5’-GCG CGT GAG CAG GCT GGA GAA ATT AAC CAC GCG CTC CATC-3’)逆转录合成miR-127和miR-136 cDNA第1链,以此反转录产物为定量PCR模板。分别以miR-127定量 PCR引物(F:5’-ATCGGATCCGTCTGAG-3’;R:5’ -GAGCAGGCTGGAGAA-3’)及miR-136 定量 PCR引物(F:5’ -CTCCATTTGTTTTGATGATG-3;R:5’-GAGCAGGCTGGAGAA-3’)进行PCR反应,反应条件为:95℃ 1 min变性,95℃ 15 s、60℃ 30 s;40个循环。以sonRNA234为内参进行数据分析。
1.2.3 Rtl1-EGFP表达载体的构建
Sekita报道,miR-127和miR-136的序列与Rtl1基因开放阅读框内一段序列具有互补性,miR-127和miR-136可能以RNAi方式调控Rtl1基因的表达[12]。本研究利用EGFP基因报告系统进一步验证。根据GeneBank公布的绵羊Rtl1基因组序列,设计用于扩增包含miR-127靶位点的Rtl1基因片段的引物(F:5’-GCACCTTCCACTCTCCCTACTG-3’;R:5’-GCTTGGCTTTTTCTTGCACC-3’)和包含 miR-136靶位点的Rtl1基因片段的引物(F:5’-ATGATAGAACCCTCTGAAGACTCA-3’;R:5’ -AGATGACAACCCTCGCATGACT-3’),以胎盘细胞基因组DNA为模板,PCR扩增包含miR-127和miR-136靶位点的Rtl1基因片段。将PCR产物经琼脂糖凝胶电泳分离,用凝胶回收试剂盒纯化后,克隆至pEGFP-N1载体(Clontech)。经XhoⅠ和SalⅠ双酶切和测序鉴定后,获得pRtl127-EGFP和pRtl136-EGFP表达载体。
1.2.4 EGFP荧光敲除实验
参照Huang等[19]验证miRNA靶基因的方法,我们利用EGFP荧光敲除实验验证miR-127和miR-136的靶基因。绵羊胎儿成纤维细胞的分离培养[14]。在转染前一天以每孔2×105个细胞接种12孔细胞板,待细胞生长至80%~90%丰度时开始转染。按照lipofectamine 2000说明书以100 nmol/L工作浓度的 miRNA minics和1.5 μg/孔的 Rtl1-EGFP表达载体,分别按miR-127 minics+pRtl127-EGFP组;miR-136 minics+pRtl136-EGFP组和pRtl136-EGFP组转染绵羊胎儿成纤维细胞,转染24 h后在荧光显微镜下观察荧光表达情况。
1.2.5 半定量RT-PCR
按照Trizol RNA提取试剂盒使用说明,提取转染后的绵羊胎儿成纤维细胞总RNA,并逆转录合成cDNA第1链。以EGFP基因引物(F:5’ -CGACGTAAACGGCCACAAGT-3’;R:5’ -TCTGCTGGTAGTGGTCGGCG-3’)进行PCR扩增,以绵羊β-actin基因为内参,比较Rtl1-EGFP融合基因在各个处理组细胞中的表达。Rtl1-EGFP融合基因PCR反应条件:95℃预变性5 min;94℃变性30 s,60℃复性30 s,72℃延伸50 s;35个循环,最后72℃延伸10 min。
1.2.6 Rtl1的荧光定量RT-PCR
由于Rtl1蛋白抗体无法获得,我们采用荧光定量PCR的方法定量分析RTL基因在正常绵羊和克隆绵羊胎盘中的表达量。根据Trizol说明书提取胎盘总RNA,使用反转录试剂盒及随机引物合成cDNA。以此cDNA为模板,用Rtl1引物P1(5’ -GGTCGAACAGTTCTGGAATCA-3’)和 P2(5’ -GGTCGAACAGTTCTGGAATCA-3’)进 行PCR,按照SYBR荧光染料说明书进行荧光定量PCR。PCR反应条件:95℃ 15 s变性,95℃ 15 s、60℃ 15 s;72℃ 15 s 40个循环。以GAPDH为内参,用2-ΔΔCT法计算Rtl1基因相对表达量。
2 结果
2.1 miR-127和miR-136在克隆绵羊胎盘中的表达
提取克隆绵羊胎盘(实验组)及对照组绵羊胎盘组织总RNA,应用荧光定量PCR方法检测miR-127和miR-136在胎盘组织中的表达情况。结果表明,克隆绵羊胎盘组织中miR-127和miR-136的表达量明显高于对照组绵羊胎盘组织中的表达量,miR-127和miR-136在克隆绵羊胎盘组织中的表达量分别增加了3.1和2.8倍(图1)。
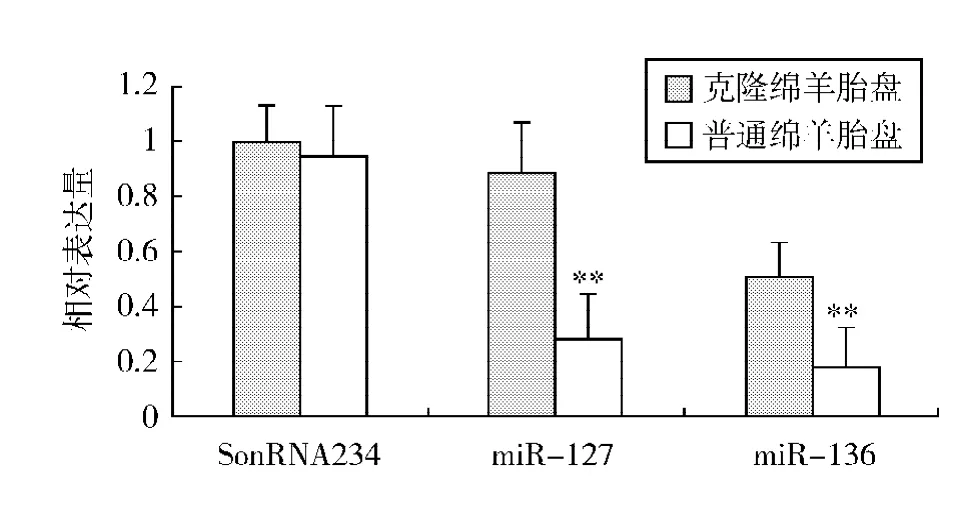
图1 miR-127和miR-136在克隆绵羊和普通绵羊胎盘中的表达分析
2.2 Rtl1为miR-127和miR-136的靶基因
从绵羊胎盘细胞基因组中,通过PCR分别扩增出含miR-136和miR-127靶位点的Rtl1基因序列,长度分别为290 bp和320 bp(图 2)。将这两段 Rtl1基因序列克隆至pEGFP-N1载体,经双酶切及测序鉴定正确,表明成功构建 pRtl136-EGFP和pRtl127-EGFP表达载体。
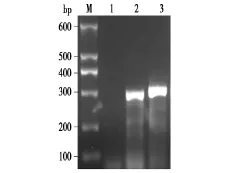
图2 miR-127和miR-136的靶位点基因序列的PCR扩增
将miR-127 minics+pRtl127-EGFP、miR-136 minics+ pRtl136-EGFP和pRtl136-EGFP分别转染绵羊胎儿成纤维细胞。24 h后荧光显微镜观察发现,miR-127 minics+pRtl127-EGFP组和miR-136 minics+pRtl136-EGFP组荧光强度明显弱于对照组(pRtl136-EGFP)(图3 A)。半定量RT-PCR检测发现,miR-127 minics+pRtl127-EGFP组和 miR-136 minics+pRtl136-EGFP组转染的细胞中Rtl1-EGFP mRNA表达水平显著减弱(图3 B)。
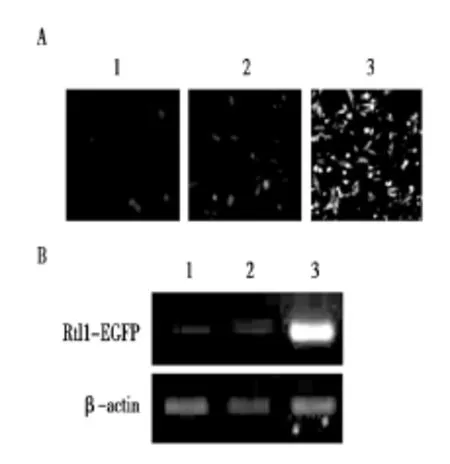
图3 miR-127和miR-136靶基因的鉴定
2.3 Rtl1在克隆绵羊胎盘中的表达分析
提取克隆绵羊胎盘及对照组绵羊胎盘组织总 RNA,应用荧光定量 PCR方法检测Rtl1在胎盘组织中的表达情况。结果表明与对照组绵羊胎盘组织,克隆绵羊胎盘组织中Rtl1的表达量降低了3/5(图4)。

图4 Rtl1在绵羊胎盘中的相对表达量
3 讨论
多项研究已经表明,胎盘发育异常可能是造成克隆动物效率低下的主要原因之一,并且很多克隆动物的胎盘都表现出发育缺陷[8,9,20]。最近,李劲松研究组[21]利用四倍体胚胎补偿技术直接证明,克隆囊胚滋养外胚层的发育缺陷是克隆胚胎体内发育失败的主要原因,进一步直接说明胎盘发育缺陷是导致克隆动物效率低下的主要原因。但目前克隆动物胎盘发育异常的分子机制尚不清楚。microRNA是一类重要的细胞生长和分化的调控分子,普通动物胎盘中表达的microRNA对胚胎的着床、胎儿的生长和发育有着重要的调控作用[22,23]。但是目前对克隆绵羊胎盘中microRNA的表达和功能研究尚未见报道。在本研究中,我们分析了miR-127和miR-136在死亡克隆绵羊胎盘组织中的表达情况,验证了miR-127和miR-136的靶基因及分析了靶基因在胎盘中的表达情况。
本研究应用荧光定量PCR的方法分析了miR-127和miR-136在克隆绵羊胎盘中和普通对照绵羊胎盘中的表达量,结果表明miR-127和miR-136在克隆绵羊胎盘中表达量显著高于普通对照绵羊胎盘中的表达量,说明miR-127和miR-136在克隆绵羊胎盘中未被正确重编程。Cui等[13]人也报道miR-127和miR-136在克隆小鼠囊胚中未被正确重编程。本研究进一步利用EGFP荧光报告系统证实Rtl1是miR-127和miR-136的靶基因,并且定量分析发现Rtl1基因在克隆胎盘中的表达量明显降低。表明在绵羊体细胞核移植后,miR-127和miR-136基因未被正确重编程,异常表达的miR-127和miR-136导致靶基因Rtl1基因在克隆胎盘中表达降低。已有研究表明Rtl1基因在胎盘发育过程中的发挥着重要作用,Rtl1基因过表达或缺失可导致胎盘发育异常,进而导致胎儿死亡或者新生小鼠死亡[12]。因此,miR-127和miR-136在克隆绵羊胎盘中的异常表达很可能导致Rtl1基因的低表达,这可能是克隆胎儿发育异常以及死亡的主要原因之一。
鉴于本研究的结果,结合Rtl1在胎盘发育过程中功能研究[12],我们假设体细胞克隆动物死亡率较高的一个重要原因如下:供体细胞的不完全重编程导致miR-127和miR-136在克隆动物胎盘中的高水平表达,异常表达的miR-127和miR-136导致靶基因Rtl1的低表达,而胎盘中Rtl1的缺失可导致新生克隆动物死亡[12]。但该假设仍需要大量的体内外试验验证。
[1] Campbell KH,McWhir J,Ritchie WA,et al.Sheep cloned by nuclear transfer from a cultured cell line.Nature,1996,380(6569):64-67.
[2] Kato Y,Tani T,Sotomaru Y,et al.Eight calves cloned from somatic cells of a single adult.Science,1998,282(5396):2095-2098.
[3] Baguisi A, Behboodi E, Melican DT, et al.Production of goats by somatic cell nuclear transfer.Nat Biotechnol,1999,17(5):456-461.
[4] Polejaeva IA,Chen SH,Vaught TD,et al.Cloned pigs produced by nuclear transfer from adult somatic cells.,Nature,2000,407(6800):86-90.
[5] Zhou Q,Renard JP,Fries GL,et al.Generation of fertile cloned ratsby regulating oocyte activation.Science,2003,302(5648):1179.
[6] Woods GL,White KL,Vanderwall DK,et al.A mule cloned from fetal cells by nuclear transfer.Science,2003,301(5636):1063.
[7] Lee BC,Kim MK,Jang G,et al.Dogs cloned from adult somatic cells.Nature,2005,436(7051):604
[8] Cibelli JB,Campbell KH,Seidel GE,et al.The health profile of cloned animals.Nat Biotechnol,2002,20(1):13-14.
[9] De Sousa PA,King T,Harkness L,et al.Evaluation of gestational deficiencies in cloned sheep fetuses and placentae.Biol Reprod,2001,65:23-30.
[10] Rana TM.Illuminating the silence:understanding the structure and function of small RNAs.Nature,2007,8(1):23-36.
[11] Brennecke J,Stark A,Cohen S M.Not miR-ly muscular:microRNAs and muscle development.Genes Dev,2005,19(19):2261-2264
[12] Sekita Y,Wagatsuma H,Nakamura K,et al.Role of retrotransposon-derived imprinted gene,Rtl1,in the feto-maternal interface of mouse placenta.Nat Genet,2008,40:243-248.
[13] CuiXS, ZhangDX, KoYG, etal.Aberrant epigenetic reprogramming of imprinted microRNA-127 and Rtl1 in cloned mouse embryos.Biochem Biophys Res Commun,2009,379:390–394.
[14] Hu S,Ni W,Sai W,et al.Sleeping Beautymediated knockdownofsheep myostatin byRNA interference.BiotechnolLetter, 2011, 33(10):1949-1953.
[15] HuSW,NiW,HaziW,etal.Cloningand functional analysisofsheep U6 promoters.Anim Biotechnol,2011,22(3):170-174.
[16] 赛务加甫,张立,杨丽,等.山羊-绵羊种间体细胞核移植重构胚构建 [J].西北农林科技大学学报,2006,34(9):17-20
[17] 赛务加甫,彭新荣,李向臣,等.精子提取物对绵羊同异种核移植重构胚的激活效果[J].畜牧兽医学报,2008,39(10),1343-1348.
[18] Chen C,Ridzon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR.Nucleic Acids Res,2005,33(20):e179
[19] Huang J,Wang F,Argyris E,et al.Cellular microRNAs contribute to HIV-1 latency in resting primary CD4(+)T lymphocytes.Nat Med,2007,13:1241-1247.
[20] Hill JR,Long CR,Looney CR,et al.Placental abnormalities in first trimester somatic cell cloned fetuses.Theriogenology,2000,53:218.
[21] Lin J,Shi L,Zhang M,et al.Defects in Trophoblast CellLineage Accountforthe Impaired In Vivo Development of Cloned Embryos Generated by Somatic Nuclear Transfer.Cell Stem Cell,2011,(8)4:371-375.
[22] Mouillet JF,Chu T,Hubel CA,et al.The levels of hypoxia-regulated microRNAs in plasma of pregnant women with fetal growth restriction.Placenta,2010,31:781-784.
[23] Maccani MA,Padbury JF,Marsit CJ.miR-16 and miR-21 expression in the placenta is associated with fetal growth.PLoS ONE,2011,6(6):e21210.

