精液对母兔子宫免疫及孕向发育的影响
刘瑞风,刘新峰,郝志明
(1.天津市神泽农业开发有限公司,天津 301721;2.天津农学院 动物科学系,天津 300384)
与自然本交相比,人工授精和胚胎移植的妊娠成功率和产仔率都还较低,特别是胚胎移植,其妊娠率还有较大的差距,严重影响了其在畜牧生产中的应用,成为胚胎移植技术推广应用的瓶颈。比较自然本交妊娠和胚胎移植妊娠可以发现,在胚胎移植情况下,特别是家畜的胚胎移植,胚胎生长发育的子宫环境常常并未与精液接触。
近年来的研究表明,精液与子宫内膜的接触能够促进胚胎的生长,能够提高母畜的受胎率和产仔数。Carp H J等研究发现,不与结扎输精管的公鼠交配,胚胎移植受体鼠的胚泡着床率会下降,胚胎的发育生长会减缓[1]。在家畜,胚胎移植受体母畜若未与输精管结扎的公畜交配,移植的胚胎虽能正常附植,但胎儿生长和胎盘发育缓慢[2]。另外,Mah J等在进行猪的配种时发现,自然本交的母猪,若再用输精管结扎的公猪交配来补充精浆能够提高母猪的受胎率和产仔数[3]。基于此,本试验拟就精液对兔子宫免疫及孕向发育的影响进行探究,以期揭示接触精液的子宫所发生的形态学和免疫学特性的变化,为提高人工授精和胚胎移植的成功率奠定理论基础。
1 材料和方法
1.1 试验动物
健康的新西兰白兔10只,空怀,体重2.0~2.5 kg,其中母兔8只,公兔2只。试验动物购买后,饲养观察两周再进行试验。试验前和试验期间,试验兔饲养在室温条件下,喂以青草和兔专用配合饲料。
1.2 试验方法
1.2.1 精液的采集
采精时,一手抓住母兔的两耳及颈部皮肤将其保定好,使母兔后躯朝向笼内,另一手将自制假阴道置于母兔两后肢之间,假阴道开口紧贴母兔外阴部,并使假阴道与水平面呈30°。当公兔爬跨母兔并伸出阴茎时,立即将假阴道套于阴茎上。射精时,公兔会尖叫一声倒向一侧,这时应将母兔放开,竖直假阴道,让精液流入集精杯。
1.2.2 母兔诱导发情和诱发排卵
为了模拟发情排卵后母兔的生理状态,试验母兔需进行诱导发情和诱发排卵处理。
诱导发情处理:所用药物为孕马血清(PMSG,宁波市三生药业有限公司产品,批号070108),按照50IU/kg的剂量,于早上6:00~7:00一次颈部皮下注射。
诱发排卵处理:在PMSG注射后约50 h前后,当母兔阴户湿润肿大,阴道黏膜潮红,并接受试情公兔爬跨时,将无菌玻璃棒插入阴道,以此来刺激阴道,诱发排卵。
1.2.3 精液宫内注入手术
诱发排卵处理后4 h进行精液宫内注入手术。手术方法:犬眠宝(0.1 mL/kg)皮下注射麻醉。在最后一对乳头前约1 cm的腹中线处,常规手术方法打开腹壁。当腹壁打开后,小指伸入腹腔,触摸拉出子宫。用缝线结扎两侧子宫颈,以防注入两侧子宫角的液体混合,并以缝线打结方式在一侧子宫角作标记。分别在两侧子宫角注入0.3 mL新鲜精液(试验组)或生理盐水(对照组)。然后将子宫送回腹腔,常规方法缝合腹壁并消毒。
1.3 子宫的采集和分析
1.3.1 子宫大小和重量的测量
精液宫内注入手术后48 h,处死试验兔,完整摘取子宫,去除周围脂肪等组织,拍照。用游标卡尺分别测量两侧子宫角的长度和直径,并分别进行称重。根据体重和子宫角重量,计算子宫角指数。
子宫角指数=一侧子宫角重量(g)/体重(kg)
1.3.2 子宫组织切片制作和观察测定
按常规方法进行制片,并分别进行HE和甲苯胺兰染色。显微镜下利用计算机图像采集系统分别测量子宫壁、子宫肌层、黏膜层、黏膜上皮和腺上皮的厚度以及腺体的周长,计数子宫黏膜单位面积内的血管、腺体和肥大细胞数量。每个切片采集10个视野进行观察和计数,最后算出平均数。
1.3.3 子宫冲洗液体细胞计数和涂片染色观察
自子宫角基部剪断子宫,吸取1 mL无菌生理盐水,从宫管结合部向子宫角基部冲洗子宫腔,收集冲洗液。子宫冲洗液体细胞计数按白细胞计数方法进行。为确定子宫冲洗液中的细胞类型,还进行了涂片姬姆萨染色观察。
1.4 试验数据统计处理
试验数据用样本均数±标准差来表示,并用PSPS11.5统计软件进行差异显著性分析。
2 结果与分析
2.1 精液对子宫免疫的影响
同一子宫的两个子宫角分别注入生理盐水(对照组)和精液后48 h,子宫黏膜内的肥大细胞数分别为3.72±0.04/mm2和2.85±0.05/mm2,精液组子宫黏膜的肥大细胞数明显减少(P<0.05);两子宫角冲洗液中的细胞数也有很大差异,对照组为8.87±0.36×109/L,精液组为53.3±4.03×109/L,精液组极显著高于对照组(P<0.01),详见表1。子宫冲洗液涂片染色检查发现,子宫冲洗液细胞主要为嗜中性粒细胞。

表1 精液对子宫黏膜肥大细胞数及子宫冲洗液体细胞数的影响
2.2 精液对子宫孕向发育的影响
2.2.1 对子宫大小和子宫角指数的影响从表2看,宫内注入精液可使子宫角指数明显增加(P<0.05),子宫角长度显著延长(P<0.05),子宫角明显增粗(P<0.05)。
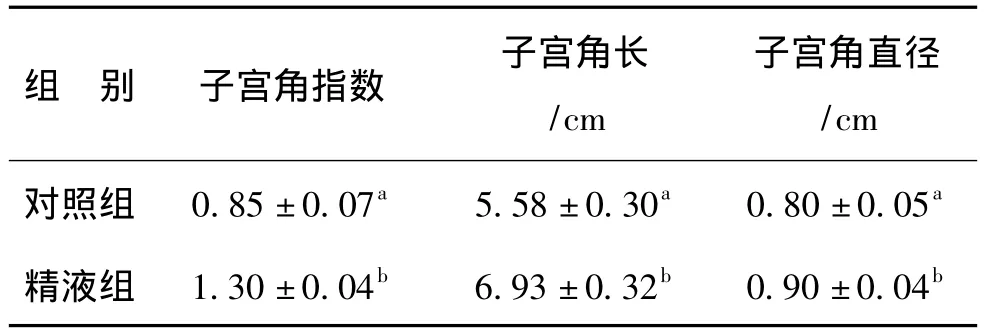
表2 精液对子宫角指数、长度及直径的影响
对照组子宫角指数、子宫角长和子宫角直径分别为 0.85±0.07 cm、5.58±0.30 cm和0.80 ±0.05 cm,而精液组则分别为1.30±0.04 cm、6.93±0.32 cm和0.90±0.04 cm。
2.2.2 对子宫壁、黏膜层、黏膜上皮层和肌层厚度的影响

表3 精液对子宫壁、黏膜层、黏膜上皮层及肌层厚度的影响
子宫注入精液后48 h,子宫壁、黏膜层、黏膜上皮层和肌层的厚度分别达到1.92±0.03 mm、1.51±0.02 mm、2.06±0.02 μm和0.29±0.06 mm。与对照组相比,子宫壁及黏膜层的厚度显著增加(P<0.05),黏膜上皮层的厚度极显著增加(P<0.01),子宫肌层的厚度虽有增加但差异不显著(P﹥0.05),详见表3。
2.2.3 对黏膜腺体和血管的影响

表4 精液对子宫黏膜腺体数、腺上皮厚、腺体周长以及血管数的影响
由表4可见,子宫注入精液后,每平方毫米子宫黏膜内的腺体数量较对照组明显增加(P<0.05),达11.75±0.27个;腺上皮厚度较对照组显著增加(P<0.05),达1.65±0.03 μm;腺体周长与对照组比较则没有明显差异(P﹥0.05)。另外,每平方毫米子宫黏膜内的血管数精液组较对照组也有明显增加(P<0.05)。
3 讨论
3.1 精液对子宫免疫的影响
在整个妊娠期,小鼠和田鼠子宫壁内肥大细胞的数量都呈先减少后增加的变化,据认为,这种变化与胚泡的附植有关[4]。胚泡植入子宫壁时肥大细胞数量减少,可使子宫局部免疫水平暂时低下,从而使具有父方抗原特征的胚泡不被排斥,可能是胚泡不被母体排斥的免疫学机制之一。本试验就精液对子宫壁肥大细胞数量的影响也进行了研究。结果表明,兔的精液也可明显降低母兔子宫壁肥大细胞数量,生理盐水组子宫壁肥大细胞数为3.72±0.04个/mm2,而精液组只有2.85±0.05个/mm2。另外,从我们的试验看,妊娠早期母兔子宫肥大细胞数量的减少可能是从子宫接触精液开始的,精液有可能是子宫肥大细胞减少的启动物。
交配后白细胞迁移进入子宫腔是精子上行过程中的重要组成部分[5,6]。许多研究显示,猪交配后精液可诱导子宫发生炎症反应,可使大量多核嗜中性粒细胞(PMN)进入子宫腔[6]。在母马也有类似现象[7]。与上述研究结果相似,本试验在兔同一子宫的两侧子宫角分别注入精液和生理盐水后,注入精液侧的子宫角腔冲洗液中的细胞数极显著高于对照子宫角腔冲洗液中的细胞数;对子宫冲洗液细胞涂片染色检查发现,其中主要也是嗜中性粒细胞。
3.2 精液对子宫孕向发育的影响
我们知道,动物发情排卵后,残留的卵泡发育转变为黄体,使子宫由雌激素诱导下的发育转变成由孕酮诱导下的发育,从而导致子宫的组织结构发生一系列变化。这些变化主要表现为子宫黏膜上皮的生长;子宫腺的增生,腺体的弯曲和分支增多,分泌物增加;以及子宫颈的收缩等[8]。子宫的这种在孕酮作用下的发育就叫孕向发育。
在发情排卵时通过自然本交或人工授精输入雌性生殖道的精液对妊娠有什么作用已有一些报道。在猪,自然交配的同时给母猪输入精浆可使母猪的产仔率由70%提高到80%,即使在既进行人工授精又进行自然本交的母猪,若再输入精浆也能提高产仔率和产仔数[9]。对生殖道遭受过感染的雌性动物,人工授精时增加精浆输入量可提高这些动物的妊娠率和产仔率[10]。在家畜,胚胎移植受体母畜若未与输精管结扎的公畜交配,移植的胚胎虽能正常附植,但胎儿生长和胎盘发育缓慢[2]。另外在大鼠和小鼠的研究也表明,胚胎移植受体动物子宫在移植前与精浆接触,能促进胚胎的卵裂和胚泡的附植,能提高胚胎和胎儿的发育速度,减少流产和畸形胎儿的产生[11,1]。可以推测,精浆的这些作用肯定是对子宫原有的孕向发育产生影响,从而改变了胚胎发育赖以生存的子宫内环境所致。
精液对子宫的孕向发育到底有什么样的影响,我们还未见到一篇有关的报道。从本研究的试验结果来看,精液注入48 h后,可以显著增加子宫的大小;可明显增加子宫壁、黏膜层和黏膜上皮层的厚度;可明显增加黏膜中腺管和血管的数量,可显著增加腺上皮的厚度。
[1] Carp H J,Serr D M,Mashiach S,et al.Influence of insemination on the implantation oftransferred rat blastocysts [J].Gynecol Obstet Invest,1984,18:194-198.
[2] Bromfield J J,Roberts C T,Robertson S A.Seminal plasmaprograms uterine receptivity and pregnancy outcome[J].Biol Reprod,2004,17:94.
[3] Mah J,Tilton J E,Williams G L et al.The Effect of repeated mating atshortintervals on reproductive performance of gilts [J].Anim Sci,1985,60:1052-1054.
[4] Deng-ZP.Quantitative studies on mast cells and histamine in the endometrium of cow and sheep [J].China Vet Sci,1994,1:50.
[5] Lovell J W,Getty R.Fate of semen in the uterus of the sow:histologic study of endome-trium during the 27 hours after natural service [J].American Journal of Veterinary Research,1968,29:609-625.
[6] Rozeboom K J, Tredsson M H, Crabo B G.Characterization of uterine leukocyte infiltra -tion in gilts after artificial insemination [J].Reprod Fertil,1998,114:195-199.
[7] Alghamdi A S,Foster D N,Troedsson M H T.Equine seminal plasma reduces sperm bind - ing to polymorphonuclear neutrophils(PMNS)and improves the fertility of fresh semen inseminated into inflamed uteri.Reprodution,2004,127:593-600.
[8] 赵兴绪.兽医产科学 [M].北京:中国农业出版社,第三版,2002:77.
[9] Flowers W L,Esbenshade K L.Optimizing management of natural and artificial matings in swine [J].Reprod Fertil,1993,48:217-228.
[10] Rozeboom K J,Tredsson M H,Hodson H H,et al.The importance of seminal plasma on the fertility of subsequent artificial inseminations in swine[J].Anim Sci,2000,78:443-448.
[11] Watson J G,Carroll J,Chaykin S.Reproduction in mice:The fate ofspermatozoa notinvolved in fertilization [J].Gamete Res,1983,7:75-84.

