NDRG4基因甲基化检测在结直肠癌早期诊断中的应用研究
赵慧霞 李秋文 董伟伟 段昕妤 朱建华 王如良 郝怡鑫 叶 明 肖文华
解放军总医院第一附属医院肿瘤科,北京 100048
NDRG4(N-myc downstream-regulated gene 4)为抑癌基因NDRG基因家族成员[1],该基因家族在人体多种其他正常组织中高表达,在某些肿瘤组织中不表达或低表达,低表达则可能与启动子高甲基化相关。大肠癌(colorectal cancer,CRC)是临床最常见的恶性肿瘤之一[2-3],在我国其发病率呈上升态势,且晚期患者预后很差,5年总体生存率不到 15%,然而有关NDRG4基因与启动子甲基化状态在结直肠癌中的作用尚未得到阐明[4]。DNA甲基化常常是肿瘤发生发展过程中的早期事件,因此,特异基因的甲基化可作为肿瘤早期诊断的分子标志物。近年来研究认为NDRG4基因存在于CRC肿瘤组织和体液中,且可能具有稳定性高、可重生性,这为提高CRC的早期筛查[5-6]、早期诊断提供了一个全新的视角。本研究采用巢式甲基化特异性PCR(nested methylation specific PCR,nMSP)检测结直肠癌血、尿、粪便NDRG4基因启动子区甲基化状态。比较结直肠癌组织与粪便、尿、血中的NDRG4甲基化在早期诊断中的敏感性和特异性及其与结直肠癌临床病理特征之间的关系,以探讨其在结直肠癌早期诊断中的应用价值。
1 材料与方法
1.1 材料
1.1.1 标本收集
取我院普外科2010年6月~2011年8月手术切除的84例患者的结直肠癌、癌旁组织,均经病理证实;年龄为36~81岁,平均年龄53岁。并同期选择相匹配的正常对照者30例(腹股沟疝患者和下肢静脉曲张患者)。全部受检者空腹抽血2 mL,EDTA-2Na 抗凝;同时留取晨尿 50~100 mL,粪便 100~200 mg,血、尿液、粪便标本于手术前收集,收集后30 min内送实验室。血、尿液、粪便立即提取基因组DNA,置于-20℃冻存备用。大肠癌患者术后立即取材,癌组织、癌旁组织标本,分装并-80℃保存。所有患者在术前均未接受过化疗、放疗及免疫治疗,所有研究对象均知情同意并签署知情同意书。
1.1.2 主要试剂与仪器
组织DNA提取试剂盒:组织基因组DNA提取试剂盒(天根公司);粪便DNA提取试剂盒:stool DNA Extraction Kit(Bioneer公司);血DNA提取试剂盒:天根全血基因组DNA提取试剂盒、血浆游离DNA纯化试剂盒(天根公司);尿液DNA提取试剂盒:尿液基因组DNA快速提取试剂盒;亚硫酸盐处理试剂 :Wizard DNA Clean-up system、EZ DNA Methylation TM-Direct Kit(Promega 公司);X-SssⅠ内 切酶(英国NEB公司);对亚硫酸氢盐转化的DNA进行全基因组扩增试剂盒:EpiTect Whole Bisulfitome Kit(德国Qiagen公司);PCR 扩增试剂:HotstarTaq DNA polymerase(德国 Qiagen公司)。
1.2 实验方法
1.2.1 基因组DNA的提取
1.2.1.1 组织DNA的提取 先将组织在液氮中研碎,再加入DNA提取缓冲液和蛋白酶K,于37℃消化直至液体变得清亮,然后参照说明书用饱和苯酚/氯仿溶液常规提取DNA。最后用紫外分光光度仪检测纯度及含量。
1.2.1.2 血浆、尿液、粪便DNA的提取 操作步骤按说明书进行。DNA抽提后用紫外分光光度仪检测纯度及含量。
1.2.1.3 全血DNA的提取 用天根生化的全血基因组DNA提取试剂盒提取正常人外周血样本中基因组DNA,操作步骤按说明书进行。提取DNA后用SssⅠ处理的正常人淋巴细胞基因组作为阳性对照,未经处理的淋巴细胞基因组作为阴性对照。
1.2.2 基因组DNA的亚硫酸氢盐修饰
组织基因组DNA参照Wizard DNA Clean-up system试剂盒进行修饰;血、尿、粪便基因组DNA的亚硫酸氢钠修饰:参照EZ DNA Methylation TM-Direct Kit试剂盒说明书进行。
1.2.3 MDA对亚硫酸氢盐转化的DNA进行全基因组扩增
使用EpiTect Whole Bisulfitome Kit扩增试剂盒进行全基因组扩增,即取5 μL亚硫酸氢钠修饰的DNA,加入5 μL灭菌水,再加入在冰上配制的1 μL REPLI-g Midi DNA polymerase和 29 μL EpiTect WBA Reaction Buffer反应混合液,振荡混匀,在28℃等温全基因组扩增反应8 h,然后95℃5 min终止反应,4℃保存。
1.2.4 巢式甲基化特异性PCR和电泳分析
NDRG4引物设计参考文献[7];引物序列、退火温度和扩增产物长度(表1);引物由上海生工生物工程有限公司合成。 PCR 体系包含 10 × Buffer 2.5 μL,TaqDNA 聚合酶 0.2 μL,dNTP 2 μL,一对外侧上下游引物各1 μL,MDA扩增的基因组DNA 2 μL,Mg2+0.5 μL,灭菌用水 15.8 μL。 同时设立阳性对照、阴性对照和空白对照。外侧PCR循环参数:95℃15 min,95℃ 30 s,56℃ 30 s,72℃ 30 s,以上步骤共 25 个循环,72℃延伸7 min。第二轮PCR使用两对内侧引物分别扩增,25 μL PCR 体系:10 × Buffer 2.5 μL,TaqDNA 聚合酶 0.2 μL,dNTP 2 μL,甲基化和未甲基化上、下游引物各 1 μL,外侧 PCR的扩增产物 2 μL 为模板,Mg2+0.5 μL,灭菌用水 15.8 μL。内侧PCR 循环参数:95℃ 15 min,95℃ 30 s,66℃ 30 s,72℃ 30 s,以上步骤共35个循环,72℃延伸7 min。经上述两次PCR扩增后,将5 μL PCR产物于2%琼脂糖凝胶上进行电泳,用凝胶成像系统观察结果并拍照。

表1 NDRG4基因的巢式甲基化特异性PCR引物序列
1.3 统计学方法
采用统计软件SPSS 16.0对实验数据进行分析,计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌和癌旁组织NDRG4基因甲基化变化
在84例结直肠癌组织中,NDRG4基因甲基化发生率81.0%(68/84),而癌旁组织为 8.3%(7/84);用于结直肠癌的组织学诊断的敏感性为81.0%(68/84),特异性则为91.7%(77/84)。
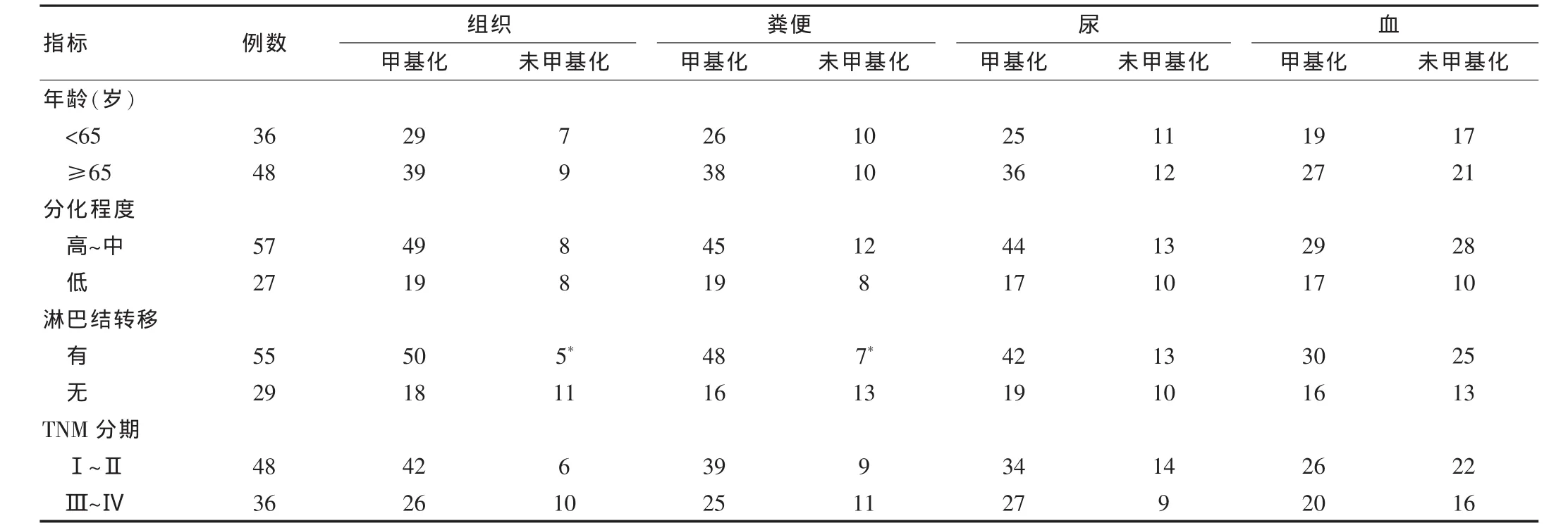
表2 NDRG4甲基化与结直肠癌临床特征的关系
2.2 结直肠癌组织和粪便中NDRG4甲基化与临床病理特征的关系
NDRG4甲基化与年龄、分化程度及TNM分期均无关,而与肿瘤的淋巴结转移有关,即有淋巴结转移的肿瘤组织和无淋巴结转移的肿瘤组织粪便中的NDRG4表达差异有统计学意义(P < 0.05)。 见表2。
2.3 结直肠癌组织、粪便、尿、血中NDRG4基因甲基化比较
NDRG4基因甲基化检测的敏感度、特异度分别为:血54.8%和 78.1%;尿 72.6%和85.0%;便 76.2%和 89.1%;组织81.0%和91.7%。在本研究分析的3个微量DNA标本中,粪便和尿液基因甲基化诊断CRC的敏感度较高,特异性也较高,而血的特异性和敏感度较低(图1)。因此基因甲基化检测用于临床时,需要联合检测尿、便基因,以保证诊断敏感度及特异度均达到较高水平。

图1 nMSP检测结直肠癌组织和粪便、尿、血NDRG4基因甲基化
3 讨论
DNA序列测定表明,NDRG4基因长32 kb,由17个外显子及16个内含子组成[8]。既往研究已证实NDRG4在成年人心、脑中表达明显高于胎儿,提示NDRG4与心、脑发育有关。虽然在肿瘤中的作用还不清楚,但大量研究表明该基因与肿瘤细胞的生长、分化和转移可能有一定关系。其基因5′端调控区域含有CpG岛,在结直肠癌发生发展过程中常常被甲基化,NDRG4基因甲基化被认为是结直肠癌的重要生物学特征。Veerle等[7]最近发现NDRG4是候选肿瘤抑制基因和直肠癌的潜在生物标志物,NDRG4启动子的甲基化可作为生物标志物,用于粪便样品检测直肠癌,敏感性为61%,特异度为93%。本实验利用巢式甲基化特异性PCR(nMSP)检测NDRG4甲基化状态,在84例结直肠癌组织中,NDRG4基因甲基化发生率81.0%(68/84),而癌旁组织为8.3%(7/84);诊断的敏感性为81.0%,特异性则为91.7%。在本研究分析的粪便、尿、血3个微量DNA标本中,粪便和尿液基因甲基化诊断CRC的敏感度、特异性较高;而血的特异性和敏感度较低。
虽然肿瘤细胞可以释放许多游离DNA到外周血、尿液中,但与肿瘤组织样品相比,外周血血清样品中DNA的量仍然是较低的(ng级),加之在用NaHSO3,修饰的过程中大部分DNA将被降解,因此,对于微量DNA样品,普通MSP法的灵敏度仍需进一步提高。本实验采用的MDA技术检测NDRG4甲基化状态,具有扩增效率高,保真性能好的优势,是一种新兴的全基因组扩增技术,适合低含量肿瘤样本甲基化状态检测。
对NDRG4基因启动子区甲基化水平进行检测,发现该检测CpG位点肿瘤样本组织和对应的癌旁样本组织甲基化率分别为81.0%和8.3%,由于所取癌旁样本不是正常结直肠粘膜组织,发生一定程度甲基化,提示甲基化作用可能与结直肠癌发生密切相关。同时发现该检测CpG位点的甲基化率在年龄、分化程度及TNM分期差异均无显著性,说明甲基化与结直肠癌的发展过程中并非起主要作用,可能只在结直肠癌的发生早期发挥作用。
本实验利用巢式甲基化特异性PCR(nMSP)检测NDRG4甲基化状态,结直肠癌粪便中的甲基化的敏感度为76.2%,特异度为89.1%;尿液敏感度72.6%,特异度85.0%,这说明粪便和尿液中的NDRG4甲基化有极大可能被作为早期检测结直肠癌的非侵入性生物标志物。且NDRG4无论来源于尿液还是粪便样本,均易于采集,稳定性强,不易被降解,重复性及特异性高,使得其有很大可能成为临床诊断的敏感指标。因此,本研究结果有望能够丰富结直肠癌的发病机制并为将来临床上将NDRG4甲基化在结直肠癌中作为一个新的诊断靶点提供一定理论基础。
[1]陈杰,张翊,饶春明,等.NDRG4基因的克隆、表达及抑瘤活性研究[J].中国生化药物杂志,2006,27(3):137-141.
[2]Jemal A,Siegel R,Ward E, et al.Cancer statistics [J].CA Cancer J Clin,2007,57(1):43-66.
[3]Wang YG,Chen KX,Wu G,et al.An analysis:colon cancer mortality in Tianjin, China from 1981 to 2000 [J].World J Gastroenterol,2005,11(6):895-898.
[4]杨锦雷,常家聪,刘弋,等.NDRG2和NDRG4在直肠癌组织中的表达及临床意义[J].安徽医科大学学报,2011,46(10):1047-1049.
[5]Zou H,Harrington J,Rego RL,et al.A novel method to capture methylated human DNA from stool:implications for colorectal cancer screening[J].Clin Chem,2007,53(9):1646-1651.
[6]Ahlquist DA,Sargent DJ,Loprinzi CL,et al.Stool DNA and occult blood testing for screen detection of colorectal neoplasia[J].Ann Intern Med,2008,149(7):441-450.
[7]Veerle M,Marjolein HF,Lentjes M,et al.N-Myc downstream-regulated gene 4(NDRG4):A candidate tumor suppressor gene and potential biomarker for colorectal cancer[J].J Natl Cancer Inst,2009,101(13):916-27.
[8]周瑞海,小龟浩市,高海青,等.视黄酸对心、脑特异性基因NDRG4在NT2神经元前体细胞中表达的影响[J].中华老年医学杂志,2003,22(12):735-737.

