端粒DNA形成不同构象的关键因素
武宇亭 张文梅 李小卫 赵红卫
1(山西大学物理电子工程学院 现代通信技术研究所 太原 030006)
2(上海交通大学上海系统生物医学中心教育部系统生物医学重点实验室 上海 200240)
3(中国科学院上海应用物理研究所 上海 201800)
端粒是真核细胞内线状染色体末端的一种特殊结构,由 DNA简单重复序列以及与序列专一性结合的蛋白质构成。端粒对染色体有保护作用,避免染色体末端融合、重组。人体端粒 DNA含有大量的重复单元,它们有双链,也有单链形式。在富G(鸟嘌呤)单链中,G和 G间可通过氢键、阳离子偶极作用和范得华力形成 G-四聚体(G-quartet)平面结构,各G-quartet平面相互堆积便形成G-quadruplex结构[1,2]。与其互补的单链为富C(胞嘧啶)序列,通过C碱基的半质子化,C+•C碱基对形成稳定的平行双螺旋,两个平行双螺旋 C+•C碱基对交替排列和相互嵌入形成 I-motif结构[3–5]。研究表明,正常细胞每次分裂会损失50–200个端粒DNA核苷酸,当端粒 DNA的长度减至足够短时,细胞开始衰老和死亡[6]。与正常细胞不同,85%–90%的癌细胞中高活性端粒 DNA酶能不断合成细胞分裂后损失的端粒DNA,从而使癌细胞无限制的分裂和繁殖。据文献[7],可通过蛋白适配复合体来抑制DNA的复制。近年来发现,富G序列形成的G-quadruplex结构能影响端粒酶的活性,也可抑制癌细胞分裂,因此,研究端粒 DNA G-quadruplex的形成对癌症治疗具有重要意义[8]。
相比于G-quadruplex,人们对I-motif的了解不足,但其与人体端粒DNA、着丝粒DNA、RNA夹层结构的相互作用及与某些蛋白结合,都表明I-motif有重要的生物作用。I-motif也可与G-quadruplex一样作为抗癌药物的作用靶点,其研究具有有重要的生物医学意义[4]。
人们用核磁共振(Nuclear Magnetic Resonance)、圆二色谱(Circular Dichroism Spectrum)、凝胶电泳等方法研究了G-quadruplex、I-motif的形成条件及其稳定性[9–13],但对富C和富G序列共存条件下结构特征的报道并不多见。由不对称分子组成的物质对左、右旋束圆偏振光吸收程度不同,这种吸收程度的不同与波长的关系称圆二色谱。本文用圆二色谱考察了不同单链分别形成四链体的关键影响因素,并研究了两单链混合时的结构特征。结果表明,在dAG3(T2AG3)3和 d(C3TA2)3C3T的混合溶液中很容易形成duplex结构,但去除对duplex结构有稳定作用的离子后则形成G-quadruplex、I-motif混合状态。
1 材料和方法
1.1 样品制备
由生工生物工程(上海)公司提供的寡核糖核酸5'-AGGGTTAGGGTTAGGGTTAGGG-3'及其互补链 5'-CCCTAACCCTAACCCTAACCCT-3', 经ULTRAPAGE纯化,并由质谱检测,分子量误差≤0.1%,其纯度达实验要求。将寡核糖核酸溶于去离子超纯水,测试样品浓度为 50 μg/mL(约 2.5 mmol/L),由HCl/NaOH调节溶液pH值,测试样品中 Na+离子浓度为 50 mmol/L,所用 EDTA 为 1 mmol/L。
1.2 CD谱实验
实验所用圆二色光谱仪为日本分光公司JASCO J-815,采用1 mm样品池,扫描范围320–200 nm,扫描速度100 nm/min,步长1 nm。测定温度为20ºC,以同种离子条件缓冲液作参比。
2 结果与讨论
2.1 dAG3(T2AG3)3与金属离子
图1为 dAG3(T2AG3)3在不同缓冲液中的 CD谱。溶于去离子超纯水未添加其它试剂的样品在235 nm处有一负峰,在255 nm和295 nm处各有一正峰,表明dAG3(T2AG3)3以单链形式存在。pH值为7的纯水时,在240 nm附近有一负峰,在265 nm附近有一很小的正峰,同时在295 nm附近形成一个较强的正峰,对应于正平行G-quadruplex结构。这与文献报道一致[11,14,15]。文献[14]也提到 K+离子能促使这种结构的稳定。将dAG3(T2AG3)3溶于NaCl溶液中并调节溶液呈中性,dAG3(T2AG3)3会在295 nm处形成一正峰,在265 nm处形成一负峰,这与反平行G-quadruplex结构的CD谱特征峰相符。
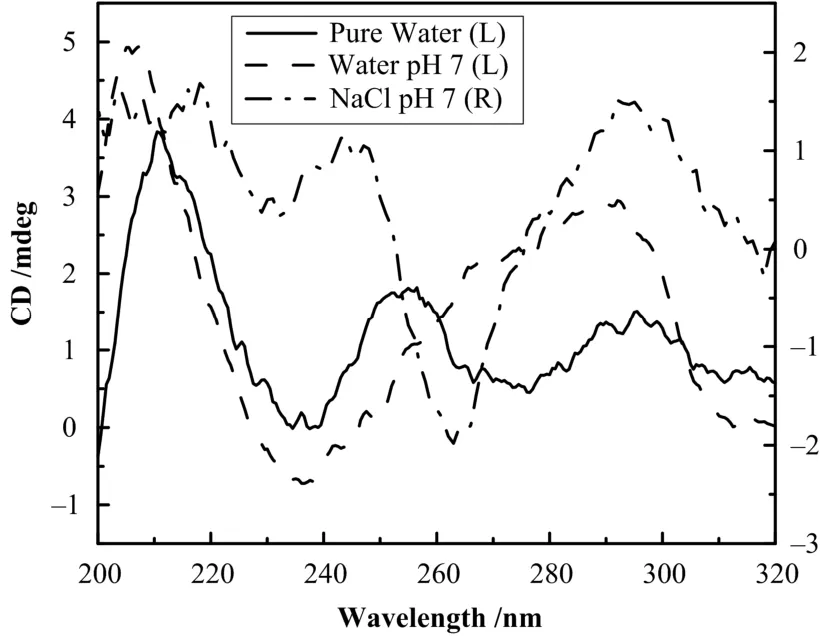
图1 dAG3(T2AG3)3溶于纯水、pH 7水、50 mmol/L NaCl溶液中的CD谱Fig.1 CD spectra of dAG3(T2AG3)3 in pure water, water at pH 7, and 50 mmol/L NaCl solution.
研究表明,溶液中的 Na+离子会促使dAG3(T2AG3)3从正平行转换到反平行四链体结构。这可能是由于正反平行四链形成的G-quadruplex中间孔径大小不同,不同半径的离子会促使不同结构的稳定,Na+离子与碱基中负性氧原子相互配位,从而促使反平行 G-quadruplex结构的形成和稳定[11]。文献[16]认为与金属离子的脱水自由能有关。但可以肯定的是在这个过程中伴随有氢键的断裂和重组以及糖苷键角的变化[15]。
2.2 dAG3(T2AG3)3与溶液pH
图2为dAG3(T2AG3)3形成构象与溶液pH的关系。将dAG3(T2AG3)3溶于纯水,在不同pH下,都形成了正平行G-quadruplex结构。将dAG3(T2AG3)3溶于 NaCl溶液,在不同的 pH下形成了反平行G-quadruplex结构。表明溶液 pH对正反平行G-quadruplex结构影响较小。结果与文献[14]报道相符,但文献[15]中指出pH会影响G-quadruplex结构的稳定性,在 pH=6.5时,其结构最为稳定,过酸过碱都会使G-quadruplex结构遭到破坏。

图2 dAG3(T2AG3)3溶于pH 4.5和7.0的纯水及pH 4.5和7.0的50 mmol/L NaCl溶液中的CD谱Fig.2 CD spectra of dAG3(T2AG3)3 in water at pH 4.5 and 7.0, and in 50 mmol/L NaCl at pH 4.5 and 7.0.
2.3 d(C3TA2)3C3T与溶液pH
图3是d(C3TA2)3C3T在不同溶液环境下形成的构象。将d(C3TA2)3C3T溶于pH 4.5的NaCl溶液,在255 nm处呈现一负峰,在284 nm处有一正峰,对应于I-motif结构。在NaCl溶液中,当pH=7时,正负峰均产生红移,分别位于250、275 nm,核磁共振实验已证实,此时并未形成I-motif结构[9],这些峰对应于单链结构。说明d(C3TA2)3C3T是否形成I-motif主要受溶液pH影响,而与金属Na+关系不大,与文献[14]结论相符。d(C3TA2)3C3T溶于纯水CDS正负峰的位置与在pH 4.5的NaCl溶液中一致,说明纯水中也形成了 I-motif结构,这是由于d(C3TA2)3C3T溶于水中使溶液呈酸性的缘故。

图3 d(C3TA2)3C3T纯水溶液和pH 4.5与pH 7.050 mmol/L NaCl溶液的CD谱Fig.3 CD spectra of d(C3TA2)3C3T in pure water,and in 50 mmol/L NaCl solution at pH 4.5 and 7.0.
2.4 dAG3(T2AG3)3/d(C3TA2)3C3T等摩尔混合
将等摩尔的单链 dAG3(T2AG3)3和d(C3TA2)3C3T溶于NaCl溶液,获CD光谱(图4)。

图4 dAG3(T2AG3)3、d(C3TA2)3C3T等摩尔混合溶于50 mmol/L NaCl溶液( pH 4.5)和不同pH值添加EDTA的CD谱Fig.4 CD spectra of the equimolar mixture of dAG3(T2AG3)3 and d(C3TA2)3C3T in 50mmol/L NaCl solution at pH 4.5 or 7, and with EDTA added at pH 4.5.
当pH为4.5或7时,在265 nm处均有一个正峰,这是由于双螺旋DNA碱基的堆积,而240 nm的负峰对应于DNA 双螺旋B型构象[17]。然而加入EDTA后,在288 nm附近形成一个正峰,表明双螺旋结构发生某种转变。文献[14]中提到在Na+及酸性的溶液中,会发生duplex和G-quadruplex、I-motif的竞争,三种结构会并存。但当其中含有Mg2+时,由于 Mg2+有稳固 duplex破坏四链体结构的作用,则仅有duplex结构。本研究中,可能所购DNA引物中含微量 Mg2+,使 duplex的形成有一定优势,这样就呈现出duplex特征谱。
图5为将此 CD谱与 G-quadruplex、I-motif、duplex的CD谱进行对比,288 nm的正峰恰好位于I-motif 285 nm及G-quadruplex 294 nm两正峰间,而 255 nm的负峰也恰好位于 I-motif 250 nm及G-quadruplex 263 nm两负峰间。因此可推断两单链等摩尔混合及含有EDTA时未形成duplex结构,而是分别形成四链体结构,所得 CD谱中的峰是G-quadruplex、I-motif CD谱中峰的叠加。这是由于EDTA可以螯合溶液中微量 Mg2+离子,从而破坏duplex使单链分别形成了四链结构。

图5 pH为4.5的50 mmol/L NaCl溶液中dAG3(T2AG3)3(22AG)、d(C3TA2)3C3(22CT)及其等摩尔混合液和加入EDTA的CD谱Fig.5 CD spectra of dAG3(T2AG3)3(22AG),d(C3TA2)3C3(22CT) and equimolar mixture with EDTA in 50 mmol/L NaCl at pH 4.5.
3 结语
本文利用圆二色谱研究了单链 dAG3(T2AG3)3和d(C3TA2)3C3T及其混合溶液形成不同构象的主要影响因素。研究结果表明,dAG3(T2AG3)3很容易形成正平行G-quadruplex结构,当溶液中含有Na+离子时形成反平行G-quadruplex结构,而pH值对于这种构象的改变影响甚微。d(C3TA2)3C3T形成四链则主要受pH值影响,其在酸性条件下形成I-motif结构。等摩尔dAG3(T2AG3)3和 d(C3TA2)3C3T的混合溶液中容易形成duplex双螺旋结构,加入EDTA螯合溶液中稳定 duplex的离子后则形成G-quadruplex、I-motif混合状态。
1 Xue Y, Kan Z Y, Wang Q,et al. Human telomeric DNA forms parallel-stranded intramolecular G-quadruplex in K+solution under molecular crowding condition[J]. J Am Chem Soc, 2007, 129(36): 11185–11191
2 Skolakova P, Bednarova K, Vorlickova M,et al.Quadruplexes of human telomere dG(3)(TTAG(3))(3)sequences containing guanine abasic sites[J]. Biochem Biophys Res Commun, 2010, 399(2): 203–208
3 Pasternak A, Wengel J. Modulation of I-motif thermodynamic stability by the introduction of UNA(unlocked nucleic acid) monomers[J].Bioorg Med Chem Lett, 2011, 21(2): 752–755
4 Li X, Peng Y H, Ren J S,et al. Carboxyl-modified single-walled carbon nanotubes selectively induce human telomeric I-motif formation[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(52): 19658–19663
5 Moyzis R K, Buckingham J M, Cram L S,et al. A Highly conserved repetitive DNA-sequence, (Ttaggg)N, present at the telomeres of human-chromosomes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(18): 6622–6626
6 Greider C W. Telomerase activity, cell proliferation, and cancer[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(1):90–92
7 Zhu C F, Wen Y Q, Li D,et al. Inhibition of the in vitro replication of DNA by an Aptamer-protein complex in an autonomous DNA machine[J]. Chem Eur J, 2009, 15:11898–11903
8 Hurley L H. Secondary DNA structures as molecular targets for cancer therapeutics[J]. Biochem Soct,2001, 29:692–696
9 Phan A T, Mergny J L.Mergny, Human telomeric DNA:G-quadruplex, I-motif and Watson±Crick double helix[J].Nucleic Acids Research, 2002, 30(21): 4618–4625
10 Shi S, Zhao J, Geng X T,et al. Molecular "light switch"for G-quadruplexes and I-motif of human telomeric DNA:[Ru(phen)(2)(dppz)](2+)[J]. Dalton T, 2010, 39(10):2490–2493
11 Zhang X Y, Cao E H, Sun X G,et al. Circular dichroism spectroscopic studies on structures formed by telomeric DNA sequencesin vitro[J]. Chinese Sci Bull, 2000,45(21): 1959–1963
12 Renciuk D, Kejnovska I, Skolakova P,et al.Arrangements of human telomere DNA quadruplex in physiologically relevant K(+) solutions[J]. Nucleic Acids Research, 2009, 37(19): 6625–6634
13 Tomasko M, Vorlickova M, Sagi J. Substitution of adenine for guanine in the quadruplex-forming human telomere DNA sequence G(3)(T(2)AG(3))(3) [J].Biochimie, 2009, 91(2): 171–179
14 Li W, Wu P, Ohmichi T,et al. Characterization and thermodynamic properties of quadruplex/duplex competition[J]. Febs Letters, 2002, 526(1-3): 77–81
15 周江, 袁谷.溶液 pH和阳离子对端粒 G-四链体 DNA形成和结构的影响[J]. 化学学报, 2007, 65(16):1728–1732 ZHOU Jiang, YUAN Gu. Effect of pH and cations on the formation and structure of human telomeric G-quadruplex DNA[J]. Acta Chimica Sinica, 2007, 65(16): 1728–1732
16 Hud N V, Smith F W, Anet A L,et al. The selectivity for K+versus Na+in DNA quadruplexes is dominated by relative free energies of hydration: A Thermodynamic Analysis by1H NMR†[J]. Biochemistry, 1996, 35(48):15383–15390
17 卜晓阳, 吴敏, 周家宏, 等.光谱法研究有机农药污染物与 DNA的相互作用[J]. 应用化学, 2011, 28(4):458–463 BO Xiaoyang, WU Min, ZHOU Jiahong,et al.Spectrometric study on the interactions between organic pesticide pollutants and DNA[J]. Chinese Journal of Applied Chemistry, 2011, 28(4): 458–463

