短暂UV-B 辐射对玉米幼苗生理生化指标的影响
赵长江 ,李佐同 ,胡雪微 ,刘鑫 ,黄寿光 ,张海燕 ,王玉凤 ,杨克军
(1.黑龙江八一农垦大学农学院,大庆163319;2.黑龙江省教育厅寒地作物种质改良与栽培重点实验室)
紫外辐射(Ultraviolet,UV)是到达地表的太阳光的一部分,UV 光谱区传统上可以分为三部分:UV-A(320~400 nm),UV-B(280~320 nm),UV-C(小于280 nm)。在这三部分光谱中,平流层臭氧吸收波长低于290 nm 的UV 辐射,使之无法到达地表,所以只有UV-A 和长波UV-B 具有生物学重要性。环境UV-B 水平是易变的,受到多种因素的影响,尤如纬度、季节、影响太阳高度角的日长和海拔,尤其是大气层的厚度。加之氯氟烃的释放导致臭氧层的变薄,导致局部地区UV-B 辐射增强。大气中的臭氧浓度每减少1%,到达地面的生物有效UV-B 辐射增加2%[1]。植物需要利用太阳光能进行光合作用,因而不可避免地受到UV-B 辐射的影响,在一定程度上与其他环境因子协同影响植物[2]。UV-B 辐射的增加,会导致植物的生长发育和生理生化过程发生一系列的变化[3],如抑制植物的色素合成与光合作用,并引起膜质过氧化加重,使植物的形态、季相、生物量积累发生变化[4]。与动物相比,对于植物而言UV-B 辐射不仅仅是逆境信号,也是一种环境因子调控生长和发育,如调节植物伸长生长和向光性[5-6]。
已有研究表明增强的UV-B 辐射影响玉米的生长发育、产量品质、光合作用和呼吸作用[7-13],上述研究多是从生态学的角度研究UV-B 对玉米的影响。尽管,王芳等[14]研究了短暂UV-B 辐射与干旱复合胁迫下玉米的生理生化变化,但是玉米对短暂单一UV-B 辐射响应的生理生化变化研究较少。研究分析玉米幼苗对短暂UV-B 辐射响应的生理生化变化,有助于揭示UV-B 作为光信号在植物生长发育过程中的作用和机制研究。
1 材料与方法
1.1 玉米种植和处理
玉米杂交种垦玉7(黑龙江八一农垦大学农学院玉米研究室自主培育),选取饱满度一致,大小均匀的玉米种子用2%的次氯酸钠溶液消毒10 min,用清水冲洗3~5 遍后于25℃培养箱保湿催芽1~2 d。然后播种于9 cm 直径的小钵内(营养土与蛭石比例约为 3∶1),置于植物生长室(昼/夜时长为 12 h/12 h,温度25℃/18℃,光照强度为12 Klux)培养至三叶一心进行逆境处理。
选择长势一致的玉米幼苗进行短暂UV-B 辐射处理,将UVB313 紫外灯管(美国,Q-LAB 公司)悬挂于幼苗上方 0.5 m 的距离,光强为 1.28 μmol ·(m2 ·s)-1,辐射处理30 min,处理后置于种植幼苗的生长室进行恢复并取样,每次取样时剪取两株苗的所有叶片进行一个理化指标测定。从UV-B 辐射处理开始,分别在 0、12、24、36、48、72 h 对 UV-B 处理和未处理的玉米幼苗进行取样,称重后液氮速冻,于-80℃保存备用。
1.2 理化指标测定
对样品进行可溶性蛋白、脯氨酸(Pro)、叶绿素、超氧化物歧化酶(SOD)、过氧化物酶(POD)和荧光值等6 个逆境相关生理生化指标进行分析,每个处理进行3 次重复。生理生化指标具体测定方法分别为可溶性蛋白含量的测定采用考马斯亮蓝G-250 法,超氧化物歧化酶(SOD),叶绿素含量[15],过氧化物酶(POD)采用愈创木酚法测定,脯氨酸(Pro)含量测定用酸性水合茚三酮显色法[16];Fv/Fm 荧光值的测定(植物胁迫测量仪OS30P,美国)。
1.3 数据分析
数据分析由Excel 和SPSS 16.0 软件完成,其中显著性分析采用最小显著差数法(LSD)。
2 结果与分析
2.1 UV-B 辐射对玉米叶片叶绿素含量的影响
叶绿素是植物进行光合作用的重要物质,其含量的高低直接影响到叶片光合能力。从图1 可以看出,除处理12 h 的叶片叶绿素a 含量显著降低外,在供试的0~72 h 范围内,UV-B 辐射处理玉米叶片叶绿素a 含量与相对应的未处理对照间无显著性差异;与未处理对照相比,0~72 h 范围内UV-B 辐射诱导叶片叶绿素a 含量先急剧降低,而后逐渐升高,其中处理后12 h 的叶绿素a 含量最低,处理24 h 后基本恢复与对照水平相近。
从图2 可以看出,在供试的0~72 h 范围内,UV-B 辐射处理玉米叶片叶绿素b 含量与相对应的未处理对照间差异较小,且差异不显著;在0~24 h 区间UV-B 辐射诱导叶片叶绿素b 含量变化趋势与叶绿素a 含量变化趋势相反,表现为先升高后降低,而后与叶绿素a 含量变化趋势相似。

2.2 UV-B 辐射对玉米叶片叶绿素荧光参数的影响
叶绿素荧光参数Fv/Fm 反应了光系统Ⅱ(PSⅡ)原初光能转换效率(Fv/Fm),研究选取照光一致的第一片完全展开叶进行测定,测定前预暗15 min。从图3 可以看出,在供试的0~72 h 范围内,除处理24 h后UV-B 辐射玉米叶片Fv/Fm 值显著低于相对应的未处理对照外,其他处理均低于对照且差异不显著;与未处理对照相比,0~72 h 范围内UV-B 辐射诱导Fv/Fm 值先逐渐降低,而后逐渐升高,其中24 h时Fv/Fm 值降到最低点,在48~72 h 区间基本恢复与对照水平相近。
2.3 UV-B 辐射对玉米叶片可溶性蛋白含量的影响
从图4 可以看出,在供试的0~72 h 范围内,UVB 辐射处理玉米叶片可溶性蛋白含量与相对应的未处理对照间在24 h 和36 h 时差异显著,其他时间点差异不显著;与未处理对照相比,0~36 h 间UV-B 辐射诱导叶片可溶性蛋白含量先升高,而后逐渐降低,其中处理36 h 蛋白含量最低,在36~72 h 间UV-B辐射诱导叶片可溶性蛋白含量亦是先升高后降低,在处理48 h 后基本恢复与对照水平相当。

2.4 UV-B 辐射对玉米叶片脯氨酸含量的影响
脯氨酸是渗透调节中最重要的溶质之一,脯氨酸还可作为自由基清除剂起保护作用。从图5 可以看出,在供试的0~48 h 范围内,UV-B 辐射处理玉米叶片脯氨酸含量均高于相对应的未处理对照间,而且在12 h 和24 h 时显著高于未处理对照;与未处理对照相比,0~72 h 范围内UV-B 辐射诱导叶片脯氨酸含量先缓慢升高,而后逐渐降低,其中处理24 h 脯氨酸含量最高,在处理36 h 后基本恢复与对照水平相当。

2.5 UV-B 辐射对玉米叶片POD 酶活性的影响
从图6 可以看出,在供试的0~72 h 范围内,UV-B 辐射处理玉米叶片POD 活性与相对应的未处理对照间无显著性,在供试的0~24 h 区间内,UV-B辐射处理玉米叶片POD 活性低于相对应的未处理对照,在24~48 h 区间内UV-B 辐射处理玉米叶片POD 活性高于相对应的未处理对照;与未处理对照相比,0~72 h 间UV-B 辐射诱导叶片POD 活性先缓慢升高,直到48 h 而后逐渐降低,基本恢复与对照水平相当。
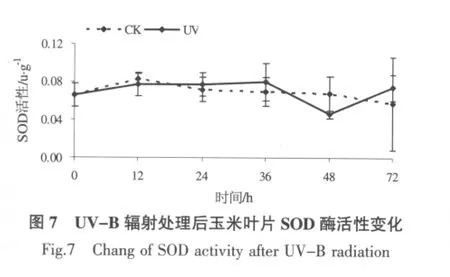
2.6 UV-B 辐射对玉米叶片SOD 活性的影响
从图6 可以看出,在供试的0~72 h 范围内,UV-B 辐射处理玉米叶片SOD 活性与相对应的未处理对照间无显著性,且差异很小;与未处理对照相比,0~36 h 区间UV-B 辐射诱导叶片SOD 活性缓慢增强,36~72 h 区间SOD 活性出现波动。整体来看,SOD 酶活性几乎未受短暂UV-B 辐射影响。
3 结论
在逆境胁迫下,植物的生理活动会受到不同程度的影响,而植物则采取一系列的应对措施来抵御外界环境的变化,减少对自身所造成的伤害[17]。研究通过对短期UV-B 辐射处理三叶一心期玉米幼苗叶片进行生理生化指标分析,研究结果表明:
3.1 在供试的时间范围内,叶绿素a 和脯氨酸等两个供试指标参与玉米幼苗对UV-B 辐射早期应答反应(0~24 h),随后叶绿素荧光Fv/Fm 和可溶性蛋白(24~36 h)受到显著影响,表明植物光合作用受到UV-B 的辐射影响显著,叶绿素a 合成受抑制后导致光系统Ⅱ(PSⅡ)光能转换效率降低;另一方面蛋白质的合成也受到UV-B 辐射显著影响,脯氨酸等逆境应答氨基酸含量的快速增加导致可溶性蛋白合成受到抑制。
3.2 与未处理对照相比,POD 和SOD 等抗氧化蛋白活性受UV-B 辐射影响变化幅度很小,表明短暂UV-B 辐射对植物的氧化伤害很小;(3)在0~72 h范围内,多数供试指标在处理36 h 后基本恢复到与未处理对照相当,所以短期UV-B 辐射对玉米造成的影响不大,能够在短期内在生理生化水平得到恢复。
[1] Paul ND,Gwynn-Jones D.Ecological roles of solar UV radiation:towards an integrated approach[J].Trends Ecol Evol,2003,18:48-55.
[2] Caldwell MM,Bornman JF,Ballare′CL,et al.Terrestrial ecosystems,increased solar ultraviolet radiation,and interactions with other climate change factors [J].Photochem Photobiol Sci,2007(6):252-266.
[3] Caldwell MM,Bjorn LO,Bronman JF,et al.Effects of increased solar ultraviolet radiation on terrestrial ecosystem[J].J Photochem Photobiol Biol,1998,46:40-52.
[4] Barns PW,Maggard S,Holmam SR,et al.Intraspecific variation in sensitivity to UV-B radiation in rice[J].Crop Sci,1993,33:1041-1046.
[5] Suesslin C,Frohnmeyer H.An Arabidopsis mutant defective in UV-B light-mediated responses[J].Plant J,2003,33:591-601.
[6] Ulm R,Nagy F.Signalling and gene regulation in response to ultraviolet light[J].Curr Opin Plant Biol,2005(8):477-482.
[7] 张荣刚,何雨红,郑有飞.UV-B 增加对玉米生长发育和产量的影响[J].中国农业气象,2003,24(2):24-27.
[8] 苏占胜,王连喜,李福生,等.UV-B 增加对玉米光合作用日变化的影响[J].宁夏工程技术,2006,5(3):284-287.
[9] 解备涛,段留生,董学会,等.穗分化期UV-B 增强辐射对大田玉米农艺性状的影响[J].华北农学报,2007,22(1):30-34.
[10] 吴荣军,郑有飞,王传海,等.紫外辐射增强对玉米地上部分与根系生长的影响比较[J].生态环境,2007,16(2):323-326.
[11] 张磊,王连喜,李福生,等.UV-B 增强对中高海拔干旱地区玉米生长的影响[J].中国农学通报,2008,24(11):433-437.
[12] 龙云,刘芸,钟章成,等.酸雨和UV-B 对玉米幼苗光合速率和抗氧化酶活性的影响[J].生态学报,2009,29(9):4956-4966.
[13] 汤红官,张满效,何元庆.UV-B 和NO 对玉米幼苗根系呼吸作用的影响[J].兰州大学学报:自然科学版,2010,46(2):51-55.
[14] 王芳,姬茜茹,邱宗波,等.不同玉米品种对增强UV-B辐射与干旱复合胁迫的生理响应[J].农业环境科学学报,2009,28(3):438-442.
[15] 李玲主编.植物生理学模块实验指导[M].北京:科学出版社,2009.
[16] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2003.
[17] 许健,高树仁,崔美燕,等.苗期玉米对碱胁迫的生理响应[J].黑龙江八一农垦大学学报,2009,21(1):19-21.

