栀子黄色素的精制及栀子蓝色素的转化
景艳艳,李世杰,陈茂彬,蒋 威,方尚玲
(教育部发酵工程重点实验室,湖北工业大学生物工程学院,湖北 武汉430068)
栀子果是茜草科植物栀子的果实,含有两种色素:栀子苷(京尼平苷)和类胡萝卜素类的栀子黄色素(藏花素)。栀子黄色素精制过程洗脱的废液中含有栀子苷。研究表明:栀子苷在β-葡萄糖苷酶或β-半乳糖苷酶的作用下,可与伯氨基酸(α-氨基酸)发生聚合反应,生成蓝色色素[1]。近几年来,用于生产β-葡萄糖苷酶的菌株多为黑曲霉、木霉等霉菌属,杆菌属的菌株较少。作者从土壤及菌种保藏室中筛选到4株霉菌、2株杆菌,并利用它们将栀子黄色素精制废液(栀子黄废液)转化为栀子蓝色素,变废为宝,以充分循环利用栀子资源。
1 实验
1.1 材料、菌株与培养基
栀子果,市售。
苏云金芽孢杆菌BT、苏云金芽孢杆菌BT-140、巨大芽孢杆菌、凝结芽孢杆菌、苏云金芽孢杆菌BT-7216、嗜热脂肪杆菌和枯草芽孢杆菌,分别编号1#~7#,湖北工业大学菌种保藏室。
杆菌斜面培养基[2]:葡萄糖2%,蛋白胨1%,NaCl 0.5%,NaNO30.3%,琼脂2%,pH 值7.0。
杆菌种子培养基[2]:葡萄糖2%,蛋白胨1%,NaCl 0.5%,NaNO30.3%,pH 值7.0。
杆菌发酵培养基:麸皮2%(麸皮加水煮沸后经4层纱布过滤得到的滤液),蛋白胨2%,栀子黄废液10%,KH2PO40.2%,MgSO4·7H2O 0.2%,pH 值7.0。
初筛培养基:葡萄糖2%,蛋白胨2%,酵母膏1%,栀子黄废液10%。
平板分离培养基:栀子黄废液10%,谷氨酸钠0.1%,蛋白胨0.5%,KH2PO41%,MgSO4·7H2O 0.05%,琼脂2%。
PDA培养基:土豆20g,葡萄糖2g,琼脂2g,水100mL,115℃灭菌30min。
霉菌种子培养基:葡萄糖1%,酵母膏0.5%,NaNO30.3%,MgSO4·7H2O 0.2%,KH2PO40.2%。
霉菌发酵培养基:麸皮2%(麸皮加水煮沸后经4层纱布过滤得到的滤液),蛋白胨2%,KH2PO40.2%,MgSO4·7H2O 0.2%,栀子黄废液10%。
1.2 方法
1.2.1 栀子黄色素的提取
准确称取经粉碎机粉碎后的栀子果粉末15g,加入150mL水,60℃水浴30min,过滤,得1次提取液;滤渣加100mL水再次浸提,过滤,得2次提取液;滤渣加50mL水第3次浸提,过滤,得3次提取液。将3次提取液混合,备用。
1.2.2 栀子黄色素的精制
1.2.2.1 树脂的预处理
AB-8型大孔吸附树脂经除杂、80%乙醇浸泡24h充分溶胀后,用80%乙醇洗至洗出液加等体积水无浑浊现象,再用去离子水洗至无醇味。
1.2.2.2 树脂的吸附和解吸
称取1g预处理后的AB-8型大孔吸附树脂于250mL锥形瓶中,加入50mL栀子黄色素提取液,于30℃、150r·min-1摇床振荡过夜至吸附平衡,测吸附前后色素溶液在440nm(栀子黄色素的最大吸收波长)处的吸光度值。
称取吸附平衡的AB-8型大孔吸附树脂0.5g,加25mL 60%乙醇,于30 ℃、150r·min-1摇床振荡24h,测解吸后60%乙醇中栀子黄色素在440nm处的吸光度值。按下式计算吸附率和解吸率:

式中:A1为吸附前栀子黄色素提取液在440nm处的吸光度值;A2为吸附平衡后栀子黄色素提取液在440nm处的吸光度值;A3为解吸后60%乙醇中栀子黄色素在440nm处的吸光度值。
1.2.2.3 栀子黄色素的精制
取吸附平衡的AB-8型大孔吸附树脂,装柱。依次用去离子水(4BV)、20%乙醇(5BV)、60%乙醇(6.5BV)进行洗脱,流速为1.5mL·min-1。收集60%乙醇的洗脱液,经浓缩干燥得栀子黄色素精品。剩余的洗脱液即为含大量栀子苷的栀子黄废液,再经浓缩去醇,置于-20℃冰箱保存备用。
1.2.3 栀子蓝色素转化菌的筛选
1.2.3.1 土壤中目的菌株的筛选
初筛:称取1g土样加入20mL无菌水充分振荡制成悬液。吸取1mL土样悬液于装有50mL初筛培养基的250mL摇瓶中,于30℃、180r·min-1摇床培养2d。若摇瓶培养过程中发现摇瓶内发酵液变蓝,说明含有目的菌株。
平板分离:取初筛培养基中的菌液作梯度稀释。取不同稀释梯度的菌悬液0.2mL涂布在平板分离培养基于30℃PHX型智能生化培养箱中培养观察。挑取能在平板分离培养基上产生蓝色菌圈的菌株划线分离,得到单菌落。
复筛:挑取单菌落接种到初筛培养基中,于30℃、180r·min-1摇床培养2~3d,发酵液转蓝的摇瓶对应的菌株即为目的菌株,将其接种到PDA培养基上作菌种斜面保藏。
1.2.3.2 杆菌的筛选
分别挑取5环斜面活化后的杆菌于种子液中,于35℃、180r·min-1摇床培养10h,以10%接种量接种到杆菌发酵培养基中摇床培养24h,发酵液转蓝所对应的菌株即为目的菌株。
1.2.4 目的菌株转蓝发酵培养
将筛选得到的目的菌株进行转蓝发酵培养:4株从土壤中筛选得到的目的菌株在种子培养基中培养3d再转接到发酵培养基于30℃摇床培养5d,转蓝发酵液稀释10倍;苏云金芽孢杆菌BT-7216和枯草芽孢杆菌在种子培养基中培养10h后以10%接种量接种到发酵培养基中培养24h,平行实验3次,转蓝发酵液稀释3倍。
取上述发酵液以10 000r·min-1离心10min,取上清液检测590nm处吸光度值。以去离子水为对照。
按下式计算发酵液色价(E1%1cm):

式中:OD590为吸光度值;f为稀释倍数;V为发酵液总体积的1%,mL。
2 结果与讨论
2.1 AB-8型大孔吸附树脂的吸附、解吸效果
实验发现,AB-8型大孔吸附树脂对栀子黄色素的吸附率达到88.92%、解吸率达到95.38%,吸附率和解吸率都较高,可用于栀子黄色素的精制。
2.2 栀子黄色素精制前后吸收光谱分析(图1)

图1 栀子黄色素提取液(a)、栀子黄废液(b)、栀子黄色素精制品(c)的吸收光谱Fig.1 The absorption spectra of gardenia yellow pigment extract(a),gardenia yellow waste(b)and purified gardenia yellow pigment(c)
由图1可知,栀子黄色素提取液的吸收光谱中,峰1在440nm处,为藏花素和藏花酸的特征吸收峰,栀子黄色素是一种罕见的水溶性类胡萝卜素,主要成分是类胡萝卜素类的α-藏花素和藏花酸[3];峰2为杂质峰;峰3在325nm附近,为绿原酸的特征吸收峰;峰4在238nm处,为栀子苷的特征吸收峰。栀子黄废液的吸收光谱中,栀子苷的含量很高,已经超出了最大测量值,说明栀子黄废液可以作为栀子蓝色素微生物转化的原料。栀子黄色素精制品的吸收光谱中,栀子苷的吸收峰不明显,由此可见栀子黄色素精制后栀子苷的含量明显减少;同时325nm处的吸光度与440nm处的吸光度比值由2.32下降到1.16,说明精制过程中除去了大量绿原酸。
2.3 转蓝发酵液吸收光谱分析
土壤中目的菌株的初筛培养液以及杆菌筛选发酵液都有蓝色色素,为确定该色素是否为栀子蓝色素,对转蓝发酵液进行吸收光谱扫描,见图2。

图2 转蓝发酵液的吸收光谱Fig.2 The absorption spectrum of the fermentation broth for converting blue
由图2可知,590nm处有一吸收峰,这与栀子蓝色素的最大吸收波长为590nm相一致[4],可确定栀子黄废液经微生物发酵转化为了栀子蓝色素。
2.4 杆菌的筛选
7株杆菌中有6株发酵液有颜色变化,测定其580~600nm处吸光度值,发现6株杆菌转蓝发酵液的吸收峰值都在590nm附近。7株杆菌发酵转蓝情况比较见表1 。

表1 7株杆菌发酵转蓝比较Tab.1 Comparison of the fermentation for converting blue of the seven Bacillus strains
由表1 可知,7株杆菌的转蓝发酵液稀释3倍后吸光度值较大的是苏云金芽孢杆菌BT-7216和枯草芽孢杆菌,同时两者发酵液的颜色呈蓝色,色泽较好。因此,选择苏云金芽孢杆菌BT-7216和枯草芽孢杆菌进一步驯化比较。
2.5 栀子黄废液转蓝发酵
从土壤中筛选得到4株目的菌株,分别编号1#~4#,其菌落形态见图3。
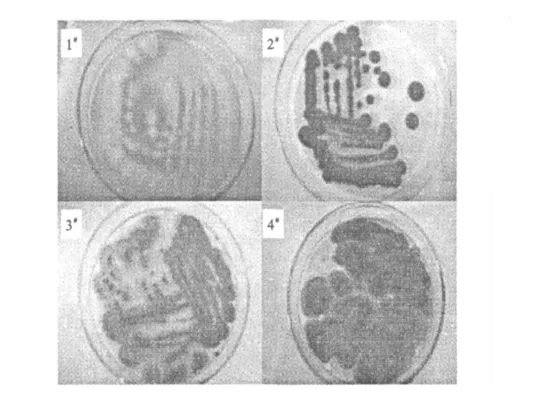
图3 4株目的菌株的形态Fig.3 Morphology of the four object strains
由图3可知,4株目的菌株属于霉菌属。
4株霉菌、2株杆菌转蓝发酵液的吸光度值和色价见表2 。

表2 4株霉菌、2株杆菌转蓝发酵液的吸光度值和色价Tab.2 The absorbance values and color values of fermentation broth of the four molds and the two Bacillus strains
由表2 可知,从土壤中筛选得到的4株霉菌在栀子黄废液转蓝发酵过程中效果较突出的是2#和4#菌株,发酵液经稀释10倍后吸光度值分别达0.258、0.343,色价(590nm)分别为129.0、171.5;枯草芽孢杆菌和苏云金芽孢杆菌BT-7216转蓝发酵液稀释3倍后,吸光度值分别达0.326、0.260,色价(590nm)分别为48.9、39.0,其中枯草芽孢杆菌的转蓝效果较好。
2.6 讨论
(1)在培养过程中,目的菌株可分解培养基中的蛋白胨为氨基酸,同时分泌出β-葡萄糖苷酶,在β-葡萄糖苷酶作用下将栀子黄废液转化为栀子蓝色素。
(2)本研究的色价计算为发酵液的色价,而通常是将发酵液换算成色素粉末来计算色价,那样其色价将更高。
3 结论
(1)栀子黄色素提取液经AB-8大孔吸附树脂吸附,装柱后依次经去离子水、20%乙醇、60%乙醇动态洗脱,除去大量杂质得到高纯度的栀子黄色素,栀子黄色素精制后的废液中含有大量的栀子苷,可用于栀子蓝色素的微生物转化。
(2)经初筛、复筛、转蓝发酵培养,从土壤中筛选得到4株霉菌,其中2#和4#菌株为优势菌株,转蓝发酵液稀释10倍后590nm处吸光度值分别达到0.258、0.343,发酵液色价 E1%1cm(590nm)分别为 129.0、171.5,达到了国际市场标准。
(3)从菌种保藏室中的7株杆菌中筛选到转蓝效果较好的2株杆菌,其中枯草芽孢杆菌的转蓝效果更好,转蓝发酵液稀释3倍后590nm处吸光度值为0.326,发酵液色价E1%1cm(590nm)为48.9。与霉菌相比,杆菌的转蓝发酵液色价较低,但用杆菌转蓝发酵周期短、效率高,其应用潜力很大,可对其转蓝发酵工艺进行优化,提高转蓝效率。
[1]赵垦田.植物精深产品加工工艺学[M].哈尔滨:东北林业大学出版社,2007:63.
[2]方尚玲,刘源才,张庆华,等.细菌产β-葡萄糖苷酶发酵优化[J].化学与生物工程,2007,24(9):54-58.
[3]李炜.栀子果化学成分的综合应用研究[D].北京:北京林业大学,2006.
[4]杨志,张芳,李梅,等.栀子蓝色素制备及纯化工艺的研究[J].现代食品科技,2008,24(4):352-356.

