影响HBeAg 阳性慢性乙肝拉米夫定抗病毒疗效的预测因素探讨
周稳兰,陆春芬,卢应梅,朱蔚岗
核苷(酸)类似物是临床治疗慢性乙型肝炎患者的重要药物,疗效已经得到肯定,但因对HBV-cccDNA无直接作用,需长期使用,故如何取得更好疗效及何时停药是患者最关心的问题。本研究对近年来HBeAg阳性慢乙肝(HBV DNA>105copies/ml)接受拉米夫定抗病毒治疗者进行回顾性分析,探讨基线ALT、HBV-DNA水平与24周时HBV-DNA检测不到率以及与远期疗效的关系;并探讨发生HBeAg/抗HBe血清转换后巩固治疗时间的长短与停药复发的关系,现报告如下。
1 资料与方法
1.1 一般资料 病例来源于我院2000年10月~2006年10月住院或门诊可随访的慢性乙肝患者共124例,其中男82例,女42例,平均年龄为(43.7±14.3)岁。均为 HBeAg(+)、HBV-DNA>105copies/ml者,诊断符合2000年(西安)中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的诊断标准。124例患者中单用拉米夫定组(A组)78例,拉米夫定加胸腺肽α1治疗组(B组)46例,这些患者在接受抗病毒前6个月内均未行抗病毒或免疫调节剂治疗。所有病例按基线ALT水平分为:组1:ALT≥5ULN;组2:5ULN>ALT>2ULN;组3:2ULN≥ALT>1ULN;按基线HBV-DNA水平分为:组4:HBV-DNA≥5.0 ×107copy/ml,组 5:HBV DNA <5.0 ×107copy/ml。
1.2 治疗方法 A、B 2组均采用拉米夫定(葛兰素威康公司生产)100 mg口服每日1次,而B组于治疗后3个月开始加用胸腺肽α1(海南双成药业有限公司生产)1.6 mg皮下注射,每周2次×6个月,各组患者均同时应用一般护肝药物治疗。治疗过程中发生HBV-YMDD变异,加用阿德福韦酯(葛兰素威康公司生产)10 mg口服,每日1次。
1.3 观察指标 全部病例于治疗前、治疗期间(前12月内每月、以后每3月)观察临床和生化指标,于治疗前、治疗后每3个月检测血清 HBVM(ELISA法)、HBV DNA(PCR法,HBV DNA<1×103copy/ml为阴性),HBV YMDD变异检测送江苏省人民医院。
1.4 统计学方法 组间率的比较用χ2检验,P<0.05为差异有显著性意义。
2 结果
2.1 基线ALT水平与治疗24周时HBV-DNA检测不到率的关系 见表1。
2.2 基线HBV DNA水平与24周时HBV DNA检测不到率的关系 见表2。
2.3 基线ALT水平与治疗12月时HBeAg/抗HBe血清转换率的比较 见表3。

表1 基线ALT水平与治疗24周时HBV DNA检测不到率的关系(n,%)
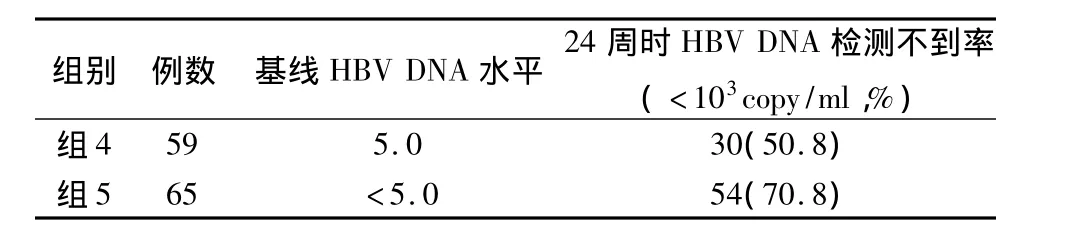
表2 基线HBV DNA水平与24周时HBV DNA检测不到率的关系(n,%)

表3 基线ALT水平与治疗12月HBeAg/抗HBe血清转换率的比较(n,%)
2.4 A、B2组治疗后12、24、36月的疗效比较 26例血清转换者继续巩固治疗1年,停药观察1年,复发率23.1%(6/26)。20例血清转换者继续巩固治疗6月,停药观察1年,复发率50%(10/20);二者相比差异有显著性(χ2=3.612,P <0.05),见表4、表5。CCCDNA[1]。由于其作用机理是抑制而不是杀灭HBV,肝细胞内的HBV能否被清除,取决于机体的免疫清除能力[2],患者在治疗未达到HBeAg/抗HBe血清转换前停药,病毒可再度活跃复制,导致疾病复发,因此,长期服用可使病毒受到持续抑制,在机体免疫应答的协助下,有望取得持续缓解[1]。ALT>2ULN的患者往往是处于免疫清除阶段,因而血清转换较高。胸腺肽α1是一种免疫增强剂,可以调节机体的细胞免疫,促进淋巴细胞的成熟,增强辅助性T淋巴细胞、NK细胞的活性,诱导毒性T淋巴细胞的活化,并通过调节活性的淋巴细胞,释放各种淋巴因子攻击受病毒感染的肝细胞,直接导致cccDNA的减少,从而使病毒蛋白的表达减少[2]。

表4 2组治疗后HBeAg/抗HBe转换率(%)比较
本组资料显示:基线ALT≥5ULN,24周时HBV DNA检测不到率、治疗1年HBeAg/抗 HBe血清转换率均显著高于5ULN>ALT>2ULN、2ULN≥ALT>1ULN(统计学有显著性差异);基线HBV DNA<5.0×107copy/ml,24周时HBV DNA检测不到率显著高于 HBV DNA≥5.0×107copy/ml(P<0.001);A、B2组于治疗3个月时HBV-DNA阴转率为60%左右,此时A组在病毒复制受到明显抑制时加用胸腺肽α1,结果显示:HBV DNA阴转率逐渐上升,于治疗12月时达84.8%,而B组虽然也有上升,但显著低于A组(P<0.05),经检测已有7例发生了YMDD变异。而HBeAg/抗HBe的转换率比较,在9个月、12个月时A组均显著高于B组(P<0.05或0.01)。延长疗程至24月、36月显示:HBV DNA的阴转率、HBeAg/抗HBe的转换率均显著高于B组(P<0.01或0.001);而24周时HBV DNA检测不到者,36月时HBV DNA检测不到率66.7%、HBeAg/抗HBe血清转换率达51.2%;A组在治疗24月时、36月时HBV-YMDD变异累计发生率分别为:10.9%、23.9%,显著低于B组(P<0.05或0.01),且A组患者发生HBV-YMDD变异在治疗后18个月,而B组在治疗后9个月即有患者出现HBV-YMDD变异。124例患者中26例血清转换者继续巩固治疗1年,停药观察1年,复发率23.1%(6/26);20例血清转换者继续巩固治疗6月,停药观察1年,复发率50%(10/20),二者比较,差异有显著性(χ2=3.612,P <0.05)。
本研究结果显示:基线ALT高、HBV-DNA低(<107copy/ml),24周时HBV-DNA检测不到率高,远期(三年)疗效持久。患者发生HBeAg/抗HBe血清转换后巩固治疗时间越长停药后复发率越低。慢性乙肝患者在拉米夫定治疗后病毒复制大幅度降低时加用免疫增强剂胸腺肽α1,可以进一步降低HBV DNA水平,减少并延迟HBV YMDD变异株的发生,提高了HBeAg/抗HBe的转换率,减少了停药后复发,远期疗效肯定,是一种治疗慢性乙型肝炎的安全有效方法。
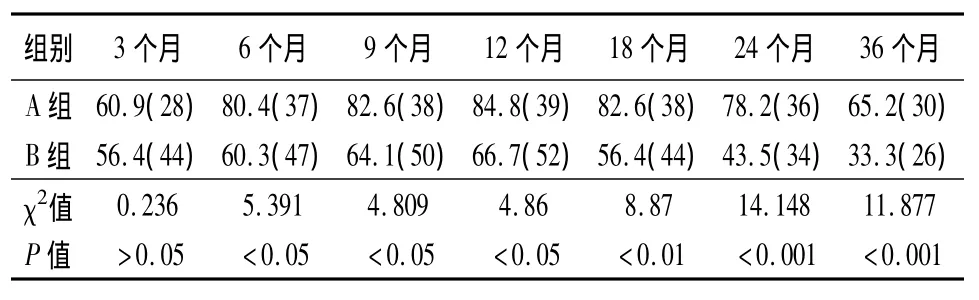
表5 A、B2组治疗后HBV-DNA的阴转率(%)比较
2.5 24周时HBV检测不到者与36月时的疗效关系 24周时HBV DNA检测不到者,36月时 HBV DNA检测不到率66.7%、HBeAg/抗HBe血清转换率达51.2%。
2.6 AB2组治疗24月、36月的累计变异率的比较 A、B2组治疗24月时HBV-YMDD变异累计发生率分别为:10.9%(5例)、37.2%(29 例),A 组显著低于 B 组(χ2=10.06,P <0.01);36月时HBV-YMDD变异累计发生率分别为23.9%(11例)、47.4%(37例),A 组仍显著低于 B 组(χ2=4.85,P<0.05)。
3 讨论
拉米夫定是一种安全有效的药物,能较好地抑制HBV复制。但尚无证据显示拉米夫定可清除肝细胞内的
[1]姚光弼,崔振宇,姚集鲁,等.国产拉米夫定治疗2200例慢性乙型肝炎的期临床试验[J].中华肝脏病杂志,2003,11(2):102-108.
[2]周稳兰,陆春芬,朱蔚岗,等.拉米夫定联合胸腺肽α1治疗慢性乙型肝炎的远期疗效观察[J].淮海医药,2009,27(2):159-160.

