纳米TiO2管电化学生物传感器用于测定水体中微囊藻毒素
赵晓琴,陈金媛,宋莉莉
(浙江工业大学 生物与环境工程学院,浙江 杭州310032)
微囊藻毒素LR(Microcystin-LR)是目前已知的毒性最强的、急性危害最大的一种淡水蓝藻毒素.由于未及时地检测水质情况的污染变化及采取相应的控制措施,致使这些毒素富集于鱼类或贝类中并通过食物链传递,直接存在于饮用水或娱乐用水中,严重威胁人类的健康,全球已经发生了多起有关藻毒素中毒并引起死亡的事故.近年来淡水藻类污染已成为一个全球性的环境问题,以碳纳米管修饰电极制作生物传感器已引起人们的关注[1-4].溶胶-凝胶是低温下固定生物活性物质的理想材料[5-6],对酶进行物理埋,可以最大限度的保持酶的活性.电化学生物传感器由于其操作简单方便、快速、灵敏度高等特点,在社会各个领域的应用越来越广泛[7-10].在实验中,我们将电化学生物传感技术用于检测微囊藻毒素,通过将纳米TiO2管修饰于石墨电极表面,再通过溶胶-凝胶法固定抗体抗原以及酶标抗体,制备了对微囊藻毒素有电化学响应的电化学生物传感器,具有灵敏度高,检测限低,操作简单,成本低等优点.
1 实 验
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器公司);三电极系统:自制生物电极为工作电极,饱和AgCl为参比电极,铂丝电极为对电极.测定体系为含10-4mol/L H2O2和10-4mol/L的邻氨基酚的磷酸缓冲溶液(PBS,pH6.5);KQ2 200E型超声波清洗器;pHS-3C型pH计(上海精密科学仪器有限公司);MC-LR标准品(ALEXIS公司);微囊藻毒素抗体、辣根过氧化物酶(HRP,晶美生物有限公司).
合成TiO2纳米管(自制);Nafion(杜邦DE520,5%,上海河森电气有限公司);石墨电极(Φ=5mm,天津艾达恒晟科技发展有限公司).实验室用水为超纯水.
1.2 电极的预处理
将石墨电极依次在砂纸、载玻片、滤纸和称量纸上打磨光滑,在水流下冲洗以除去石墨颗粒.依次用V(浓硝酸)∶V(超纯水)=1∶1的HNO3溶液、无水乙醇及二次蒸馏水超声清洗(每次约1min),倒置晾干.称取1mg TiO2纳米管加至5mL0.1%Nafion的无水乙醇中,超声震荡分散成均匀浅白色溶液,用微量进样器吸取该混合液12μL滴于石墨电极表面上,室温下晾干[11-12].
1.3 抗体的固定
取制备好的溶胶-凝胶10μL,加 HRP6μL(1mg的 HRP标准品溶入200μL的pH 7.1的PBS中混匀),均匀铺展于预处理的电极表面,并置于4℃的冰箱中存放直至成膜[12].
溶胶-凝胶的合成方法[13]如下:在小烧杯中,依次加入1mL硅酸丁酯(TEOS),0.2mL 乙醇,V(浓盐酸)∶V(超纯水)=1∶20的 HCl溶液30μL,500μL水,放入超声清洗仪中超声半小时,使溶液完全澄清.再加水1.5mL,30μL的聚乙二醇辛基苯基醚(Triton X-100),搅拌均匀.
1.4 抗原的固定
将成膜后的电极倒置入2mL一定质量浓度抗原溶液中,37℃下温育30min.
1.5 酶标抗体的固定
将固定好抗原的电极在PBS中搅拌洗涤晾干后,倒置入3mL20μg/L的酶标抗体溶液中,37℃下温育30min,PBS中搅拌洗涤,晾干.
1.6 电化学检测
取出已修饰完成的MC-LR生物电极,采用示差脉冲伏安法(DPV)考察峰电流的变化.DPV测试条件:电压-0.05~-0.5V,振幅0.05V,脉冲宽度0.06s,静置时间2s.测试底液为1×10-4mol/L邻氨基酚和1×10-4mol/L过氧化氢混合液.所有测试均在室温下进行(图1).
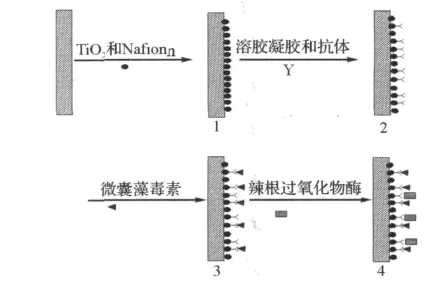
图1 生物电极修饰过程示意图Fig.1 The schematic illustration of the stepwise immunosensor fabrication process
2 结果和讨论
2.1 自制TiO2纳米管材料的表征
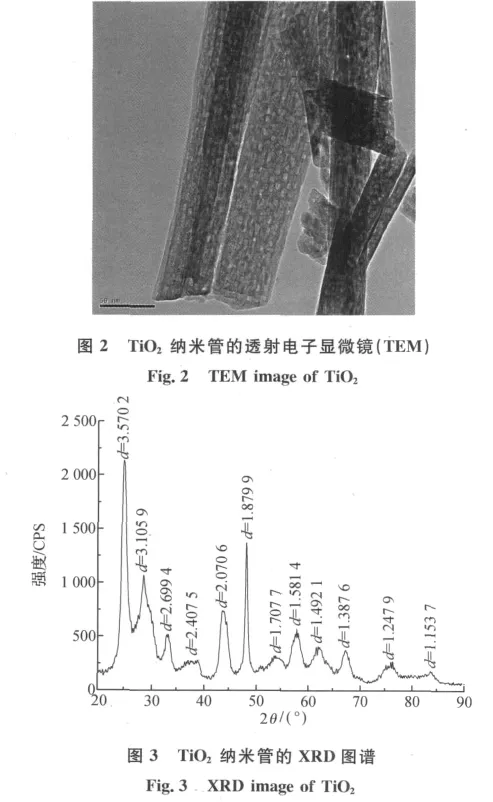
从TiO2纳米管的透射电子显微镜(TEM)图(图2)中可以看到,TiO2纳米管的端口被打开,该纳米管外径约为10~15nm,管壁为多层管壁,管壁厚约1nm.
图3为TiO2纳米管的XRD衍射谱图.在2θ为24.9°和48.4°处出现了2个明显的衍射峰,为典型的锐钛矿相,其相对应的衍射晶面分别为(101)和(200).
2.2 缓冲溶液的影响
研究了0.2mol/L同等pH(pH 6.5)的KH2PO4-NaOH、Na2HPO4-KH2PO4、Na2HPO4-NaH2PO4、Na2HPO4-柠檬酸和柠檬酸-NaOH-HCl的缓冲溶液作为支持电解质时的影响.由图4可知:该生物传感器在柠檬酸-NaOH-HCl缓冲溶液中的响应电流大.
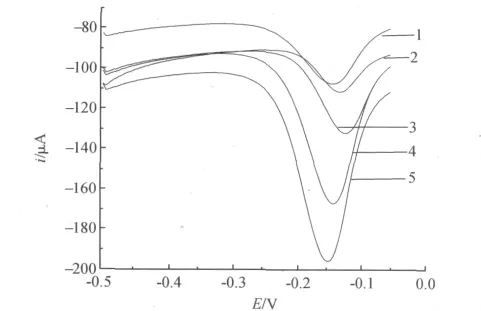
图4 该生物传感器在5种磷酸缓冲溶液中的示差脉冲伏安图Fig.4 DPV of current for the immunosensor in 5sorts of PBS
2.3 缓冲溶液pH值的影响
当缓冲溶液的pH从1~9范围变化时,由图5可以看出传感器在pH=6.5时响应峰电流最大.
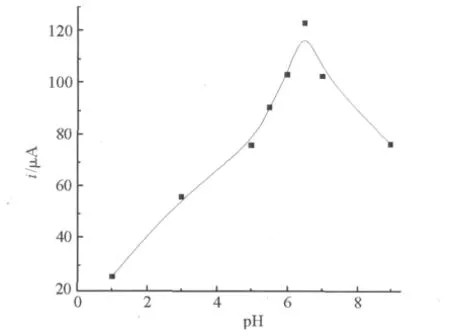
图5 缓冲溶液的pH对传感器响应电流的影响Fig.5 Influnce of the pH on the peak current
2.4 修饰剂用量的影响
实验发现 MC-LR的DPV峰电流与TiO2-Al膜的厚度有关.当修饰剂用量从0μL增加到10μL时,峰电流显著增加;当修饰剂用量超过12μL后,氧化峰电流随修饰剂用量的增加反而逐渐降低,这是由于电极表面的TiO2膜厚度太厚,阻碍了 MCLR的传质以及与电极之间的电子交换.
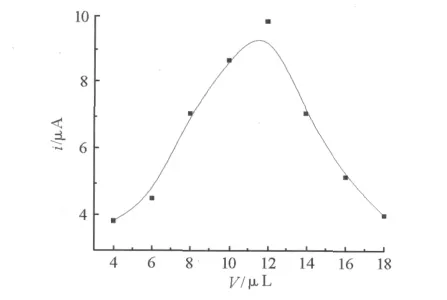
图6 修饰剂分散液用量对传感器响应电流的影响Fig.6 Influnce of the suspension on the peak current for the biosensor
2.5 电化学动力学
Michaelis-Menten常数km是酶促反应的特征常数,是表征酶与底物之间亲和力大小的统计标准.米氏常数可以根据如下公式[10]求得
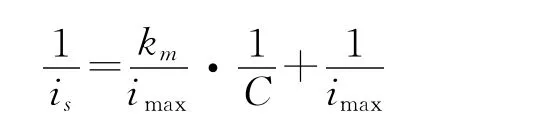
式中:is为一定底物浓度下传感器的稳态响应电流;imax为底物饱和浓度下测得的最大稳态电流;C为底物浓度.固定化酶对微囊藻毒素的表观米氏常数km为13.8mmol/L.km越小,表明酶与底物的亲合力越大,酶的活性受抑制的作用就越小.
2.6 微囊藻毒素在 MWCNTs-Nafion/GCE上的线性范围及检出限
在最佳实验条件下用DPV研究了MC-LR氧化峰电流随其浓度变化关系.氧化峰电流与空白电流的差值Δi与其质量浓度在10-5~1μg/L范围内,呈良好线性关系,线性方程为:100Δi=0.142 2 logC+0.799 7.r为0.995 0,检出限10-6μg/L.
2.7 干扰实验
在 MC-LR溶液质量浓度为10-5~1μg/L,允许误差不大于±5%的情况下,分别用超纯水、纯净水、矿物质水和自来水4种水样配制同浓度的MCLR溶液作为抗原,发现以上水样中所含物质均不干扰测定结果.表明该生物传感器具有极其良好的应用前景.
2.8 电极稳定性及重现性
用该TiO2纳米管修饰电极对10-4mol/L微囊藻毒素溶液连续测定10次,其RSD=2.5%.说明修饰电极有很好的重现性;将该TiO2材料修饰电极在4℃冰箱中放置四周后,其催化作用基本不变,表明该TiO2纳米管修饰电极具有良好的化学稳定性,这对实际应用有重要的意义.
2.9 样品测定
取2种天然湖水水样,在离心机上以1 200r/min的速度离心10min,以去除水样中的可沉淀杂质.取上清液先用国标法GB/T20466—2006测出每个样品的MC-LR值,平行测定3次,取平均值.再在每个样品中分别加入 MC-LR标准品0.1μg/L,稀释100倍,取上清液20mL作为抗原,37℃下温浴30min后,采用DPV法进行扫描,平行测定3次,取平均值.由表1可以看出:平均回收率为99.3%~102.9%,该电化学生物传感器具有良好的应用价值.
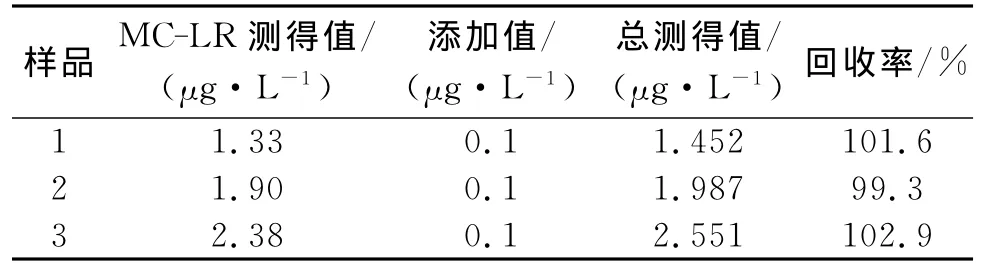
表1 生物传感器在水样中的加标回收率(n=3)Table 1 Recoveries of MC-LR in spiked water samples using prepared immunosensor(n=3)
3 结 论
以TiO2-Nafion修饰石墨电极为基底,利用夹心法将一抗、不同浓度的抗原、二抗固定在石墨电极表面制备成电化学生物传感器,在测定底液中用DPV法测定响应电流值,利用该合成材料特殊的纳米效应对酶促反应产生良好的电催化性能,从而实现了较低电位下对微囊藻毒素的间接测定,避免了生物样品中易还原的物质的干扰,提高了传感器的选择性和灵敏度.另外溶胶-凝胶技术所具有的良好的生物兼容性和稳定性大大提高了该传感器的稳定性和使用寿命.
[1]ASH C,MACKINTOSH C,MACKINTOSH R,et al.Use of aprotein phosphatase inhibition test for the detection of cyanobacterial toxins in water[J].Water Science and Technology,1995,31(5/6):51-53.
[2]HERESZTYN T,NICHOLOSON B C.A colorimetric protein phosphatase inhibition assay for the determination of cyanobacterial peptide hepatotoxins based on the dephosphorylation of phosvitin by recombinant protein phosphatase[J].Environmental Toxicology,2001,16(3):242-252.
[3]李红莉,金丽莎,万黎,等.淡水水体中微囊藻毒素的毒性鉴别和测定技术[J].环境与可持续发展,2007,(4):50-52.
[4]盛建武,何苗,施汉昌,等.水环境中微囊藻毒素检测技术研究进展[J].环境污染与防治,2006,28(2):132-136.
[5]DAVE B C,DUNN B,VALENTINE.Sol-Gel encapsulation methods for biosensors[J].American Chemical Society,1994,66(22):1120-1127.
[6]WANG J,COLLINSON M M.Electrochemical characterization of inorganic/organic hybrid filmsprepared from ferrocene modified silanes[J].Electroanal Chem,1998,455:127-137.
[7]DAI Zong,CHEN Jin,YAN Feng,et al.Electrochemical sensor for immunoassay of carcinoembryonic antigen based on thionine monolayer modified gold electrode[J].Cancer Detection and Prevention,2005,29(3):233-240.
[8]杜波,袁华,刘俊峰,等.多壁碳纳米管/环氧树脂复合材料雷达波吸收性能[J].南昌理工大学学报,2008,32(5):439-442.
[9]DU Dan,YAN Feng,LIU Sheng-li,et al.Electrochemical immunosensorfor carbohydrate antigen 19-9based on immunological reaction andits immobilization in titania sol-gel matrix[J].Immuno Methods,2003,283(1-2):67-75.
[10]CHEN Jin,YAN Feng,DAI Zong,et al.Reagentless amperometric immunosensor for human chorionicgonadotrophin based on direct electrochemistryof horseradish peroxidase[J].Biosens Bioelectron,2005,21(2):330-336.
[11]孙延一,吴康兵,胡胜水.多壁碳纳米管-Nafion化学修饰电极在高浓度抗坏血酸和尿酸体系中选择性测定多巴胺[J].高等学校化学学报,2002,23(11):2067-2069.
[12]孙元喜,郑丽英,肖小燕,等.碳纳米管修饰石墨电极的制备及应用[J].广州化工,2008,36(6):34-36.
[13]王宗花,刘军,李清文,等.辣根过氧化酶溶胶-凝胶膜修饰电极与过氧化氢的安培检测[J].分析化学,2001,29(12):1482.
[14]SHU F R,WILSON G S.Rotating ring-disk enzyme Electrode for surface catalysis studies[J].Analytical Chemistry,1976,48(12):1679-1686.
