模拟研究沙海蜇消亡过程中海水pH变化及对海水酸化的影响
马清霞, 李 宁, 李学刚, 袁华茂, 段丽琴, 曲宝晓, 宋金明
(1. 中国科学院 海洋研究所 海洋生态与环境科学重点实验室, 山东 青岛 266071; 2.中国科学院 研究生院,北京 100049)
水母暴发后的消亡引起了一系列的海洋生态灾害: 一方面, 水母暴发时在短时间内繁殖, 数量迅速增多, 摄取大量的营养物质, 死亡后的水母残体在分解过程中, 向海洋环境中释放大量的 C、N、P等营养元素, 影响到海洋营养元素的循环模式, 造成营养元素分布不均匀; 另一方面, 水母的身体 97%以上都是水分, 是一类透明易碎的胶质浮游动物,一般水母死亡后的残体会在 4~7d内分解完全, 消耗水体中大量的氧气, 引起局部海域发生低氧和缺氧现象[1-5], 水母暴发后消亡时, 其残体在低氧/缺氧环境中降解并向海水中释放一些酸性有机物质, 引起海水pH变化, 将会导致海洋生态环境变化。所以研究水母的消亡时水体 pH变化具有重要的科学意义。
水体的 pH值是反映水体化学性质的一个重要指标, 通常被认为是影响生态环境的重要因素[6]。目前在海洋环境中出现海水pH变化, 尤其出现酸化现象, 将导致海洋生态系统遭受一系列严重的破坏:海水的酸化会损害鱼类的听觉组织, 引起鱼类行为的改变[7]; 同时, 海水的酸化影响珊瑚虫、软体动物、棘皮动物、有孔虫类和含钙的藻类等生物的石灰化过程, 使之无法形成壳; 海水的酸化不仅影响了他们的繁衍, 更给海洋食物网带来巨大破坏[8-9]。导致海洋酸化的原因相当复杂, 而水母暴发后的消亡可能是影响海水酸化的重要因素之一, 因此, 研究水母死亡分解对水体 pH的影响对研究海洋生态环境变化有重要的指导作用。
近年来, 由于气候变化及越来越多的人类活动,海洋生态系统遭到严重破坏, 在全球许多海域都出现了水母暴发的现象。自20世纪90年代中后期起,我国渤海辽东湾、东海北部和黄海南部海域也相继出现了大型水母暴发的现象, 其中沙海蜇是我国大型水母暴发的主要种类之一[10-13]。沙海蜇(Nemopilema nomurai), 属腔肠动物门(Coelenterata),钵水母纲(Scyphomedusae), 根水母目(Rhizostomeae),冠水母科(Stomolophidea), 冠水母属(Stomolophus),主要分布于中国的东海北部和黄海南部[14-15], 并且在这些海域沙海蜇的暴发消亡已经形成重要的生态灾害。
本文以沙海蜇为研究对象, 采用室内模拟实验的方法, 主要研究了不同的 pH、盐度、温度和氮磷比控制条件下沙海蜇消亡过程中水体 pH的变化特征及对海水酸化的影响, 可为构建水母暴发消亡所引发的次生灾害应对技术措施提供基础。
1 材料与方法
本实验采取室内模拟的方法。实验所用沙海蜇取自青岛市沙子口海域, 洗净切割成5 kg(湿质量)的块体(包含伞部和口腕部, 两者质量比约为 4∶1)备用。所用海水取自青岛汇泉湾, 其初始pH为8.0, 盐度 30.3‰, DIN 浓度 13.64 μmol/L, DIP浓度 0.05 μmol/L。实验分为空白组(本底海水不加实验用沙海蜇)、本底海水组(本底海水+实验用沙海蜇)、受控实验组。其中受控实验组又分为pH实验组(3个水平)、盐度实验组(4个水平)、温度实验组(3个水平)、氮磷比实验组(4个水平)共4组受控实验组所需调节海水参数水平具体条件如表1。
实验采用的培养箱均为55 cm×37 cm×38 cm的白色透明塑料箱作为培养箱, 每个培养箱中均加入30 L实验用水。除空白组外向各个培养箱中分别加入已备好的5 kg沙海蜇块体, 并用透明的纱网将所有的培养箱口覆盖, 以防止大的颗粒物落入。实验温度为(27±1)℃(除温度实验组)。从实验的第1天开始, 每天上午8点用Orion star-5多参数仪测定培养箱中水体的pH值。

表1 各实验组选用海水的初始特征Tab. 1 Initial characteristics of the water in the incubation experiments
2 结果与分析
2.1 沙海蜇分解过程中的现象
沙海蜇的分解一般需要 5~6 d, 在室内模拟实验的前两天, 除了第 2天 30℃温度实验组块体出现腐烂, 培养箱水面结了一层薄膜外, 其他组沙海蜇块体大小无明显变化。此后, 沙海蜇块体分解速率加快, 培养箱水面开始结膜, 水体散发出一股恶臭味;且随着块体逐渐变小, 薄膜渐变成红色, 同时恶臭味加剧; 直到沙海蜇块体消失, 只剩一些絮状体时,恶臭味才逐渐变淡。第4天30℃温度实验组的沙海蜇块体完全分解掉, 而 23℃温度实验组和氮磷比实验组中N/P>16的各条件下的沙海蜇块体分解速率明显慢于其他组; 第6天, pH组、盐度组、本底海水组和N/P=16的氮磷比组的沙海蜇块体分解完全; 第7天, 23℃温度实验组的沙海蜇完全分解掉; 氮磷比实验组中N/P>16的各条件下的沙海蜇直至第8天才分解完全。
2.2 沙海蜇分解过程中水体pH的变化
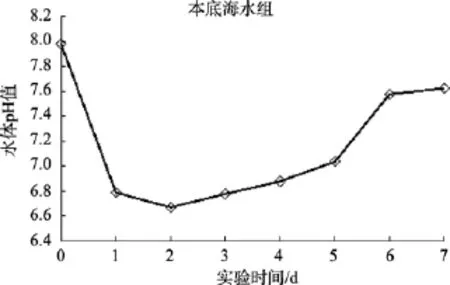
图1 本底海水中沙海蜇分解过程水体pH变化Fig. 1 The variation of pH with decomposition of Nemopilema nomurai in the seawater group
在本底海水组中, 沙海蜇的分解使得水体pH明显下降, 出现水体酸化现象(图 1)。在沙海蜇分解的第1天, 水体的pH值下降最快, 下降值可达1.3; 第2天, 水体pH达到最小值, 随后pH值缓慢上升, 直至第 6天沙海蜇分解完全时趋于稳定, 此时比空白组水体的pH值低0.5。并且在实验的第1天, 水体中的溶解氧(DO)即由初始的 4.32 mg/L迅速下降为0.61 mg/L, 水体出现明显的缺氧现象。
水母暴发死亡后, 残体的降解需要消耗大量的氧气, 使得水体出现低氧或缺氧现象[1,4-5]; 在低氧环境中残体进行厌氧分解会释放出大量的酸性有机物质, 这可能是导致水体pH下降的主要原因, 随着水母残体的逐渐分解, 这些酸性有机物被细菌分解成中性的无机物或 NH4+或CO2逸出水面, 致使水体pH又会开始上升[3-4]。此外, 室内模拟实验中沙海蜇块体分解散发出恶臭味, 表明块体中的有机物在进行厌氧分解, 产生有机酸, 导致水体 pH值下降, 出现水体酸化等水质恶化现象; 随着沙海蜇块体的降解, 所产生的有机酸又逐渐被分解消耗, 水体的 pH值转而缓慢上升; 至沙海蜇块体分解完全时, pH升至7.5并趋于稳定。由此可知: 沙海蜇暴发后的消亡过程可使海水酸化。
不同初始盐度、pH、氮磷比及不同过程温度下,沙海蜇分解过程中水体 pH的变化趋势和本底海水组水体 pH的变化趋势一致: 水体 pH均是先下降,达到最小值后缓慢回升。但水体pH出现最小值的时间与本底海水组的时间不同, 具体先后顺序: 本底海水组(第2天), 温度组(第3天), pH和盐度组(第4天), 氮磷比组(第5天), 沙海蜇分解过程中, 温度、盐度、pH和氮磷比这4个实验组的水体pH下降的幅度分别为: 0.5~1.3、0.8~1.8、0.5~1.6、0.5~1.3(图 2—图 5)。
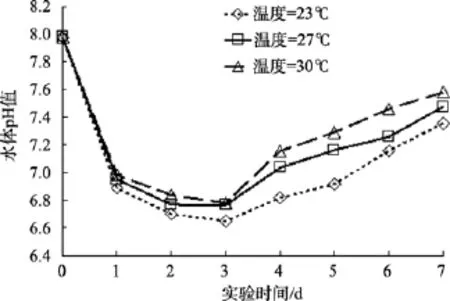
图2 不同过程温度下沙海蜇分解过程中水体pH变化Fig. 2 The variations of pH with decomposition of Nemopilema nomurai at different initial temperatures
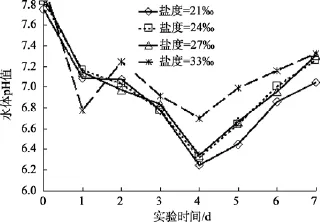
图3 不同初始盐度海水中沙海蜇分解过程水体pH的变化Fig. 3 The variations of pH with decomposition of Nemopilema nomurai at different initial salinities
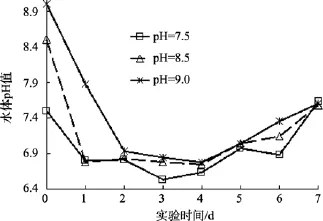
图4 不同初始pH海水中沙海蜇分解过程中水体pH变化Fig. 4 The variations of pH with decomposition of Nemopilema nomurai at different initial pHs
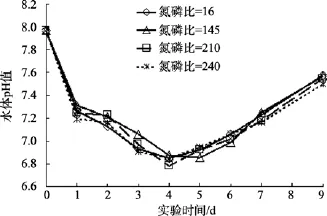
图5 不同初始氮磷比海水中沙海蜇分解过程水体pH变化Fig. 5 The variations of the pH with decomposition ofNemopilema nomurai at different initial N/P ratios
2.3 盐度因素对沙海蜇分解过程中pH影响
图6是盐度实验组与本底海水组同一日 pH值(图 1)的差值随时间变化的曲线。沙海蜇分解的前 3天, 不同盐度条件下, 水体pH值均比本底海水组pH值高; 随后差值 ΔpH 由正值迅速下降为负值, 并且差值的绝对值越来越大, 最大约为 0.75个单位; 直到分解结束时, 差值的绝对值才趋于减小。而且盐度越小, 水体的pH值与本底海水pH相差越大。
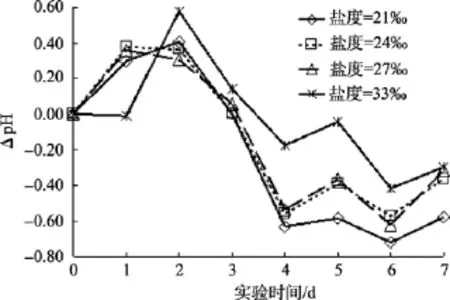
图6 盐度因素对沙海蜇分解过程中水体pH的影响Fig. 6 Influence of salinity on the pH of the water during degradation of Nemopilema nomurai
在不同盐度条件下, 水体pH差值的变化趋势表明, 在沙海蜇分解前期, 由于水体盐度改变, 影响本底海水中的微生物菌落生长[5,16], 使得微生物分解水母块体的速率减慢, 水母分解产生有机酸速率变小,致使盐度实验组水体的 pH比本底海水组降低的少;后期水体中的微生物群落逐渐适应新的盐度环境,沙海蜇块体的分解速率加快, 并且盐度越小, 后期分解产生有机酸速率越快。与本底海水组相比而言,沙海蜇分解过程中, 海水盐度变化使得水体酸化情况更严重; 而且低盐度条件对沙海蜇块体的分解影响更大, 因为盐度越高, 离子强度也越大, 一般微生物越难以生长繁殖[17], 故盐度越高越不利于沙海蜇的分解, 即沙海蜇分解产生酸性有机物质的速率减慢, 反之盐度越低, 沙海蜇分解越彻底, 产生的有机酸越多, 导致水体pH越低, 水体酸化越严重。因此,近岸和河口处沙海蜇暴发死亡后的降解, 可能会使该海域海水发生更严重酸化。
2.4 pH因素对沙海蜇分解过程中pH影响
图7是pH实验组与本底海水组同一日水体pH值的差值随时间变化的曲线。由图7可以看出, 初始pH为 9的碱性环境中, 沙海蜇分解过程中水体 pH变化范围最大, 水体pH值与本底海水组pH值差值从1.0下降到-0.2, 由此也可以证实沙海蜇分解过程中会产生大量的酸, 使得水体 pH降低。不同的 pH实验组, 水体 pH与本底海水组 pH差值不同, 但随着沙海蜇块体的分解, 差值趋于稳定。
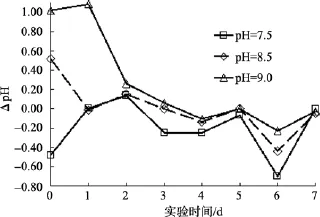
图7 pH因素对沙海蜇分解过程中水体pH的影响Fig. 7 Influence of pH on the pH of the water during degradation of Nemopilema nomurai
在碱性环境, 沙海蜇块体分解出的酸被水体中的碱中和, 促进块体的水解, 故受控因素 pH越大,其差值越大, 水体的酸化程度越严重。由此也说明受控因素pH越大, 对沙海蜇分解过程中水体pH的影响越大。反之, 影响越小。实验结果表明, 近海 pH高值海域, 沙海蜇暴发后的消亡可能导致更严重的海水酸化; 而且在海水已经酸化的海域, 沙海蜇的消亡会加重该海域的酸化情况。
2.5 温度因素对沙海蜇分解过程中pH影响
图8是温度实验组与本底海水组水体同日pH值的差值随时间变化的曲线。由图 8可以看出温度因素对沙海蜇分解过程中水体的pH值影响: 当水温保持在30℃时, 温度实验组水体的pH值比本底海水组高, 当水温保持在 23℃时, 温度实验组水体的 pH值一直比本底海水组的水体pH值低, 最大的差值约为-0.45。
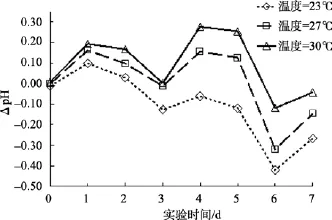
图8 温度因素对沙海蜇分解过程中水体pH的影响Fig. 8 Influence of temperature on the pH of the water during degradation of Nemopilema nomurai
海水的温度本身与海水pH有着密切的关系。一般情况下, 海水随着温度的升高, 所蕴含的二氧化碳会向空中逸出, 从而使海水中的二氧化碳减少,导致海水的pH值升高。反之, 海水温度降低, 海水中二氧化碳的溶解度增加, 使海水pH降低[18-19]。在沙海蜇分解过程中, 虽然海水温度的升高会促进沙海蜇块体的分解, 加速沙海蜇块体产生有机酸, 使得水体pH下降, 但随着海水温度升高, 二氧化碳更快地向空中逸出, 海水的二氧化碳减少, 使得水体pH升高, 这两方面的综合作用使得高温时水体 pH降低的幅度比低温时小。
在 30℃温度实验组中, 高温对沙海蜇分解速率的影响所导致的水体 pH降低作用小于高温对二氧化碳溶解度的影响所导致的水体pH增高作用, 使得水体 pH值比本底海水组(室温)的高, 故 ΔpH>0; 虽然 30℃高温条件下沙海蜇的分解会导致海水酸化的发生, 但酸化程度减缓。同理可知, 在23℃低温实验组中, 低温对水体二氧化碳的溶解度的影响所导致的水体pH增高作用大于低温对沙海蜇块体分解速率的影响所导致的水体 pH降低作用, 使得水体的 pH值一直比本底海水组的低, 故 23℃低温条件下水体发生酸化的情况更严重。27℃实验组和室内模拟实验的室温很接近, 而且与本底海水组的水体pH值相比, 变化幅度较小。就目前全球海水不断升温的情形下, 沙海蜇死亡后的残体会在更短的时间内分解完全, 释放出大量的C、N、P营养元素并使得海水pH在短时间内明显下降, 这将导致附近海域的生态系统结构与功能遭受严重的破坏。
2.6 氮磷比因素对沙海蜇分解过程中pH影响
图9是氮磷比实验组和本底海水组水体同日pH值的差值随时间变化的曲线。由图9可知, 受到投加氮磷比不同的影响, 从沙海蜇分解第2天起, 氮磷比实验组的水体pH一直比本底海水组的高, 直至第7天, 水体pH才下降到与本底海水组pH相当的水平。沙海蜇分解过程中, 在投加不同氮磷比的影响下,水体pH值比本底海水组的水体pH值高, 最大高出0.25个pH单位。
随着氮浓度的增加(即实验中氮磷比增加), 电解质浓度增高, 致使沙海蜇块体先失去水分, 细胞膜破裂延迟, 培养箱中沙海蜇块体的分解速率减慢,即块体向水体释放酸性有机物速度放慢, 导致沙海蜇分解过程中氮磷比实验组的水体 pH值比本底海水组水体pH值高, 沙海蜇分解过程中水体酸化程度虽有减缓, 但水体仍处于酸化状态。富营养化的近海海域(即高浓度的氮磷), 本身环境就处于低氧、酸化状态, 如果暴发沙海蜇, 其消亡会给该海域的环境带来更严重的影响[20]。
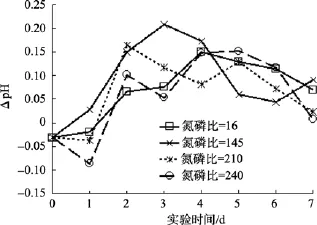
图9 氮磷比因素对沙海蜇分解过程中水体pH的影响Fig. 9 Influence of N/P on the pH of the water during degradation of Nemopilema nomurai
3 结论
沙海蜇的消亡一般需要 5~6 d时间, 但不同因素条件下沙海蜇块体的消亡需要的时间不同, 其消亡顺序为: 30℃温度实验组(4 d), pH实验组、盐度实验组和N/P为16的氮磷比实验组(6 d), 23℃温度实验组(7 d), N/P>16的氮磷比实验组(8 d)。其中高温和高氮磷比(N/P>16)对沙海蜇分解的影响最大; 在高氮浓度(即高氮磷比)的海水中, 沙海蜇残体分解的速率减缓, 并且海水氮的浓度越高, 分解的速率越慢, 全球变暖使得海水升温, 沙海蜇的消亡速率加快, 在更短的时间内分解完全。
沙海蜇消亡过程中水体出现酸化现象。在本底海水组、pH、盐度、温度和氮磷比实验组中, 随着沙海蜇的分解, 水体pH先下降, 达到最小值后缓慢升高, 在沙海蜇块体分解完全时水体 pH稳定在7.2~7.6。
沙海蜇的分解过程中水体 pH达到最小值的先后顺序是: 本底海水组(第2天), 温度组(第3天), pH和盐度组(第4天), 氮磷比组(第5天); 相对而言, 海水 pH、盐度变化或温度降低, 均会导致沙海蜇消亡过程中出现更严重酸化, 而且随着海水盐度的减小,水体pH下降程度更大, 水体酸化情况更严重, 受控因素pH对其的影响亦是如此。而沙海蜇分解过程中海水的氮磷比变化或温度的升高, 均会导致水体 pH变化幅度减小, 酸化程度减缓, 但水体仍发生酸化的现象。
致谢: 感谢中国科学院海洋研究所生物地球化学实验组全体老师及师兄师姐在实验中给予我的帮助和指导, 感谢梁丛丛同学和吕丽莎同学在材料准备中给予帮忙。
[1]宋金明, 马清霞, 李宁, 等. 沙海蜇消亡过程中海水溶解氧变化的模拟研究[J]. 海洋与湖沼, 2012, 43(3):502-506.
[2]李学刚, 李宁, 马清霞, 等. 沙海蜇模拟消亡过程中氮与磷的释放[J]. 海洋与湖沼, 2012, 43(3): 507-512.
[3]West E J, Welsh D T, Pitt K A. Influence of decomposing jellyfish on the sediment oxygen demand and nutrient dynamics[J]. Hydrobiologia, 2009, 616: 151-160.
[4]Pitt K A, Welsh D T, Condon R H. Influence of jellyfish blooms on carbon, nitrogen and phosphorous cycling and plankton production[J]. Hydrobiologia, 2009,616: 133-149.
[5]Titelman J, Riemann L, Sørnes T A, et al. Turnover of dead jellyfish: stimulation and retardation on microbial activity[J].Marine Ecology Progress Series, 2006, 325: 43-58.
[6]黄岁樑, 臧常娟, 杜胜蓝. pH、溶解氧、叶绿素a之间相关性研究Ⅰ:养殖水体[J]. 环境工程学报, 2011,6(5): 1201-1208.
[7]Simpson S D, Munday P L, Wittenrich M L, et al.Ocean acidification erodes crucial auditory behaviour in a marine fish[J]. Biologyletters, 2011, 7: 917-920.
[8]Chauvin A, Denis V, Cuet P. Is the response of coral calcification to seawater acidification related to nutrient loading? [J]. Coral Reefs, 2011, 30: 911-923.
[9]陈清华, 彭海君. 海洋酸化的生态危害研究进展[J].科技导报, 2009, 27(19): 108-111.
[10]程家骅, 李圣法, 丁峰元, 等. 东、黄海大型水母暴发现象及其可能成因浅析[J]. 现代渔业信息, 2004,19(5): 10-12.
[11]李建生, 凌建忠, 程家骅, 等. 2008年夏秋季东海区北部沙海蜇资源状况分析[J]. 海洋渔业, 2009, 31(4):444-449.
[12]江红, 程和琴, 徐海根. 大型水母爆发对东海生态系统中上层能量平衡的影响[J]. 海洋环境科学, 2010,29(1): 91-95.
[13]张芳, 孙松, 李超伦. 海洋水母类生态学研究进展[J].自然科学进展, 2009, 19(2): 121-130.
[14]洪惠馨, 林利民, 张士美. 中国海域钵水母(Scyphomedusae)分类的研究[J]. 厦门水产学院学报,1985, 2: 7-18.
[15]Mills C E. Jellyfish blooms: are populations increasing globally in response to changing ocean conditions? [J].Hydrobiologia, 2001, 451: 55-68.
[16]Tinta T, Malej A, Kos M, et al. Degradation of the Adriatic medusaAureliasp. by ambient bacteria[J].Hydrobiologi, 2010, 645: 179-191.
[17]李艳红, 解庆林, 雷云, 等. 高盐度工业废水优势降解菌的生长特性及应用[J]. 城市环境与城市生态,2008, 21(5): 5-8.
[18]王玉衡, 蒋国昌, 董恒霖. 春季浙江南部海区溶解氧、pH值和营养盐分布特征及相互关系研究[J]. 海洋学报, 1990, l2(5): 654-660.
[19]韦钦胜, 周明, 魏修华, 等. 冬季南黄海海水化学要素的分布特征及变化趋势[J]. 海洋科学进展, 2010,28(3): 353-363.
[20]Cai W J, Hu X P, Huang W J, et al. Acidification of subsurface coastal waters enhanced by eutrophication[J]. Nature Geoscience, 2011, 11(4): 766-770.

