海洋贝类功能基因的研究进展
周小龙 , 郑云云 董迎辉 林志华
(1. 浙江万里学院 浙江省水产种质资源有效利用技术研究重点实验室, 浙江 宁波 315100; 2. 上海海洋大学水产与生命学院, 上海 201306)
本世纪初人类基因组序列图谱的完成从分子水平上揭示了DNA内部结构和遗传机制的本质, 极大地推动了生命科学的发展, 同时也使人们意识到基因资源的巨大科研和商业价值。在此后的 10年间,基因组测序及分析技术取得了一系列重大突破, 大量模式生物基因组数据库相继发布, 生物信息量呈爆发式增长。在海洋贝类方面, 有太平洋牡蛎(Crassostrea gigas)全基因组序列图谱的完成[1]、文蛤(Meretrix meretrix)[2]和虾夷扇贝(Patinopecten yessoensis)[3]转录组以及虾夷扇贝[4]、文蛤[5]、泥蚶(Tegillarca granosa)[6]、缢蛏(Sinonovacula constricta)[7]等多种贝类cDNA文库的成功构建等。如何利用这些海量生物信息来预测、挖掘和鉴定新的重要功能基因并阐明其表达调控机制, 已成为贝类分子遗传学的一个重要发展方向。本文结合近年来的相关文献, 对海洋贝类功能基因的研究方法、现状进行了综述, 同时阐述了现阶段存在的问题。
1 功能基因的结构和研究方法
1.1 功能基因的结构
功能基因是DNA上编码蛋白质或RNA等具有特定功能产物的遗传信息的基本单位。功能基因包括能够转录成相应mRNA并编码蛋白的编码区和起调控作用的非编码区, 在编码区上游有一小段核苷酸序列被称为启动子, 是 RNA聚合酶的结合位点,是转录的起始点, 相应的在编码区下游有一小段核苷酸序列被称为终止子, 是转录的终止点。功能基因的研究就是在了解基因结构的基础上, 确定基因的功能, 主要包括开放阅读框的确定, 基因时空表达的调节机制以及表达产物的功能分析。
1.2 研究功能基因的方法
1.2.1 表达序列标签技术(EST)
EST技术是在建立生物特定组织cDNA文库的基础上, 对文库中的 EST序列进行测序, 然后和GENBANK核酸数据库中已有的cDNA进行相似性检测, 进而得到特定功能基因的技术。该技术在大批量筛选和获得功能基因的研究中有重要的作用, 也是目前研究贝类功能基因最常用的方法。
1.2.2 基因芯片技术(Gene chip)
基因芯片技术是将数以万计的已知核苷酸片段有序的固定在固相载体上, 然后将带有同位素标记或者荧光标记的待检测分子片段与之杂交, 再使用计算机对杂交信号的强弱进行检测和分析, 从而获得待检测分子片段的表达情况。基因芯片技术具有耗时短、效率高的特点, 在疾病检测、多态性分析、筛选和确定功能基因的用途上有巨大的潜力。
1.2.3 转基因技术(Transgenic technology)
转基因又称基因转导, 是将目的基因通过某种手段整合到受体胚胎或者细胞中去, 使之表达外源蛋白, 然后观察受体的生物学变化, 进而了解目的基因在受体中的功能, 转基因是研究基因功能最常用、最成熟的技术之一[8]。早在1985年朱作言院士就成功的获得了转基因鲫[9], 现正努力实现转基因鱼的商品化。
1.2.4 基因打靶技术(Gene targeting)
基因打靶是在同源重组的理论基础上, 利用受体细胞基因组和与之有相同或者相似序列的外源基因片段发生同源重组的手段, 将目的基因整合到受体基因组中并表达, 从而研究目的基因功能的一项技术。该技术近年来还演化出一种新的技术—— 基因诱捕, 基本原理是: 插入的DNA使内源基因突变,并在被诱捕序列启动子的转录控制下, 表达插入的报告基因以鉴定突变[8]。
1.2.5 建立遗传连锁图谱(Genetic linkage map)
遗传连锁图谱是指以遗传距离表示基因组内基因以及专一的多态性DNA标记相对位置的图谱, 完成遗传图谱就可以对其功能基因进行准确的定位, 这对于功能基因的克隆和优良品种的选育具有重大的意义。
1.2.6 RNA干涉(RNA interference, RNAi)
RNA 干涉是指外源或内源性的双链RNA(dsRNA)导入细胞后引发生物体内基因的同源序列降解, 从而使基因转录后表现出沉默的现象[8]。通过形成 dsRNA, 产生RNA干涉, 使目的基因沉默, 从而进一步研究目的基因的功能, 这种特性使得 RNAi在功能基因组的研究中, 成为一种强有力的工具。
2 国内外海洋贝类功能基因的研究进展
2.1 生长发育调控基因研究
贝类的生长速度、体型大小、肉质鲜度等经济性状是科研工作者关注的焦点, 因此与之相关的生长、发育、代谢相关基因向来是功能基因研究的重点。在海洋经济贝类中也已经展开了大量相关研究,近年来报道的与生长发育调控相关的基因列于表1。

表1 贝类生长和发育相关基因
肌动蛋白(actin)基因是在海洋贝类中研究比较多的功能基因, 在肌原纤维、细胞迁移、胞浆移动、染色体分离、细胞分裂与分化、细胞内吞和外排、信号转导等多方面发挥着重要作用[32-37]。脊椎动物中, 已鉴定出6种actin蛋白。尽管已经有多种海洋贝类的actin基因被克隆出来, 但只检测出α、β两种类型的actin基因。
肌球蛋白基因也是一类研究的比较多的基因,尤其是在扇贝中。肌球蛋白广泛参与细胞的活动, 包括细胞迁移、跨膜运输、细胞器定位、信号传导及RNA定位等, 不同种类的肌球蛋白各自行使不同的功能[38]。
除此之外, 还有一些在贝类生长发育过程中起重要作用的酶类, 其基因已经被成功地克隆出来。王嘉[27]通过 RACE法克隆获得了皱纹盘鲍(Haliotis discus hannai)L-古洛糖酸-l,4-内酯氧化酶(GLO)的基因全长序列。这是国际上第一次从除原生动物利什曼原虫之外的无脊椎动物上克隆出GLO的cDNA全长序列, 证明了皱纹盘鲍有 GLO活性, 进而推翻了此前认为无脊椎动物没有VC合成能力的假设。
还有与珍珠质形成或外套膜代谢相关的基因,研究比较多的有nacrein蛋白基因及其类似基质蛋白的基因, nacrein蛋白具有催化 CO2水合反应和结合 Ca2+的功能, 这类蛋白可能参与珍珠层碳酸钙晶体的形成, 对碳酸钙晶体的沉淀具有负调节作用。
2.2 抗逆相关功能基因
近年来贝类频频发生大规模的病害事件, 不仅造成了大量的经济损失, 而且影响了人们对贝类养殖业健康发展的信心。为了改良种质, 培养具有更高抗逆能力的品系, 贝类抗逆相关基因的筛选和分析成为了贝类功能基因研究中的热点。其中抗氧化酶基因、热休克蛋白基因、金属硫蛋白基因是迄今研究比较多的海洋贝类抗逆相关基因。
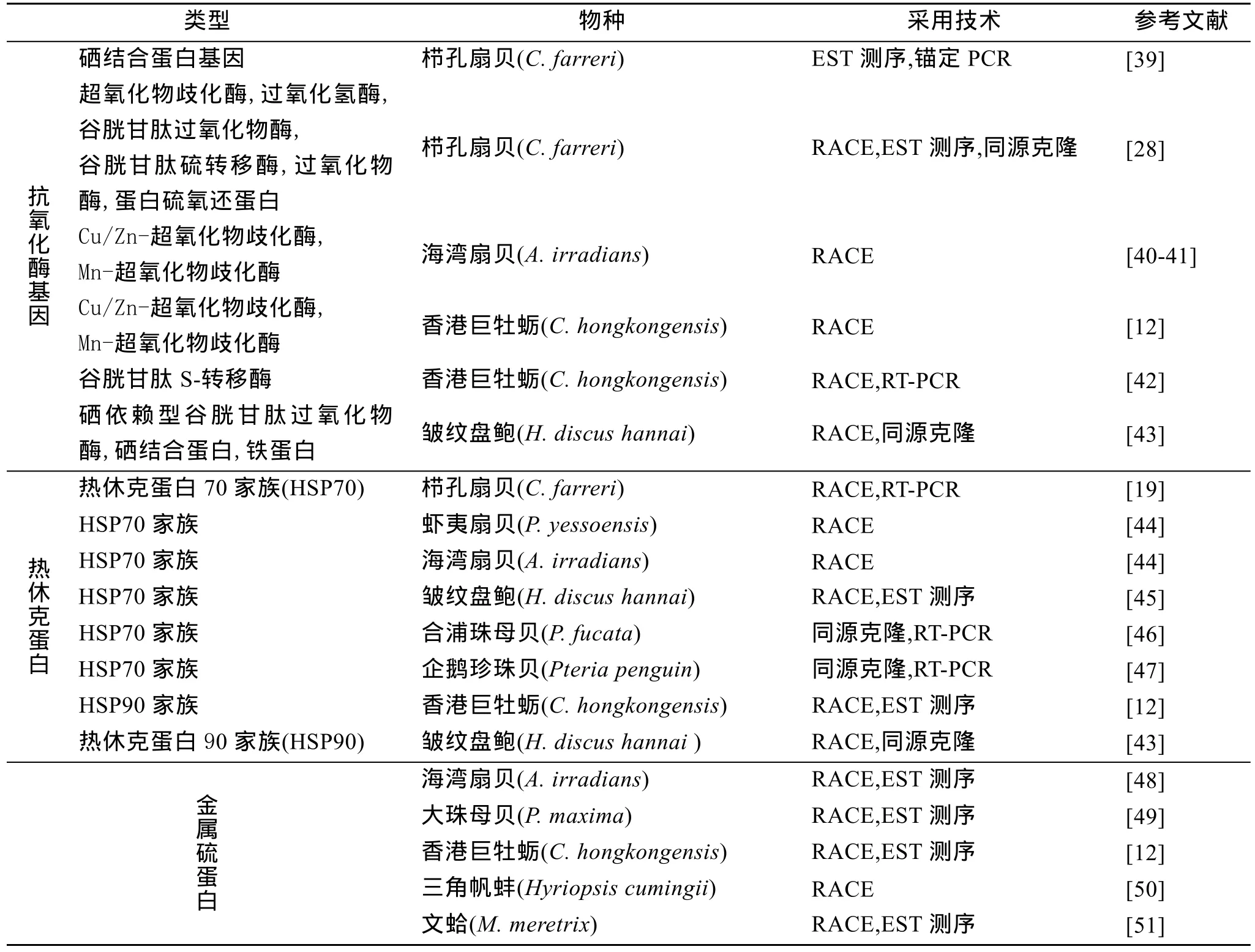
表2 贝类抗逆相关基因
超氧化物歧化酶、过氧化氢酶、过氧化物酶等所构成的抗氧化酶系统在动物机体内发挥了重要的调节功能, 以维持氧化和抗氧化之间的动态平衡,可以有效地防止过量活性氧对机体造成损伤[52-53]。近年来关于抗氧化酶基因的研究相当丰富, 在栉孔扇贝(Chlamys farreri)[28-39]、香港巨牡蛎(C. hongkongensis)[42]、皱纹盘鲍[43]等多种贝类中克隆得到了多种类型的抗氧化酶基因。
热休克蛋白(HSP)是另一类与抗逆相关的蛋白,生物体在受到高温胁迫、缺氧、重金属离子、氨基酸类似物等应激刺激下, 以及机体内的生理改变,都可以导致细胞发生热休克反应[54]。HSP70家族是热休克蛋白超家族的重要成员, 也是在贝类中研究最多的热休克蛋白, 栉孔扇贝[19]、虾夷扇贝、海湾扇贝(Argopecten irradians)[44]、皱纹盘鲍[45]、合浦珠母贝(Pinctada fucata)和企鹅珍珠贝(Pteria penguin)[46-47]等贝类的HSP70基因已经成功克隆。并有学者利用流式细胞术对高温、低温、细胞感染、水质恶化等特定条件下栉孔扇贝、虾夷扇贝、海湾扇贝不同组织中HSP70的诱导和基因表达进行了初步研究[44]。此外还得到了香港巨牡蛎和皱纹盘鲍HSP90 基因[12,43]。
金属硫蛋白 (metallothionein, MT)基因也是一类重要的抗逆相关基因, 其在生物体内参与细胞内金属的稳态调节、重金属解毒、清除自由基、抵抗电离辐射等, 具有较强的生物学功能。在应用上由于MT基因的可诱导性、易选择性和高水平表达的特点,常将 MT的启动子连接在要表达的某些蛋白质的结构基因前面, 从而使外源基因可以高效可控地表达出来[55]。另外, 经常将 MT作为重金属污染的一种早期生物反应, 例如贻贝整体软组织或鳃中 MT的水平可作为环境中Cd、Hg、Ag和Cu污染的生物标志[56-57]。目前, 已知克隆出 MT基因的贝类有海湾扇贝[48]、大珠母贝(P. maxima)[49]、香港巨牡蛎[12]、三角帆蚌(Hyriopsis cumingii)[50]、文蛤[51]等。还有研究证明了镉刺激和鳗弧菌均能诱导海湾扇贝MT基因(AIMT)的表达, 推测 AIMT在一定程度上参与了海湾扇贝与病原相互作用的过程[48]。
另外太平洋牡蛎(C. gigas)胁迫相关基因铁硫蛋白(Rieske protein)也得到成功克隆, 组织分布表明,铁硫蛋白在多种组织中都具有广泛表达, 其中在闭壳肌中的表达量最高; GFP融合表达和细胞转染的结果表明, 铁硫蛋白主要定位于线粒体上[12]。
2.3 抗病相关功能基因
2.3.1 贝类固有免疫概况
贝类等无脊椎动物抵御病害主要依靠固有免疫,即依靠血细胞的吞噬作用和血淋巴中各种非特异性免疫活性因子的复杂作用, 来实现机体对外来物的防御。固有免疫曾一直被认为是向获得性免疫进化的初级形式, 是一种应答外界刺激的低级表现。但近十几年来, 随着对免疫系统研究的深入, 固有免疫的重要性越来越显现出来。贝类免疫过程可分为非己识别、丝氨酸蛋白级联反应、病原清除三个阶段,相关基因分类比较明确, 具体基因种类和相应信息见表3。
2.3.2 非己识别相关功能基因
1997年美国免疫学家 Janeway[74]揭示了先天性免疫识别分子作用的本质, 即宿主通过有限量胚系基因编码的模式识别受体(Pattern recognition receptors, PRRs), 从而识别具有病原相关分子模式(PAMPs)结构的各种病原体。根据目前的研究结果,无脊椎动物固有免疫相关的 PRRs在结构上主要可分为7种类型: C-型凝集素、硫依赖型凝集素、肽聚糖识别蛋白、硫酯蛋白、革兰氏阴性菌结合蛋白、清道夫受体和类Toll受体[75-76]。
目前在海洋贝类中关于栉孔扇贝模式识别受体的报道最多, 已经克隆出了其 C-型凝集素[58]、脂多糖葡聚糖结合蛋白(LGBP)基因、肽聚糖识别蛋白(PGRP-S1)基因[61]、四个类Toll受体信号通路基因[62]以及含硫酯蛋白、含Clq结构域蛋白[59]等多种基因。其中邱丽梅[62]获得的 CfMyd88基因, 是在软体动物中获得的第一个类 Toll受体的接头分子, 该结果直接证明软体动物具有与哺乳动物和节肢动物高度类似Myd88依赖的Toll样受体信号通路。此外, 在海湾扇贝中也克隆出了C型凝集素[59]、含C1q结构域蛋白基因[60]等模式识别受体基因。
2.3.3 丝氨酸蛋白级联反应相关功能基因
非己识别引发了激活丝氨酸蛋白酶和解除丝氨酸蛋白酶抑制剂的细胞级联反应, 从而将受到感染的信号放大为更强的“危险”信号或解除错误警报, 这个过程称为信号的调整和放大, 然后引发信号转导途径,进而引发目的基因转录以及蛋白合成。丝氨酸蛋白酶抑制剂(SPI)通过与靶酶相互结合形成稳定的复合体,从而防止生物体内丝氨酸蛋白酶的有害水解激活, 在无脊椎动物的免疫应答中起着核心作用。
SPI主要有以下四类: Kazal家族、Kunitz家族、Serpin家族以及 α-巨球蛋白。目前的研究主要集中在Kazal家族和Kunitz家族, 而对于另两种丝氨酸蛋白酶抑制剂基因鲜有报道。

表3 贝类固有免疫相关基因
2.3.4 病原清除相关免疫因子
贝类主要依靠细胞免疫和体液免疫来清除病原体。细胞免疫主要指当病原体穿透体表物理屏障、进入血淋巴后引发的一系列细胞防御反应, 包括吞噬作用、结节形成、包囊作用和凝集反应等。体液免疫因子包括组成性表达或诱导产生的活性分子,主要是血淋巴中具有抗菌、抗病毒、溶菌、识别及凝集活性的效应物, 包括各类抗菌因子、抗病毒因子、凝血因子、细胞激活因子、识别因子、凝集素、溶血素、溶菌酶及水解酶等各种具有免疫活性的物质。
溶菌酶是一种碱性蛋白, 它能催化细菌细胞壁中肽聚糖 N-乙酰葡萄糖胺和 N-乙酰胞壁酸之间的β-1, 4糖苷键的水解, 导致细菌细胞壁破裂、内容物逸出而使细菌死亡[77]。溶菌酶主要杀灭革兰氏阳性菌和部分革兰氏阴性菌, 其在贝类免疫中发挥着重要作用。在海洋贝类中, 目前已经有十多种贝类的溶菌酶基因被成功克隆。值得注意的是, 得到的大部分是i-型溶菌酶基因, 仅从海湾扇贝和栉孔扇贝中克隆得到g-型溶菌酶基因[39], 从皱纹盘鲍中得到c-型溶菌酶基因[71]。
抗菌肽是指由特定基因编码的一类具有抗菌活性的双亲性小分子碱性多肽, 是无脊椎动物的关键免疫因子。早在 2000年, 就从贻贝(Mytilus edulis)和地中海贻贝(M. galloprovincialis)体内分离纯化出了四类抗菌肽: 防御素(MGD)、贻贝素(Mytilin)、贻贝肽(Myticin)、抗真菌的贻贝霉素(Mytimycin)[72-73]。但是目前只克隆了MytilinB和MGD-2的基因。近年来, 从海湾扇贝血淋巴中克隆到了大防御素基因(big defensin, AiBD)的全长cDNA序列, 并且通过抑菌实验证明了 AiBD具有广谱抗菌活性[66]。还得到了栉孔扇贝核心组蛋白群的全长序列[65], 包括H2B, H2A,H3和H4这四种组蛋白, 还对H2A基因N末端39个氨基酸进行了重组表达和抗菌活性分析, 证实了栉孔扇贝H2A对于革兰氏阴性菌、革兰氏阳性菌和真菌均具有一定的杀菌活性, 确认了该多肽是一种潜在的抗菌肽。
3 贝类功能基因研究存在的问题
当今, 海洋生物资源开发和利用已成为世界各国解决资源问题的有效途径, 对水产动物基因领域的研究, 尤其是重要功能基因的研究已显得愈发迫切。迄今, 对海洋贝类功能基因的研究已经获得了一定成果, 各种分子生物学技术在研究贝类功能基因的过程中发挥了重要作用, 大量功能基因被人们成功地克隆出来。但是, 应该看到贝类功能基因的研究, 相对于哺乳动物甚至鱼类功能基因的研究来说还是处于初级阶段, 还有很多问题亟待解决。
3.1 在海洋贝类功能基因的研究中使用的方法比较单一
目前普遍使用的方法是依托EST文库的基因片段测序和同源克隆, 在高等生物上已经应用的方法如基因芯片技术、基因打靶技术、蛋白质组学技术、转基因技术、RNA干涉等, 由于贝类的物种特殊性,还缺乏有效方法将这些技术应用到贝类功能基因的研究上来。例如, 在鱼类中广泛应用的转基因技术,在贝类则由于一直没有成功建立体外细胞系而无法应用。
3.2 研究的海洋贝类种类还比较局限
纵观现有报道可以发现, 大部分研究是关于牡蛎、扇贝、皱纹盘鲍, 而同样作为我国重要经济贝类的蛤、蚶、蛏等的研究报道相对较少。现在牡蛎基因组序列图谱已绘制完成, 以此为基础, 可以通过同源比对法和同线性分析法, 有效、迅速地挖掘其他海洋贝类功能基因。
3.3 功能基因研究的深度还远远不够
目前的研究通常停留在贝类基因克隆、结构分析和功能预测方面, 但是对于功能基因的功能验证、在体内表达的变化规律和调控机制的研究还不够深入, 还无法阐明基因型和表型的关系, 难以将功能基因研究成果作为育种实践的指导。
[1]廖洋. 水产养殖研究进入基因组时代[N]. 科学时报,2010-7-28(2).
[2]Huan P, Wang H X, Liu B Z. Transcriptomic Analysis of the clamMeretrix meretrixon different larval stages[J]. Marine Biotechnology,2011, 10:1007-1012.
[3]Hou Rui, Bao Zhenmin, Wang Shan, et al.Transcriptome sequencing and de novo analysisfor yesso scallop(Patinopecten yessoensis)using 454 GS FLX[J]. Plos One, 2011, 6(6): 1-7.
[4]李云峰, 刘卫东, 高祥刚, 等. 虾夷扇贝外套膜和肾脏组织cDNA文库构建以及EST的初步分析[J]. 中国水产科学, 2010, 17(3): 578-55.
[5]高祥刚, 李云峰, 宋文涛, 等. 文蛤肠、外套膜和肝胰脏组织cDNA文库构建及其ESTs序列分析[J]. 中国水产科学, 2010, 17(2):344-350.
[6]贺静静, 李晔, 李太武, 等. 泥蚶(Tegillarca granosa)cDNA 文库的构建及铁结合蛋白基因(Ferritin)序列分析[J]. 海洋与湖沼, 2009, 40(3): 289-295.
[7]秦玉明, 苏秀榕, 李晔, 等. 缢蛏(Sinonovacula constricta)cDNA文库的构建及肌动蛋白基因的研究[J].海洋与湖沼, 2010, 41(01): 54-60.
[8]李新枝, 蔡佩玲, 牟林春. 基因功能研究的方法[J].四川解剖学杂志, 2007, 15(1): 57-59.
[9]Zhu Z Y. Novel gene transfer into the fertilized goldfish(Carassius auratus)[J]. Z Angew Ichthyol, 1985, 1:31-34.
[10]邵明瑜. 栉孔扇贝生殖相关基因 DEAD-box家族和boule的cDNA克隆及其发育表达图式[D]. 青岛: 中国海洋大学, 2007.
[11]王晓梅. 文蛤(Meretrix meretrix)幼虫生长发育相关基因的克隆和功能分析[D]. 青岛: 中国科学院海洋研究所, 2008.
[12]付定坤, 何小翠, 张扬, 等. 牡蛎盐度胁迫相关基因的初步筛选、克隆及其功能分析[C]//中国动物学会.中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编. 青岛: 中国海洋湖沼学会, 2009.
[13]Hu X L, Guo H H, He Y, et al. Molecular characterization of myostatin gene from zhikong scallopChlamys farreri(Jones et Preston 1904)[J]. Genes Genet Syst, 2010, 85: 207-218.
[14]于非非, 桂建芳, 周莉, 等. 马氏珠母贝 Dmrt5基因的克隆及时序表达模式分析[J]. 水生生物学报, 2009,33(5): 844-850.
[15]石耀华, 王嫣, 顾志峰, 等. 马氏珠母贝Rab7基因的克隆及其表达特征分析[J]. 渔业科学进展, 2010,31(2): 72-79.
[16]Nyitray L J. Scallop striated and smooth muscle myosin heavy-chain isoforms are produced by alternative RNA splicing from a single gene[J]. Proc Natl Acad Sci,1994, 91: 12686-12690.
[17]Hasegwa Y. Identification of a novel unconventional myosin from scallop mantle tissue[J]. Biochem, 2002,131:113-119.
[18]Hasegwa Y. Isolation of a cDNA encoding the motor domain of nonmuscle myosin which is specifically expressed in the mantle pallial cell layer of scallop(Patinopecten yessoensis)[J]. Biochem, 2000, 128:983-988.
[19]胡晓丽. 高温胁迫和鳗弧菌感染对栉孔扇贝基因表达影响的分析及相关基因的克隆与表达[D]. 青岛:中国海洋大学, 2005.
[20]马洪明. 栉孔扇贝血细胞形态学研究和抗病功能基因的克隆[D]. 青岛: 中国海洋大学, 2004.
[21]凌立, 谢莉萍, 张勇, 等. 合浦珠母贝β-肌动蛋白基因的克隆和序列分析[J]. 海洋科学, 2006, 30(8):64-70.
[22]刘卫东, 赫崇波, 刘彤, 等. 虾夷扇贝肌动蛋白基因cDNA序列克隆与分析[J]. 水产科学, 2008, 27(10):519 -522.
[23]林群, 梁旭方, 王琳, 等. 近江牡蛎等 7种养殖鱼虾贝类参照基因 β-肌动蛋白 cDNA序列的克隆与比较分析[J]. 生态毒理学报, 2008, 3(3): 256-261.
[24]傅立元, 高祥刚, 李云峰, 等. 虾夷扇贝 β-actin基因的克隆和序列分析[J]. 生物技术通报, 2010, (4):128-131.
[25]郭慧慧, 包振民, 胡晓丽. 扇贝细胞色素酶 P450的克隆及表达分析[C]//中国动物学会.中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编.青岛: 中国海洋湖沼学会, 2009.
[26]周驰, 李纯厚, 张为民, 等. 翡翠贻贝 CYP4基因克隆及其表达水平分析[J]. 热带海洋学报, 2010, 29(4):82-88.
[27]王嘉. 皱纹盘鲍(Haliotis discus hannaiIno.)L-古洛糖酸-1,4-内酯氧化酶(GLO)的研究[D]. 青岛: 中国海洋大学, 2010.
[28]倪多娇. 栉孔扇贝抗氧化酶基因的克隆与表达分析[D]. 青岛: 中国科学院海洋研究所, 2007.
[29]喻达辉, 王玉梅. 大珠母贝基因克隆研究[C]//中国动物学会. 中国海洋湖沼学会贝类学会分会第十四次学会研讨会论文摘要汇编. 青岛: 中国海洋湖沼学会, 2009.
[30]王玉梅, 夏建红, 黄桂菊, 等. 大珠母贝外套膜基因PMMG1的克隆、表达及其特征分析[J]. 海洋学报(中文版), 2010, 32(3): 121-128.
[31]王玉梅, 夏建红, 唐仁生, 等. 大珠母贝珍珠质相关基因N36和 N45的克隆与序列特征分析[J]. 上海海洋大学学报, 2011, (1): 8-14.
[32]Schroeder T E. Actin in dividing cells: Evidence for its role in cleavage but not mitosis.“Cell Motility”[C]//Cold Spring Harbor Conferences on Cell Proliferation. Ny: Cold Spring Harbor Laboratory, 1976, 3:265-277.
[33]Mollenhauer H, Morre D. Cytochalasin but not cholchicine inhibits migration of secretory vesicles in root tips of maize [J]. Protoplasma, 1976, 87: 39-48.
[34]Brawley S, Quatrano R S. Sulfation of fucoidan in Fucus embryos[J]. Dev Biol, 1979, 73: 193-205.
[35]Pollard T, Selden C, Maupin P. Interaction of actin filaments with microtubules[J]. J Cell Biol, 1984, 99:335-375.
[36]Pollard T D, Weihing R. Cytoplasmic actin and myosin and cell movement[J]. Crit Rev Biochem, 1974, 2:1-65.
[37]Hightower R C, Meagher R B. The molecular evolution of actin [J]. Genetics, 1986, 114: 315-332.
[38]Baker J P, Titus M A. Myosins:Macthing functions with motors[J]. Curr Opin Cell Biol, 1998, 10: 80-86.
[39]邹慧斌. 栉孔扇贝和海湾扇贝 G型溶菌酶基因及栉孔扇贝硒结合蛋白基因的克隆和表达研究[D]. 青岛:中国海洋大学, 2005.
[40]Bao Y B, Li L, Wu Q, et al.Cloning, characterization,and expression analysis of extracellular copper/zinc superoxide dismutase gene from bay scallopArgopecten irradians[J].Fish and Shell fi sh Immunology, 2009,27: 17-25.
[41]Yongbo Bao, Li Li, Guofan Zhang. The manganese superoxide dismutase gene in bay scallopArgopecten irradians: Cloning, 3D modelling and mRNA expression[J]. Fish and Shell fi sh Immunology, 2008, 25:425-432.
[42]林群, 梁旭方, 胡永乐, 等. 近江牡蛎 4种类型 GST基因 cDNA全序列的克隆与分析[J]. 生态毒理学报,2009, 4(2): 237-243.
[43]吴成龙. 皱纹盘鲍抗氧化基因的克隆及其在营养调控下表达的研究[D]. 青岛: 中国海洋大学, 2010.
[44]曲凌云. 三种养殖扇贝热休克蛋白 HSP70在逆境因子下的表达和相关基因的克隆[D]. 青岛: 中国科学院海洋研究所, 2004.
[45]Cheng P, Liu X, Zhang G, et al. Cloning and expression analysis of a HSP70 gene from Pacific abalone(Haliotis discus hannai)[J]. Fish and Shellfish Immunology, 2007, 22(1-2):77-87.
[46]黄桂菊, 曲妮妮, 喻达辉, 等. 合浦珠母贝热休克蛋白HSP70基因的克隆与表达分析[J]. 中国水产科学,2007, 14(5): 726-732.
[47]黄桂菊, 喻达辉, 曲妮妮, 等. 企鹅珍珠贝热休克蛋白70基因的克隆与序列比较分析[J]. 热带海洋学报,2008, 27(1): 46-51.
[48]刘维青. 海湾扇贝金属硫蛋白 cDNA序列克隆及其在镉和鳗弧菌诱导下的表达研究[D]. 青岛: 中国海洋大学, 2005.
[49]唐仁生, 夏建红, 王玉梅, 等. 大珠母贝(Pinctada maxima)金属硫蛋白 cDNA克隆与序列特征分析[J].福建水产, 2009, (1): 31-36.
[50]袁一鸣, 汪桂玲, 李家乐. 三角帆蚌金属硫蛋白基因的克隆及序列分析[J]. 动物学杂志, 2009, 44(5):98-104.
[51]高祥刚, 赫崇波, 李云峰, 等. 文蛤金属硫蛋白基因的克隆与分析[J]. 水产学杂志, 2009, (4): 8-11.
[52]Nishikimi M, Yagi K. Molecular basis for the deficiency in humans of gulonolactone oxidase, a key enzyme for ascorbic acid biosynthesis[J]. Ameriean Journal of Clinical Nutrition. 1991, 54(6):1203-1208.
[53]王海涛, 杨祥良, 徐辉碧. 活性氧的信号分子作用[J].生命的化学, 2001, 21(1): 39-41.
[54]谷文萍. 热休克蛋白 70研究进展[J]. 国际神经病学神经外科学杂志, 1999, 26(2):57-59.
[55]Klaassen, C D. The induction of metallothionein[J]. Am Coll Toxicol, 1998, 8(7):1315-1321.
[56]Bebianno M J, Langston W J. Cadmium induction of metallothionen synthesis inMytilus galloprovincialis[J].Comparative Biochemisty and Physiology, 1992, 103:79-85.
[57]Bebianno M J, Serafim M A. Comparison of metallothionein induction in response to cadmium in the gills of the bivavle molluscsMytilus galloprovincialisandRuditapes decussatus[J]. The Science of the Total Environment, 1998, 214:123-131.
[58]胥炜. 海湾扇贝和栉孔扇贝 EST分析及 C型凝集素基因的克隆与分析[D]. 青岛: 中国科学院海洋研究所, 2004.
[59]张峘. 扇贝补体样成分的基因及其功能研究[D]. 青岛: 中国科学院海洋研究所, 2010.
[60]孔鹏飞. 海湾扇贝补体样成分 AiC1qDC-1基因克隆及其功能的研究[D]. 青岛: 中国科学院海洋研究所,2010.
[61]苏建国. 栉孔扇贝两种模式识别受体基因的克隆与表达的研究[D]. 青岛: 中国科学院海洋研究所,2005.
[62]邱丽梅. 栉孔扇贝 Toll样受体及其信号传递相关基因的克隆与表达[D]. 青岛: 中国科学院海洋研究所,2006.
[63]朱玲. 扇贝丝氨酸蛋白酶及其抑制剂基因的克隆与表达[D]. 青岛: 中国科学院海洋研究所, 2006.
[64]王波. 扇贝丝氨酸蛋白酶抑制剂基因 CfKZSPI及Aikunitz的克隆与重组表达[D]. 青岛: 中国科学院海洋研究所, 2008.
[65]李成华. 栉孔扇贝核心组蛋白的基因结构及 H2A抗菌活性的研究[D]. 青岛: 中国科学院海洋研究所,2007.
[66]赵建民. 扇贝大防御素和 G型溶菌酶的基因克隆与重组表达[D]. 青岛: 中国科学院海洋研究所, 2006.
[67]Nilsen I W, Sandsdalen E, Sandaker E, et al. Protein Purification and gene isolation of chlamysin, a coldactive lysozyme-like enzyme with antibacterial activity[J].FEBS Lett,1999,464:153~158.
[68]Bachali S, Jager M, Hassanin A, et al. Phylogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function[J]. J Mol Evol, 2002, 54(5):652-664.
[69]Xue Q G, Itoh N, Schey K L, et al. A new lysozyme from the eastern oyster(Crassostrea virginica)indicates adaptive evolution of i-type lysozymes[J]. Cell Mol Life Sci, 2007, 64: 82-95.
[70]Olsen M, Nilsen I W, Sletten K et al. Multiple invertebrate lysozymes in blue mussel(Mytilus edulis)[J].Comp Biochem Physiol B, 2003, 136:107-115.
[71]Ding J F, Li J, Bao Y B. Molecular characterization of a mollusk chicken-type lysozyme gene fromHaliotis discus hannaiIno., and the antimicrobial activity of its recombinant protein[J]. Fish and Shellfish Immunology,2011, 30(1): 163-172.
[72]Guillaume M, Vandenbulcke F, Roch P. Original involvement of antimicrobial peptides in mussel Innate immunity[J]. FEBS Letters, 2000, 486(3): 185-190.
[73]Guillaume M, Florence H, Elisabeth A, et al. Mytilin B and MGD2, two antimicrobial peptides of marine mussels: gene structure and expression analysis[J].Developmental & Comparative Immunology, 2000,24(4): 381-393.
[74]Janeway, C A J. The immune system evolved to discriminate infectious nonself from noninfectious self[J].Immunology Today, 1992, 13(1): 11-16.
[75]Christophides, G K, Zdobnov, et al. Immunity-related genes and gene families inAnopheles gambiae[J]. Science, 2002, 298: 159-165.
[76]Hultmark, D. Drosophila immunity: paths and patterns[J]. Curr Opin Immunol, 2003, 15: 12-19.
[77]Jollès P, Jollès J. What's new in lysozyme research?[J]. Mol Cell Biochem, 1984, 63: 165-189.

