猪sall4b基因的克隆及表达分析
张鑫淼,韩小娇,何文腾,刘世超,牟彦双,胡魁,刘忠华
东北农业大学生命科学学院 胚胎工程实验室,黑龙江 哈尔滨 150030
动物及兽医生物技术
猪sall4b基因的克隆及表达分析
张鑫淼,韩小娇,何文腾,刘世超,牟彦双,胡魁,刘忠华
东北农业大学生命科学学院 胚胎工程实验室,黑龙江 哈尔滨 150030
sall4基因是sall基因家族的一个成员,在胚胎发育、器官形成和干细胞多能性的维持以及重建中都起到重要作用,有sall4a和sall4b两种剪切突变体类型。目前猪的sall4基因序列尚未获得。鉴于其在多能性细胞调控中的作用,对猪的sall4基因进行了克隆测序,并对其在各组织及胚胎中的表达进行了初步研究。通过5¢和3¢RACE克隆得到猪sall4基因cDNA全长序列 (2 372 bp),序列分析证明此基因编码的蛋白结构更接近于小鼠和人Sall4B亚型,同源性可达70%~80%,而与其他物种的Sall4A相比则缺少一段含锌指结构域的片段,同源性降至30%~55%。Real-time PCR证明猪sall4b基因广泛表达于猪的各种器官,其中除卵巢组织呈高量表达之外,脾、肺、心和睾丸表达量也相对较高;在早期胚胎发育过程中除 4-细胞阶段相对表达量较低,其他阶段呈高量表达。免疫荧光跟踪Sall4在猪早期胚胎中的表达情况发现Sall4在着床前胚胎中全程表达并定位于细胞核中,在囊胚阶段基因表达趋向于定位在内细胞团中。表达分析证明sall4b基因与多能性紧密相关,预示着猪sall4b基因将可能作为新的重编程因子用于诱导猪多能干细胞的体系中。
sall4,基因克隆,基因表达,胚胎,猪
Abstract:sall4, a member ofsall4gene family, plays important roles in embryo development; organogenesis as well as pluripotency maintenance and re-establishment. There are two isoforms of Sall4, Sall4A and Sall4B. The sequence of porcinesall4gene is still not reported. Because of its distinct role in maintaining the pluripotent state of stem cells, wecloned and sequenced porcinesall4gene and assessed its expression in pig tissues and embryos. One 2 372 bp nucleotide sequence representing the full-length cDNA of pigsall4was obtained by 5¢and 3¢RACE. Analyses of putative protein sequence showed a 70% to 80% identity with isoform Sall4B of human and mouse. Comparing with Sall4A, the identity reduced to 30% to 55% because of the loss of a zinc-finger domain-rich fragment. Assessment ofsall4bexpression in porcine tissues by Real-time PCR showed that it expressed most strongly in ovary and stronger in spleen, lung, heart and testis. For preimplantation embryos, the expression level was lower in 4-cell embryos compared with other stages.Immuno-fluorescence analysis of Sall4 on porcine preimplantation embryos indicated that it expressed in all the preimplantation embryos and located in nucleus, in blastocyst it preferentially limited in ICM cells. Expression pattern in early embryos suggest that pigsall4bis associated with pluripotency and might be a new and useful reprogramming factor for establishing pig induced pluripotent stem cell lines.
Keywords:sall4, gene cloning, gene expression, embryo, pig
sall4属于婆罗双树样基因 (splat-like/sall)家族成员,最初在研究人类常染色体显性遗传病Okihiro综合征时被发现并鉴定。sall4基因突变导致四肢畸形、眼球运动缺陷、直肠、耳、心和肾的发育异常[1-2],而在小鼠中双敲除sall4基因则直接导致植入初期胚胎致死[3-4],证明sall4基因对于早期胚胎发育是不可或缺的。sall4基因缺失的小鼠胚胎难以建立胚胎干细胞系[3,5],在细胞融合[6]和多能因子[5]介导的重编程中都证明了高量表达sall4基因能够提高重编程效率,说明sall4对多能性的维持及重建都起到关键作用。最近在人[7]和小鼠[8]中发现sall4基因由于选择性剪切可以形成两种不同的剪切突变体sall4a和sall4b。与sall4a相比,sall4b缺失了第二外显子的大部分区域,在小鼠胚胎干细胞中更趋于高表达。当只表达一种亚型时,sall4b单独即可维持干细胞的多能性状态[8],提示sall4b可作为建立诱导多能性干细胞(Induced pluripotent stem cells,iPS cells) 的重要诱导因子。
虽然sall4b基因的结构和功能在小鼠和人上得到初步的研究,但在其他物种中还并没有获得同样的剪切变异体。猪作为一种重要的动物模型,在代谢和器官大小方面都与人有极高的相似性,具有很高的研究价值[9-11]。多能性干细胞是疾病模型建立、疾病机理研究和医学再生领域的重要的实验材料。但是目前为止,尚未建立真正具有形成嵌合体能力的猪胚胎干细胞。自 2009年以来,先后有几个研究组报道了猪iPS细胞的建立[12-15],但目前为止只有一个研究组初步证明了他们建立的iPS细胞系可能具有形成嵌合体的能力[16]。其中一个重要的原因可能是目前适用于小鼠和人的重编程因子组合并不足以完全重编程猪的分化细胞至多能性干细胞状态。猪sall4b基因的克隆对完全重编程iPS细胞系的建立和多能性维持机制的研究具有重要意义。
1 材料与方法
1.1 材料
新生大白仔猪购买于哈尔滨市三原种猪场,在实验室解剖取材,将取得的各器官组织样 (包括肾、肠、脾、胃、肺、肝、脑、心肌、骨骼肌、睾丸、脂肪、卵巢) 保存于液氮中。用于克隆基因的卵巢组织来自于当地屠宰场,收集后尽快保存于液氮中,用于提取RNA。
1.2 主要试剂
TRIzol试剂盒购自Invitrogen公司;PCR试剂盒、SYBR荧光实时定量 PCR试剂盒、pMD18-T载体均购自TaKaRa公司;琼脂糖粉剂购自 Amresco公司;反转试剂盒购自ABI公司和TaKaRa公司;免疫荧光抗体一抗购自GeneTex公司,二抗购自Santa Cruz公司。
1.3 RNA提取与反转cDNA
用 TRIzol试剂将性成熟猪卵巢按照标准方案提取 RNA,并溶解于DEPC处理水中,以此为模板用反转录试剂盒 (ABI) 反转录为cDNA。新生猪各组织用同样方法获得 RNA,反转为cDNA时使用 TaKaRa公司反转试剂盒,用于Real-time检测。引物序列具体见表2。
1.4 PCR 扩增与 5¢ RACR 与 3¢ RACE
反应体系25 μL∶1 μL模板cDNA,上下游引物混合物 1 μL (浓度各为 10 μmol/L),dNTPs 2.5 μL,Pfu酶 0.2 μL,10×缓冲液 2.5 μL 溶解于17.8 μL灭菌去离子水中。引物序列与反应条件详见表 1。5¢RACR 与 3¢RACE 用于获得sall4bmRAN全长,按照TaKaRa公司试剂盒说明书标准操作。
1.5 序列分析、比对分析与系统树分析
开放读码框分析使用NCBI工具ORF finder(www.ncbi.nlm.nih.gov/gorf/)并翻译为相应的氨基酸序列。蛋白结构域分析使用 SMRAT(http://smart.embl-heidelberg.de/)与NCBI CDD数据库 (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),序列比对使用ClustalX2软件,比对序列由 NCBI数据库提供。系统树分析采用MEGA5.1软件进行。理论PI值和预测分子量使用 Prot-Param工具(http://kr.expasy.org/tools/protparam.html)。
1.6 IVF胚胎的获取
从哈尔滨市三原种猪场人工采集大白种公猪新鲜精液,回到实验室后离心弃除精清,用DPBS悬浮,1 000 r/min离心洗涤精子,弃上清再悬浮,重复3次,最后用预先平衡的受精液悬浮,调节精子浓度到1.0×106个/mL。同时预先在成熟培养液中培养42 h的卵母细胞移至30 μL受精液微滴中,将20 μL受精液与30 μL预先成熟培养 42 h的卵母细胞以卵母细胞数:精子数=1∶200的比例混合,12 h后换为胚胎培养液,取不同发育阶段胚胎进行Real-time PCR及免疫荧光实验。
1.7 SYBR实时定量PCR测定
反应体系为25 μL,上、下游引物各0. 5 μL,SYBR Mix 12.5 μL,ddH2O 10.5 μL,cDNA 1 μL。循环参数:94 ℃ 5 min ;94 ℃30s,60 ℃30s,72 ℃30s,85 ℃8 s收集荧光,40个循环。以18S rRNA作为内参对照,引物序列具体见表2。
1.8 免疫荧光
各阶段IVF胚胎在四孔板中进行固定,预冷的4%的多聚甲醛固定30 min;透膜液37 ℃恒温孵育1 h;封闭液37 ℃封闭1 h;移入一抗中(稀释比例为 1∶200) 4 ℃孵育过夜;清洗清洗5 min,连续 3次;移入二抗 (鼠抗兔稀释比例为1∶200) 37 ℃孵育1 h;清洗5 min,连续3次;Hoechst染核10 min,清洗液清洗;移至涂有防淬灭剂的载玻片上,压片,荧光显微镜下观察。
1.9 统计学分析
Real-time PCR结果分析方法采用经典的2△△Ct法,基因的表达水平经过 SAS软件的ANOVA检验,P<0.05判定为差异显著。
2 结果与分析
2.1sall4b基因的克隆
假设猪sall4基因也存在两种剪切突变体,首先选择由基因组测序得到的猪sall4编码区预测序列NM_001114673.1作为sall4a模板,另外通过与小鼠和人的sall4b编码区比对自行预测了猪sall4b的编码区序列。为了鉴定两种剪切突变体是否存在,我们在预测选择性剪切位点两端跨位点设计上下游引物。以猪卵巢 cDNA为模板,PCR扩增仅得到一条与预测sall4b符合的1 062 bp条带 (图1A),测序结果证明可与sall4b预测序列匹配。为了获得sall4基因mRNA的全长序列,在已得序列的基础上进行 5¢与3¢ RACE 实验,5¢ RACE 的 GSP 引物设计在选择性剪切位点的下游,以期通过RACE实验进一步鉴定sall4a的存在,但仍然仅得到一条与sall4b预测长度匹配的1 500 bp特异性条带 (图1B)。3¢ RACE实验得到一条841 bp的特异性条带产物(图1C)。经测序分析,分别与已得的1 062 bp的中段序列有 988 bp和 43 bp的重合,证明RACE扩增得到的是特异性条带。为了得到mRNA全长序列,我们将三段序列用重叠PCR的方式连接起来,中间的保守序列首先与 3¢端连接得到1 860 bp片段 (图1D),此PCR产物再与5¢ RACE PCR产物进行第二轮重叠PCR获得2 372 bp mRNA全长 (图1E)。我们设计了针对于预测sall4a的特异性鉴定引物,仍没有获得相应条带。
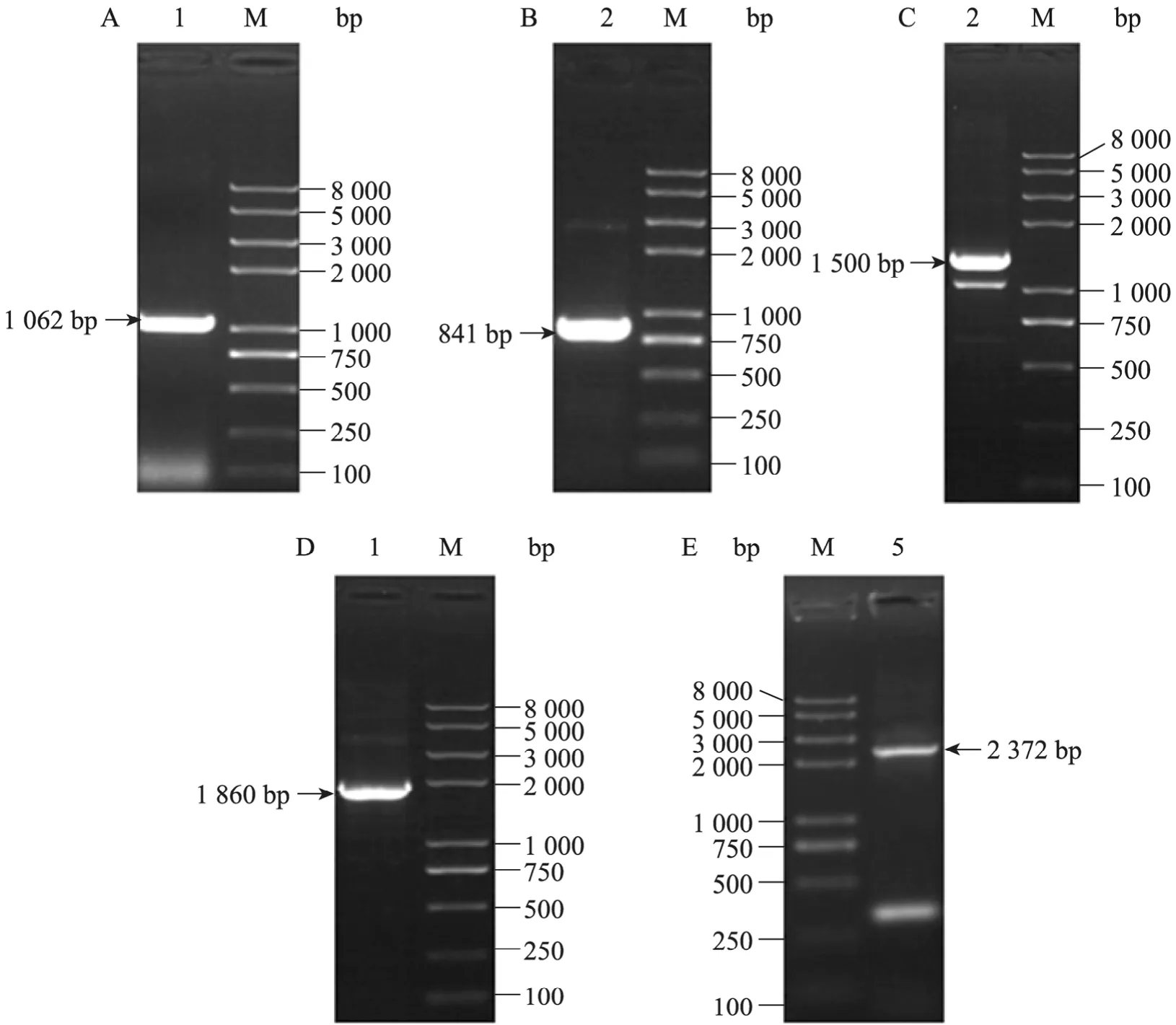
图1 克隆猪sall4b基因Fig.1 Molecular cloning of pigsall4b.M: DNA marker; 1: PCR product for middle part; 2: 3¢ RACE PCR product; 3:5¢ RACE PCR product; 4: overlap PCR product of middle part and 3¢ RACE PCR product; 5: full-length ofsall4mRNA.
所获得的含有完整编码区的 cDNA序列经NCBI工具ORF finder分析,找到1 851 bp的编码区,编码616 aa的多肽链。经SMART工具分析蛋白含有3个ZnF_C2H2锌指结构域 (分别在72-92 aa,432-454 aa和460-482 aa位置)。序列已提交至 GenBank (GenBank Accession No.JQ773336),序列见图2。
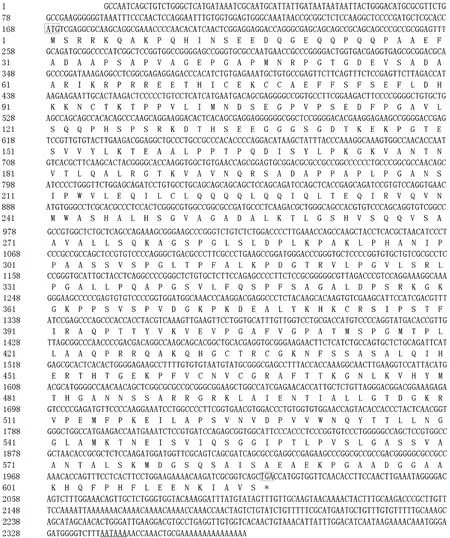
图2 猪sall4b核酸序列及预测蛋白序列Fig.2 Nucleotide and deduced amino acid sequences of pigsall4b. The ORF is presented above the amino acid sequences.
2.2sall4基因同源性分析
将克隆序列测序后得到的sall4核酸序列翻译为蛋白序列,并与其他物种的Sall4蛋白序列进行比对,两两比对相似性结果如表1所示,发现我们克隆得到的sall4基因与B类亚型匹配度更高。通过比较保守结构域,也确认猪 Sall4B蛋白与小鼠和人的 Sall4两种亚型相比,猪Sall4B蛋白结构更接近于小鼠和人的Sall4B,相比与 Sall4A,缺少 2个富含锌指的结构域(图3)。因此我们将克隆的猪sall4基因命名为猪sall4b。
2.3sall4基因系统树分析
为了阐述猪sall4b基因及其他物种的sall4基因的分子进化关系,我们基于氨基酸序列使用邻接法构建系统树。分析发现整个进化树可以分为两个主支:哺乳动物类和非哺乳动物,前者有可分为明显的3个分支:灵长类、偶蹄类和啮齿类。整个系统树的分析结果基本符合常规分类学。虽然亚型不同,但Sall4A与Sall4B在物种内是同源的 (图 4)。
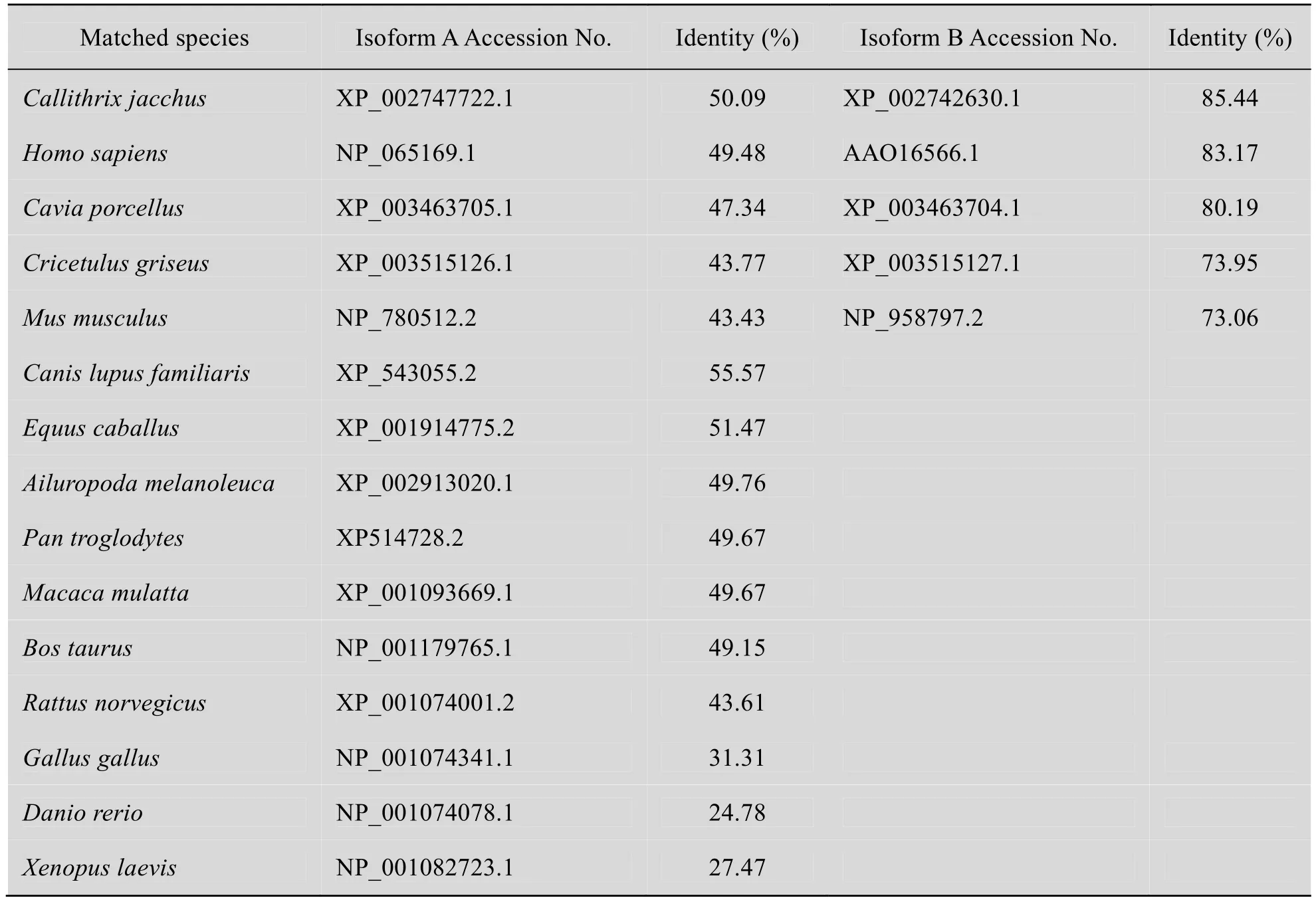
表1 猪Sall4蛋白序列与其他物种Sall4蛋白序列对比相似性Table 1 Sall4 identities between pig and other organisms
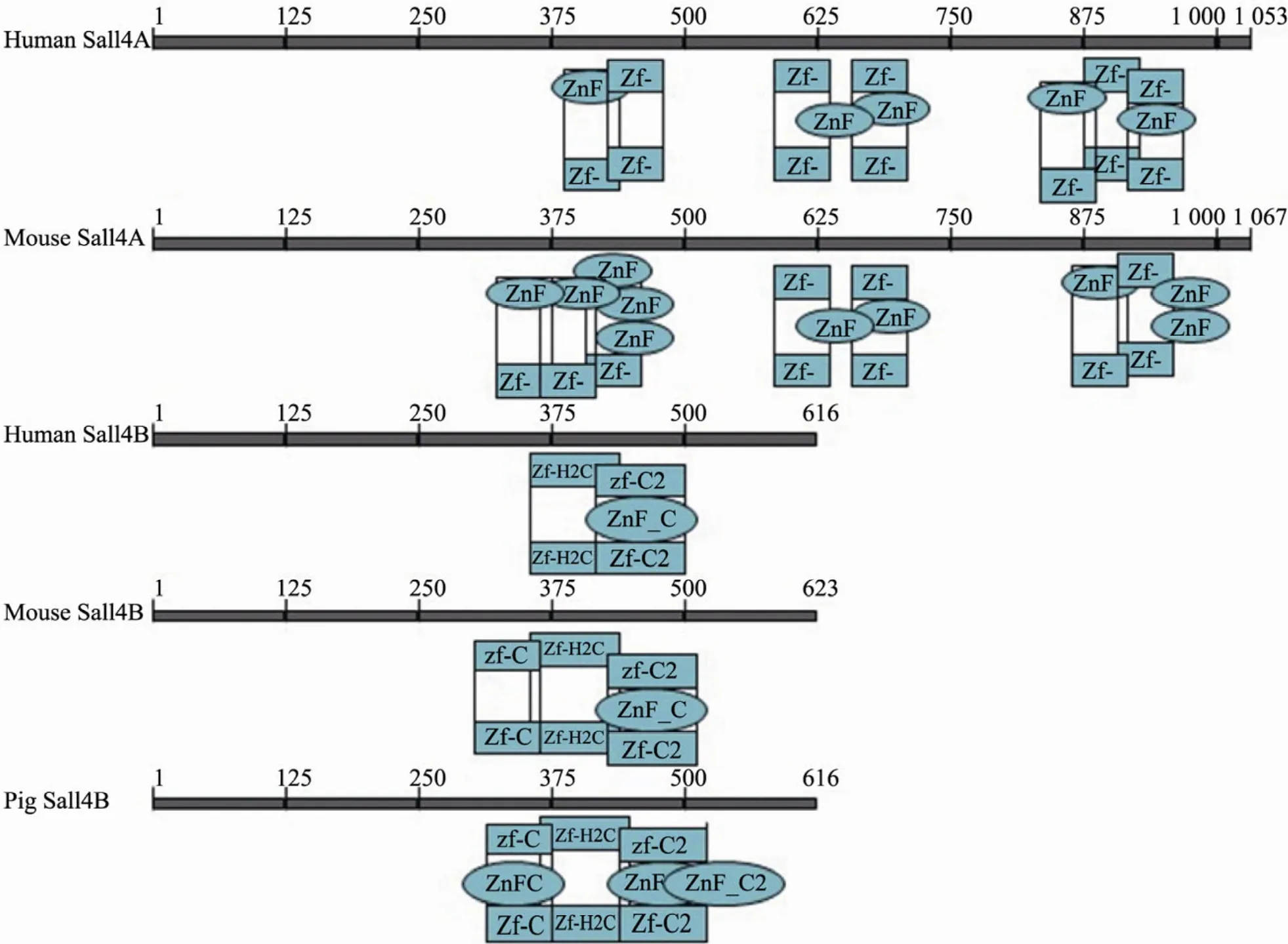
图3 猪、小鼠和人Sall4蛋白保守结构域的比对Fig.3 Alignment of conserved domain of pig, human and mouse Sall4.
2.4sall4基因定量及定位表达分析
在新生猪各个组织器官和猪早期胚胎的各个发育阶段中检测sall4基因表达情况如图 5所示。Real-time PCR结果证明sall4b基因在各个组织中均有表达,除卵巢组织表达非常强烈之外,脾、肺、心和睾丸相对表达量较高,而在猪 IVF早期胚胎发育过程中跟踪检测中发现,相对于合子阶段胚胎,4-细胞阶段胚胎相对表达量较低,而至8-细胞至囊胚阶段表达量逐渐升高。免疫荧光实验证明 Sall4蛋白定位于细胞核内,在各个发育阶段均有表达,并且随着发育进行内细胞团与滋养外胚层的表达量出现了差异,Sall4蛋白逐渐限定于内细胞团中表达。
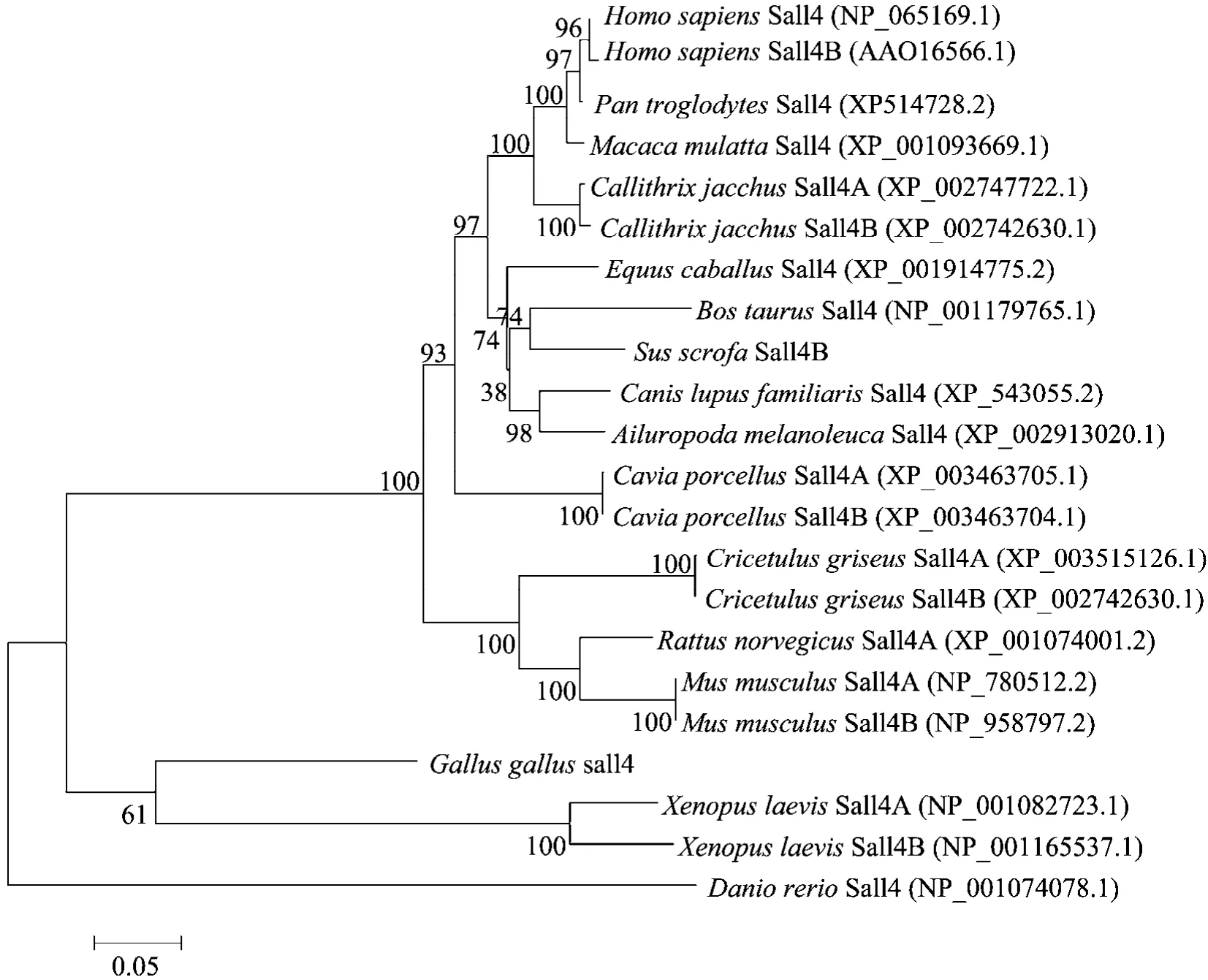
图4 系统树分析Fig.4 Phylogenic tree analysis.
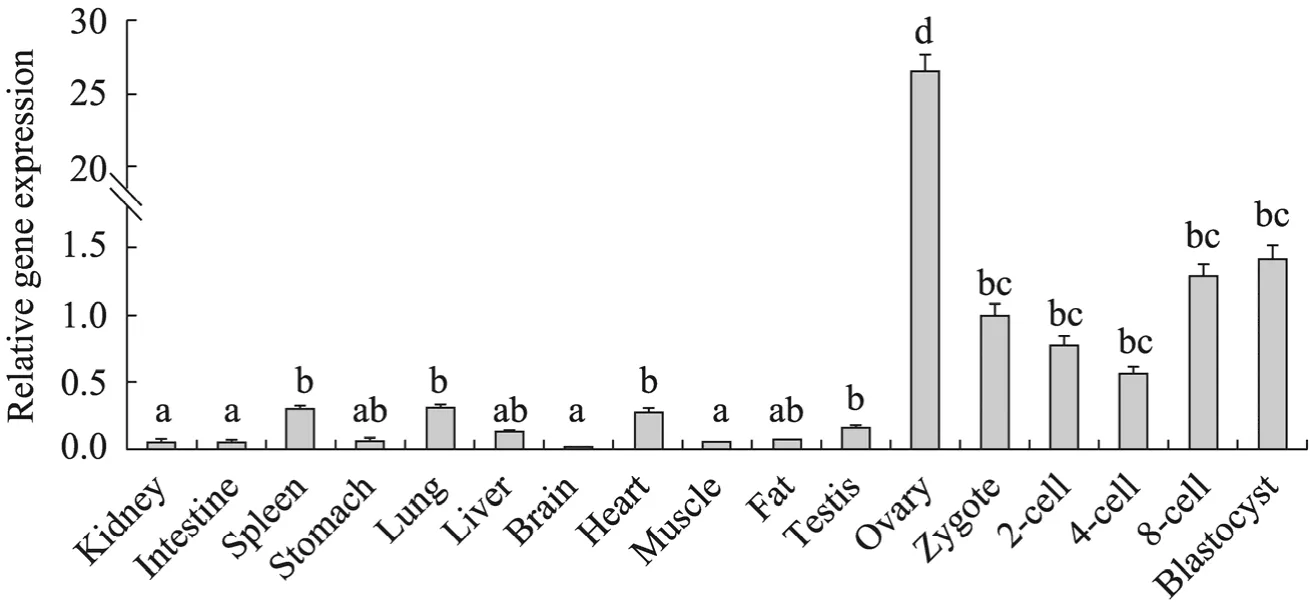
图5sall4b基因在组织和胚胎中的表达情况Fig.5sall4bexpression in tissues and embryos.

表2 引物序列与PCR条件Table 2 Primers and PCR conditions
3 讨论
在本实验中我们获得了猪sall4基因的mRNA全长序列,经结构分析并与其他物种的Sall4蛋白亚型的序列比对发现,获得的基因编码的蛋白与小鼠和人 Sall4B匹配,而与小鼠Sall4A蛋白序列相比则缺少一段锌指结构富集区。我们在从猪卵巢组织中克隆sall4基因时并没有获得与小鼠和人sall4a相匹配的转录变异体,利用针对于sall4a特异序列设计的鉴定引物在检测的各组织中也并没有扩增出相应 PCR产物。有可能是由于检测的各组织中sall4a的表达量较低,或者在猪中并不存在sall4a型的转录变异体。Sall4A和Sall4B两种亚型结构的差异决定了两者结合DNA和其他蛋白的位点可能有所不同,在小鼠sall4b的研究中也证明了在整个基因组中sall4a与sall4b的靶位点有交叉,但不完全相同[8]。而猪sall4b特异性的表达模式,可能是猪与小鼠和人在早期胚胎发育和多能性维持机制的差异形成的重要原因之一。例如,与小鼠和人的胚胎中oct4基因限定在内细胞团中的表达模式不同,猪早期胚胎中oct4基因在滋养外胚层中也有所表达,小鼠中的研究已经证明sall4与oct4互相激活形成正反馈机制[17],在猪中sall4a亚型的低表达或缺失可能是猪oct4基因特异性表达模式的原因之一。因此,比较小鼠和人与猪sall4基因靶位点的差异可能对于揭示小鼠和人与猪早期胚胎及多能性维持机制的差异具有重要意义。
由于并没有检测到sall4a的表达,因此本实验体系验证下的sall4基因Real-time检测结果可以认为即是sall4b的检测结果。表达分析证明各种组织中均有所表达,但在卵巢中表达尤其高,另外脾、肺、心和睾丸也相对表达量较高。这一结果与在人sall4b的研究一致[7]。sall4b基因在这些组织中的高量表达提示了sall4b可能参与这些组织的发育及功能维持等。在人的研究中发现sall4的突变可导致卵巢早衰[18],而sall4b在猪卵巢中相对于其他组织和胚胎的极高量表达可能预示着sall4b对猪卵巢发育及功能维持具有重要作用。卵母细胞质量是影响核移植重编程最重要的因素,结合sall4b在猪受精卵中的表达情况,猜测sall4b的高量表达可能有助于提高猪核移植效率。另外有文章证明sall4作为原癌基因可能是睾丸[19]和肺[20]肿瘤形成主要诱导因素之一,提示猪sall4b基因可能对睾丸和肺中某种或某些细胞的增殖能力及发育具有调控作用。另外sall4基因在血细胞生成以及造血干细胞多能性的维持上具有重要作用[21-22],而我们检测的组织来自于新生猪,新生猪脾可能还具有残留的部分造血功能,因此这些组织表达sall4b的含量较高。在猪早期胚胎的跟踪实验中证明sall4b基因表达及定位随着发育而有所变化。在受精卵中,sall4b的表达量高于2细胞及4细胞阶段,可能在合子基因启动之前,母源sall4bmRNA是主要来源。而到桑葚胚至囊胚阶段,sall4基因表达量逐渐上升,并且趋于表达限制在内细胞团中。说明与小鼠和人一致,猪sall4b基因与多能性也具有紧密相关性。
综上所述,我们首次克隆了猪sall4b基因,并用实验方法证明了除小鼠和人之外在其他哺乳动物中sall4b型剪切形式。初步获得了猪sall4b基因的表达模式,表达分析证明sall4b基因与多能性紧密相关,预示着sall4b基因将有可能作为新的重编程因子应用于猪多能性细胞的诱导体系中。
REFERENCES
[1] Al-Baradie R, Yamada K, St Hilaire C, et al. Duane radial ray syndrome (Okihiro syndrome) maps to 20q13 and results from mutations in SALL4, a new member of the SAL family. Am J Hum Genet,2002, 71(5): 1195−1199.
[2] Kohlhase J, Heinrich M, Schubert L, et al. Okihiro syndrome is caused by SALL4 mutations. Hum Mol Genet, 2002, 11(23): 2979−2987.
[3] Elling U, Klasen C, Eisenberger T, et al. Murine inner cell mass-derived lineages depend on Sall4 function. Proc Natl Acad Sci USA, 2006, 103(44):16319−16324.
[4] Sakaki-Yumoto M, Kobayashi C, Sato A, et al. The murine homolog of SALL4, a causative gene in Okihiro syndrome, is essential for embryonic stem cell proliferation, and cooperates with Sall1 in anorectal, heart, brain and kidney development.Development, 2006, 133(15): 3005−3013.
[5] Tsubooka N, Ichisaka T, Okita K, et al. Roles of Sall4 in the generation of pluripotent stem cells from blastocysts and fibroblasts. Genes Cells, 2009,14(6): 683−394.
[6] Wong CC, Gaspar-Maia A, Ramalho-Santos M, et al. High-efficiency stem cell fusion-mediated assay reveals Sall4 as an enhancer of reprogramming.PLoS ONE, 2008, 3(4): e1955.
[7] Ma YP, Cui W, Yang JC, et al.SALL4, a novel oncogene, is constitutively expressed in human acute myeloid leukemia (AML) and induces AML in transgenic mice. Blood, 2006, 108(8):2726−2735.
[8] Rao S, Zhen S, Roumiantsev S, et al. Differential roles of Sall4 isoforms in embryonic stem cell pluripotency. Mol Cell Biol, 2010, 30(22):5364−5380.
[9] Esteban MA, Peng M, Deli Z, et al. Porcine induced pluripotent stem cells may bridge the gap between mouse and human iPS. IUBMB Life,2010, 62(4): 277−282.
[10] Montserrat N, Bahima EG, Batlle L, et al.Generation of pig iPS cells: a model for cell therapy.J Cardiovasc Transl Res, 2011, 4(2): 121−130.
[11] Roberts RM, Telugu BP, Ezashi T. Induced pluripotent stem cells from swine (Sus scrofa):Why they may prove to be important. Cell Cycle,2009, 8(19): 3078−3081.
[12] Esteban MA, Xu J, Yang J, et al. Generation of induced pluripotent stem cell lines from tibetan miniature pig. J Biol Chem, 2009, 284(26):17634−17640.
[13] Wu Z, Chen JJ, Ren JT, et al. Generation of pig-Induced pluripotent stem cells with a drug-inducible system. J Mol Cell Biol, 2009, 1(1):46−54.
[14] Ezashi T, Telugu BPVL, Alexenko AP, et al.Derivation of induced pluripotent stem cells from pig somatic cells. Proc Natl Acad Sci USA, 2009,106(27): 10993−10998.
[15] Telugu BP, Ezashi T, Roberts RM (2010) Porcine induced pluripotent stem cells analogous to naive and primed embryonic stem cells of the mouse. Int J Dev Biol, 2010, 54(11/12): 1703−1711.
[16] West FD, Terlouw SL, Kwon DJ, et al. Porcine induced pluripotent stem cells produce chimeric offspring. Stem Cells Dev, 2010, 19(8): 1211−1220.
[17] Yang JC, Gao C, Chai L, et al. A novel SALL4/OCT4 transcriptional feedback network for pluripotency of embryonic stem cells. PLoS ONE,2010, 5(5): e10766.
[18] Wang B, Li L, Ni F, et al. Mutational analysis of SAL-Like 4 (SALL4) in Han Chinese women with premature ovarian failure. Mol Hum Reprod, 2009,15(9): 557−562.
[19] Cao D, Li J, Guo CC, et al. SALL4 is a novel diagnostic marker for testicular germ cell tumors.Am J Surg Pathol, 2009, 33(7): 1065−1077.
[20] Kobayashi D, Kuribayashi K, Tanaka M, et al.Overexpression of SALL4 in lung cancer and its importance in cell proliferation. Oncol Rep, 2011,26(4): 965−970.
[21] Chai L.The role of HSAL (SALL) genes in proliferation and differentiation in normal hematopoiesis and leukemogenesis. Transfusion,2011, 51(S4): 87S−93S.
[22] Oikawa T, Kamiya A, Kakinuma S, et al. Sall4 regulates cell fate decision in fetal hepatic stem/progenitor cells. Gastroenterology, 2009,136(3): 1000−1011.
Cloning and gene expression ofsall4bgene in pig
Xinmiao Zhang, Xiaojiao Han, Wenteng He, Shichao Liu, Yanshuang Mu, Kui Hu,and Zhonghua Liu
Laboratory of Embryo Engineering,Department of Life Science,Northeast Agricultural University,Harbin150030,Heilongjiang,China
张鑫淼, 韩小娇, 何文腾, 等. 猪sall4b基因的克隆及表达分析. 生物工程学报, 2012, 28(10): 1164−1174.
Zhang XM, Han XJ, He WT, et al. Cloning and gene expression ofsall4bgene in pig. Chin J Biotech, 2012, 28(10): 1164−1174.
Received:March 16, 2012;Accepted:June 7, 2012
Supported by:National Basic Research Program of China (973 Program) (No. 2009CB941002).
Corresponding author:Zhonghua Liu. Tel/Fax: +86-451-55191747; E-mail: liu086@yahoo.com
国家重点基础研究发展计划(973计划) (No. 2009CB941002)资助。