端粒酶抑制剂对骨肉瘤细胞株增殖的抑制作用
万法青,王 井,单玉兴,张海玉
(1.吉林大学第一医院二部骨科,吉林 长春 130031;2.吉林大学第一医院儿外科,吉林 长春 130021)
端粒酶是一种特殊的逆转录酶,能以自身RNA为模板合成端粒DNA序列,其结构和行为的异常被认为与细胞衰老及肿瘤发生发展有密切关系。目前有研究[1]表明:85%~95%的恶性肿瘤均有端粒酶的活性表达,而大多数体细胞无端粒酶活性。因此端粒酶可能成为治疗肿瘤的新靶点。有学者[2]提出了以抑制端粒酶活性为目标的肿瘤基因治疗方案,希望能开发出抑制端粒酶活性或基因表达的抑制剂,从而达到治愈肿瘤的目的。骨肉瘤是起源于间叶组织的恶性肿瘤,在原发性骨肿瘤中发病率最高,约占35%[3-4],好发于青少年,是青少年死亡率和致死率最高的骨恶性肿瘤。近年来骨肉瘤化疗药物研究取得了一定的进展[5-6],但常因耐药问题及副作用而影响疗效,端粒酶的发现及其最新研究为骨肉瘤治疗提供一种新的方法。齐多夫定(zidovudine,AZT)是一种核苷类似物,具有抗艾滋病作用,同时还可作为一种端粒酶抑制剂。国内外有文献[7-10]报道:AZT可以抑制肝癌细胞、人脑胶质瘤细胞、肺癌细胞和结肠癌细胞的端粒酶活性,从而抑制肿瘤细胞的增殖,并可使HeLa细胞的端粒发生不可逆变的缩短,而AZT在骨肉瘤方面应用的报道却很少。本实验应用AZT作用于骨肉瘤细胞株(HOS),观察其对肿瘤细胞生长及端粒酶活性的作用,旨在为端粒酶抑制剂更好地应用于骨肉瘤及其他肿瘤的临床治疗提供实验依据。
1 材料与方法
1.1 细胞、试剂及主要仪器人骨肉瘤细胞株(HOS)购自北京鼎国生物;MEM培养基购自Gibco公司;胎牛血清购自Hyclone公司;AZT为Sigma公司产品;四氮甲唑蓝(MTT)和BCA蛋白试剂盒为碧云天公司产品;TRAP-PCR-ELISA试剂盒为德国宝灵曼公司产品。
1.2 细胞培养及分组HOS细胞培养于含10%胎牛血清的MEM培养基中,置于37℃、5% CO2的细胞培养箱中培养。取对数生长期的HOS细胞分为AZT组和阴性对照组,分别加入100 μL经培养液稀释的不同浓度(1、10、100及1 000 μmol·L-1) AZT及相同体积培养液,培养24、48和72 h后观察各项指标。
1.3 细胞形态学观察在MTT实验中,加药前后用倒置相差显微镜观察各组培养孔内细胞形态结构的变化。
1.4 MTT比色分析法取对数生长期细胞(制备细胞悬液为1×106mL-1),接种于96孔板,每孔100 μL。设立实验组和对照组,次日分别加入100 μL经培养液稀释好的不同浓度(1、10、100及1 000 μmol·L-1)的AZT及相同体积的培养液,每个浓度设3个复孔,分别培养24、48和72 h后加入MTT(5 g·L-1)20 μL,继续培养4 h,吸弃培养液,每孔加150 μL二甲基亚砜(DMSO),终止培养,室温振荡约10 min,充分溶解蓝紫色结晶。用Model-450酶标仪(Bio-Bad)测定波长490 nm处的吸光度(A)值。细胞存活率(%)=(实验组A值/对照组A值)×100%,细胞抑制率(%)=1-细胞存活率,抑制率达到50%为最佳作用时间和浓度,并作为下一步测定端粒酶活性改变的药物浓度和作用时间。
1.5 TRAP-PCR-ELISA方法检测端粒酶活性按试剂盒说明操作,具体步骤如下:收集细胞沉淀用冷洗液悬浮,冰浴5 min,4℃、10 000 r· min-1离心5 min,弃上清。沉淀与冷的裂解缓冲液冰浴30 min,其间涡旋振荡3~5次,4℃、13 000 r·min-1离心 30 min,上清即所需的提取液,吸取上清液至一经DEPC水处理的EP管中,分装,20 μL/管,BCA法测定其中一份蛋白浓度,其余-70℃保存备用。TRAP-PCR反应:在0.2 mL扩增管中依次加入25 μL反应混合物,3 μL细胞裂解产物,加无菌水至终体积50 μL。PCR步骤:25℃、30 min引物延伸;94℃、5 min端粒酶灭活;94℃、30 s,50℃、30 s,72℃、90 s,共循环36个周期后72℃、10 min 进一步延伸。4℃保存PCR产物。ELISA反应:PCR产物与变性剂以及杂交缓冲液反应后,取100 μL加入有亲合素包被的反应孔中37℃振荡孵育2 h。洗涤后,于各孔中加入抗地高辛-过氧化物酶,室温下振荡30 min。洗涤,再依次加入TMB和终止液,从酶标仪上读取其在450 nm处的A值。以65℃水浴10 min加热灭活的HOS细胞提取液作为阴性对照,阳性对照由试剂盒内提供。端粒酶活性下调率(% )=(实验组平均A值-对照组平均A值) /对照组平均A值×100%。
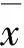
2 结 果
2.1 细胞形态学变化倒置显微镜下观察对照组细胞贴壁生长,呈短梭形,细胞排列紧密,核较大,细胞密集时呈多层生长,细胞增殖状态良好;1 μmol·L-1AZT作用HOS细胞48 h后,细胞体积变小,细胞间隙变宽,可见少量细胞由瓶壁脱落并悬浮于培养液中,并可见少量细胞碎片,上述改变随着AZT浓度的增加及时间的延长而更加明显。HOS细胞与100 μmol·L-1AZT作用24 h后,细胞体积变小,由短梭形变为多角形或不规则形;48 h后细胞形态改变最显著,细胞体积进一步变小,细胞数量减少,部分贴壁的细胞皱缩并与邻近细胞脱离,且瘤细胞大小不一,多呈单层生长;72 h后细胞数量进一步减少,细胞变圆,皱缩,大部分细胞漂浮。见图1(插页三)。
2.2 AZT作用后HOS细胞存活率的变化不同浓度AZT对HOS细胞分别作用24、48和72 h后,细胞生长明显抑制。以1、10、100和1 000 μmol·L-1AZT分别处理HOS细胞24、48和72 h后细胞存活率见表1。以对照组增殖率为(100.000±0.000)%,将不同浓度组的不同时间与对照组相比显示:AZT可以明显抑制HOS细胞的增殖,且抑制作用随着浓度的增加及作用时间的延长而增强(P<0.05),呈时间和浓度依赖性。AZT对HOS细胞的半数致死浓度(IC50)为100 μmol·L-1。
2.3 AZT作用后端粒酶活性的变化对照组A值为1.236±0.22,AZT组A值为0.547±0.07。AZT组A值与对照组比较明显降低(P<0.05),AZT作用后HOS细胞端粒酶活性下降了55.74%,表明AZT对HOS细胞端粒酶活性有明显的抑制作用。
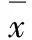
表1 AZT作用后HOS细胞的存活率
3 讨 论
端粒酶是细胞内一种核糖蛋白,主要由RNA成分(hTR)、端粒酶相关蛋白(hTEP)和催化亚单位 (hTERT)3部分组成[11]。其能以自身RNA为模板,在染色体末端合成端粒DNA,使端粒得以延长,以补偿细胞分裂时染色体末端的缩短,解决“末端复制问题”,进而稳定端粒长度使细胞达到永生化。因此,抑制端粒酶活性在肿瘤治疗中有重要作用。近年来有研究[12]报道:在84%的骨肉瘤、60%的软骨肉瘤中可检测到端粒酶活性的表达,而在瘤旁正常组织中却检测不到,这表明端粒酶活性是恶性肿瘤细胞的一种标志,也表明抑制端粒酶活性可能成为治疗骨肉瘤的一个新靶点。AZT作为端粒酶抑制剂可以和正常的单核苷酸竞争与RNA模板结合并抑制细胞内部逆转录酶的活性,在DNA复制时亦可掺入继而使复制过程中止[13]。有研究[14]发现:AZT能抑制恶性肿瘤的端粒酶活性,缩短端粒,从而抑制肿瘤细胞的增殖和生长。本研究中端粒酶活性下调率为55.74%,与AZT对体外培养的肝癌细胞、大肠癌细胞及肺癌细胞的端粒酶活性下调率一致[15];1 μmol·L-1AZT作用于HOS细胞24 h后细胞增殖即受到抑制,该剂量远远低于其在舌癌等细胞的应用剂量,表明骨肉瘤细胞对AZT较敏感;随着时间的延长及浓度的增加抑制作用增强,100 μmol·L-1AZT作用于HOS细胞72 h时抑制率达到50%,当1 000 μmol·L-1AZT作用于HOS细胞72 h时抑制率达到最高(90.92%)。有文献报道:AZT可以阻滞脑胶质瘤细胞处于G1期,干扰逆转录过程从而抑制脑胶质瘤细胞生长,AZT对HOS细胞增殖抑制作用的具体机制还有待进一步的研究。
本实验结果表明:AZT对HOS细胞生长有明显的抑制作用,且呈时间和浓度依赖性,AZT具有抗骨肉瘤作用,有望成为治疗骨肉瘤的一种新药。
[参考文献]
[1]邱广斌,孙开来.端粒酶活性抑制与肿瘤治疗的研究[J].国外医学:遗传学分册,2000,23(3):127-129.
[2]黄 金,邓兴力,宋晓斌,等.逆转录酶抑制剂AZT对胶质瘤肝细胞端粒酶活性和细胞增殖的影响[J].中国微侵袭神经外科杂志,2011,16(10):470-473.
[3]Bacci G,Longhi A,Fagioli F,et al.Adjuvant and neoadjuvant chemotherapy for osteosarcoma of the extremities:27 year experience at Rizzoli Italy[J].Eur J Caner,2005,41(18):2836-2845.
[4]朱广迎.放射肿瘤学[M].北京:科学技术文献出版社,2009:76-80.
[5]Scotland K,Picci P,Kovar H.Targeted theralies in bone sarcomas [J].Curr Cancer Drug Targets,2009,9(7):843-853.
[6]Bacci G,Lari S.Current treaunent of high grade osteosacoma of the extremity [J].J Chemother,2001,13(3):235-243.
[7]Chen C,Zhang Y,Wang Y,et al.Synergic effect of 3′ -azido-3′-deoxythymidine and arsenic trioxide in suppressing hepatoma cells[J].Anticancer Drugs,2011,22(5):435-443.
[8]Liu J,Wang Q,Yu SZ,et al.Azidothymidine inhibition of telomerase acticity and proliferation of TJ905 human glioblastoma cells[J].Zhonghua Bing Li Xue Za Zhi,2009,38(3):183-188.
[9]陈 雯,张 桥,魏 青,等.端粒酶抑制剂对肿瘤细胞及其端粒酶活性的影响[J].肿瘤,2000,20(6):415-418.
[10]Gomez DE,Tejera AM,Olive OA.Irreversible telomere shortening by 3′ -Azido-2′,3′-dideoxythmidine(AZT) treatment[J].Biochem Biophy Res Commun,1998,246(1):107-110.
[11]Nakamura TM,Morin GB,Chapman KB,et al.Telomerase catalytic subunit homologs from fission yeast and human [J].Science,1997,277(5328):955-959.
[12]Wen JM,Sun LB,Zhang M,et al.Anon-isotopic method for the detection of telomerase activityin tumour tissues: TRAP-silver staining assay[J].Mol Pathol,1998,51(2):110-112.
[13]于金海,刘国辉.AZT对胃癌细胞SGC7901端粒酶活性的影响[J].中国实验诊断学,2011,15(7):1064-1066.
[14]王建奇,韩艳华,柯以铨,等.端粒酶反义寡核苷酸及顺铂对恶性脑胶质瘤治疗的协同作用[J].肿瘤,2005,25(6):600-603.
[15]Liu SX,Sun WS,Cao CH,et al.Antisense oligonucleotide targeting at the initiation of hTERT arrests grouth of hepatoma cells[J].World J Gastroenterol,2004,10(3):366-370.

