GST与FGF23 C末端 71个氨基酸融合蛋白的表达、纯化及其免疫原性
陈玉斌,刘孝菊,姚 娜,孙常文,田海山,4,张 键,刘 敏,李校堃,3,4
(1.吉林农业大学 生物反应器与药物开发教育部工程研究中心,吉林 长春 130118;2.吉林农业大学 生命科学学院,吉林 长春 130118;3.吉林大学公共卫生学院 卫生部放射生物学重点实验室,吉林 长春 130021;4.温州医学院药学院 生物技术制药工程重点实验室,浙江 温州 325035)
成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)于2000年被成功鉴定[1],作为一种调磷因子,其通过抑制磷的重吸收及增加磷的外分泌在肾脏中发挥重要的作用[2]。许多研究[2-4]证实:人类FGF23基因突变可导致常染色体显性遗传性低磷血症(autosomai dominant hypophosphatemic rickets,ADHR)、X-连锁低磷血症性佝偻病(X-linked hypophosphatemia,XLH)以及肿瘤诱发性骨软化症(tumor-induced osteomalacia,TIO)等疾病,而且FGF23在慢性肾病伴发的继发性甲状旁腺亢进的发病机制中起关键作用[5-6],尤其是在慢性肾病患者(chronic kidney disease,CKD)早期磷稳态的维持中发挥重要作用[7]。研究[8]证实:多数血液透析患者血清FGF23浓度超过正常人的 100~1 000倍[8]。肾功能下降后血清FGF23水平缓慢升高,CKD和终末期肾病患者血清FGF23的水平增高,而肾移植后可下降到正常水平[9]。Ferrari等[10]通过改变健康人饮食中磷的含量,观察到血清FGF23的改变与24 h尿磷的清除成正相关,表明FGF23的代谢水平与CKD患者的患病程度相关。本研究利用原核表达载体表达了FGF23的活性片段(FGF23CTR)与GST的融合蛋白,并做了纯化和初步的免疫原性分析,显示融合蛋白中的FGF23CTR片段能够在小鼠体内产生较高活性的抗体,为进一步制备特异性针对FGF23的单克隆抗体提供了条件,也为CKD诊断试剂盒的开发奠定基础。
1 材料与方法
1.1 菌株﹑质粒及主要试剂大肠杆菌DH5α、BL21(DE3)菌种及pGEX-4T-1质粒为生物反应器与药物开发教育部工程研究中心保存,限制性内切酶BamHⅠ、Xhol Ⅰ PCR反应的相关酶类及T4DNA连接酶均为TakaRa公司产品,DNA Marker DL2 000和低分子量蛋白标准购于宝生物工程(大连)公司,IPTG 购自鼎国生物工程公司,PCR 产物回收试剂盒、DNA 凝胶回收试剂盒、小量质粒提取试剂盒购自长春百金生物试剂经销有限公司,Glutathione Sepharose 4B购自Pharmacia公司,弗氏佐剂购自Sigma公司,FGF23多克隆抗体购自Santa Cruz Biotechnology公司,带有辣根过氧化酶标记的羊抗兔二抗购自北京博奥森生物公司,其他常规化学试剂均为分析纯。6~ 8周龄雌性 Balb/C小鼠,购自吉林大学实验动物中心。
1.2 目的基因扩增以人源FGF23基因为模板用特异性引物扩增FGF23CTR基因。首先,依据GenBank中人类FGF23的基因序列设计合成一对引物,上游引物F:5′-CGTGGATCCCGGAGCG-CCGAGGACGACTCG-3′含有BamH Ⅰ酶切位点;下游引物R:5′-CACGCTCGAGTTACTAGATGAACTTGGCG-3′含有XhoⅠ酶切位点。PCR扩增条件:94℃、5 min;94℃、30 s,59.4℃、30 s,72 ℃、40 s,30个循环;72℃、7 min。PCR产物用1%琼脂糖凝胶电泳,恒压100 V,35 min,EB染色,利用凝胶成像系统观察分析。
1.2 重组表达载体构建将PCR产物用BamHⅠ和XhoⅠ进行双酶切消化,切胶回收酶切片段,并与用同样的酶进行处理的pGEX-4T-1质粒进行连接,热激法将连接产物转化到DH5α感受态中,涂布平板法筛选阳性菌株,并对重组质粒进行酶切和测序鉴定。
1.3 GST-FGF23CTR表达菌的筛选将测序正确的重组质粒保种菌按1%的接种量转接于小试管中,37℃、180 r·min-1振荡培养过夜,用质粒提取试剂盒提取重组质粒。热激法将重组质粒转化到BL21感受态中,氨苄抗性平板筛选出阳性菌株。将阳性菌落过夜培养物按2%的接种量接种于LB培养基中(Amp+),振荡培养至A600值在0.4~ 0.6,加IPTG 至终浓度1 mmol·L-1继续震荡培养1 h,离心收集菌体,进行 12%SDS-PAGE电泳分析。
1.4 表达条件的优化及可溶性分析表达菌分别用0.4、0.8和1.0 mmol·L-1的IPTG,在25℃和37℃条件下,分别诱导表达4、8和12 h取样,离心回收菌体,进行12%SDS-PAGE电泳分析,选取最优的表达条件,并且超声破碎菌体,分别将上清和沉淀取样进行SDS-PAGE电泳。
1.5 融合蛋白的纯化将大量扩增诱导表达后的表达菌以8 000 r·min-1离心10 min收菌,菌体用预冷的裂解缓冲液(PBS,140 mol·L-1NaCl,2.7 mol·L-1KCl,10 mol·L-1Na2HPO4,1.8 mol·L-1KH2PO4,pH 7.3)重悬,超声破碎,4℃、12 000 r·min-1离心15 min,弃沉淀。将上清过Glutathione Sepharose 4B柱,先以5倍体积的PBS洗柱,再以适量的洗脱缓冲液(50 mmol·L-1Tris-HCl,10 mmol·L-1还原性的谷胱甘肽,pH 8.0)洗脱蛋白,纯化的蛋白用微量紫外分光光度计测量浓度后,于-20°保存备用。
1.6 纯化后融合蛋白的Western blotting鉴定按照参文[11]的方法将纯化后的GST-FGF23CTR融合蛋白及表达菌诱导前对照以BIO-RAD系统电转移至PVDF膜上,经牛血清白蛋白封闭后,依次加入兔抗人FGF23多抗、辣根过氧化物酶标记的羊抗兔二抗,最后进行化学发光显影。
1.7 小鼠免疫首次免疫取含有400 μg GST-FGF23CTR融合蛋白的纯化液并添加注射用水至总体积为1.5 mL,用1.5 mL弗氏完全佐剂充分乳化、混匀。取4只小鼠,在小鼠腹部皮下进行多点注射,每只注射0.75 mL;之后每隔2周用同样方法注射弗氏不完全佐剂乳化混匀的GST-FGF23CTR融合蛋白抗原;免疫4次后,通过尾部采血来制备抗血清。
1.8 ELISA法检测抗血清效价按照参文[12]的方法检测抗血清的效价,首先建立ELISA反应体系,通过棋盘方阵滴定法确定抗原包被浓度。然后将GST-FGF23CTR融合蛋白和GST蛋白分别用抗原稀释液稀释至合适的包被浓度,加入100 μL/孔,4℃包被过夜。将待测血清分别按至1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000的倍数稀释,也是100 μL/孔,在37℃孵育1 h。再加入100 μL HRP标记的羊抗兔二抗(效价1∶3 000)稀释液,37℃反应1 h,洗涤后加入底物显色,10 min,终止反应后测定490 nm 处的A值。
2 结 果
2.1 目的基因的扩增扩增产物经过1%琼脂糖凝胶电泳分析,可见一条长度约为250 bp的明亮条带,与理论值相符。见图1。

图1 FGF23CTR基因PCR扩增产物的琼脂糖凝胶电泳图
2.2 转化子的阳性鉴定用高保真酶做PCR,用胶回收试剂盒回收目的片段,同时用质粒提取试剂盒提取出pGEX-4T-1质粒,两者分别进行双酶切(BamHⅠ/XholⅠ),T4连接酶16℃过夜连接,次日将全部连接产物转入到DH5α中,涂布到Amp抗性平板上。从抗性筛选出的菌落中随机挑取19个菌落做PCR鉴定,结果显示有3个阳性菌落(图2)。将3个菌种送北京华大基因测序公司测序,结果显示序列均与理论序列一致。

图2 FGF23CTR转化子的菌落PCR阳性鉴定
2.3 表达菌的筛选将重组质粒提取并转化到BL21感受态中,利用IPTG于37℃诱导表达目的蛋白,SDS-PAGE分析,筛选出表达菌。结果显示:在34 000处有目的条带的表达,与理论值相符。同时在约26 000处也出现1个表达条带。见图3。其原因是pGEX-4T-1质粒本身携带有GST基因的起始密码子,经过IPTG诱导后可以表达出GST蛋白。因此,将野生型的pGEX-4T-1质粒转化到BL21中,并筛选表达菌(数据未显示)。
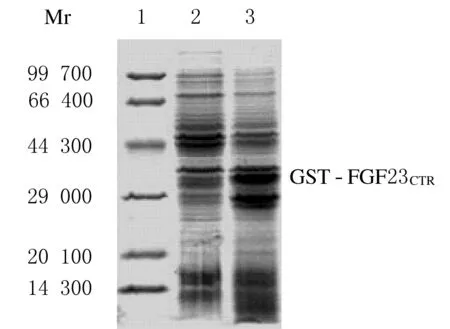
图3 融合蛋白表达的SDS-PAGE分析
2.4 表达条件的优化经不同浓度IPTG诱导,在25℃和37℃、于不同的诱导时间取样,行SDS-PAGE分析,结果显示:菌体在不同IPTG浓度下都有高量的表达,0.4 mmol·L-1IPTG、25℃、诱导8 h菌体表达量达到最高,实验选择诱导条件为表达的最优条件。在各浓度IPTG诱导下,25℃时均比37℃时的表达量高,说明低温有利于蛋白的表达。在诱导过程中发现:随着时间的延长,到12 h时诱导量又有所下降。见图4。

图4 表达条件的优化
2.5 融合蛋白的表达位置分析和纯化蛋白在上清表达,经过Glutathione Sepharose 4B亲和层析纯化得到了纯度大于90%的融合蛋白,由于质粒本身可以表达出GST蛋白,因此纯化的蛋白中还有少许GST蛋白残余。随着洗脱时间的延续,在洗脱的最后出现了仅有少许杂带的蛋白,可以作为抗原免疫小鼠。见图5。
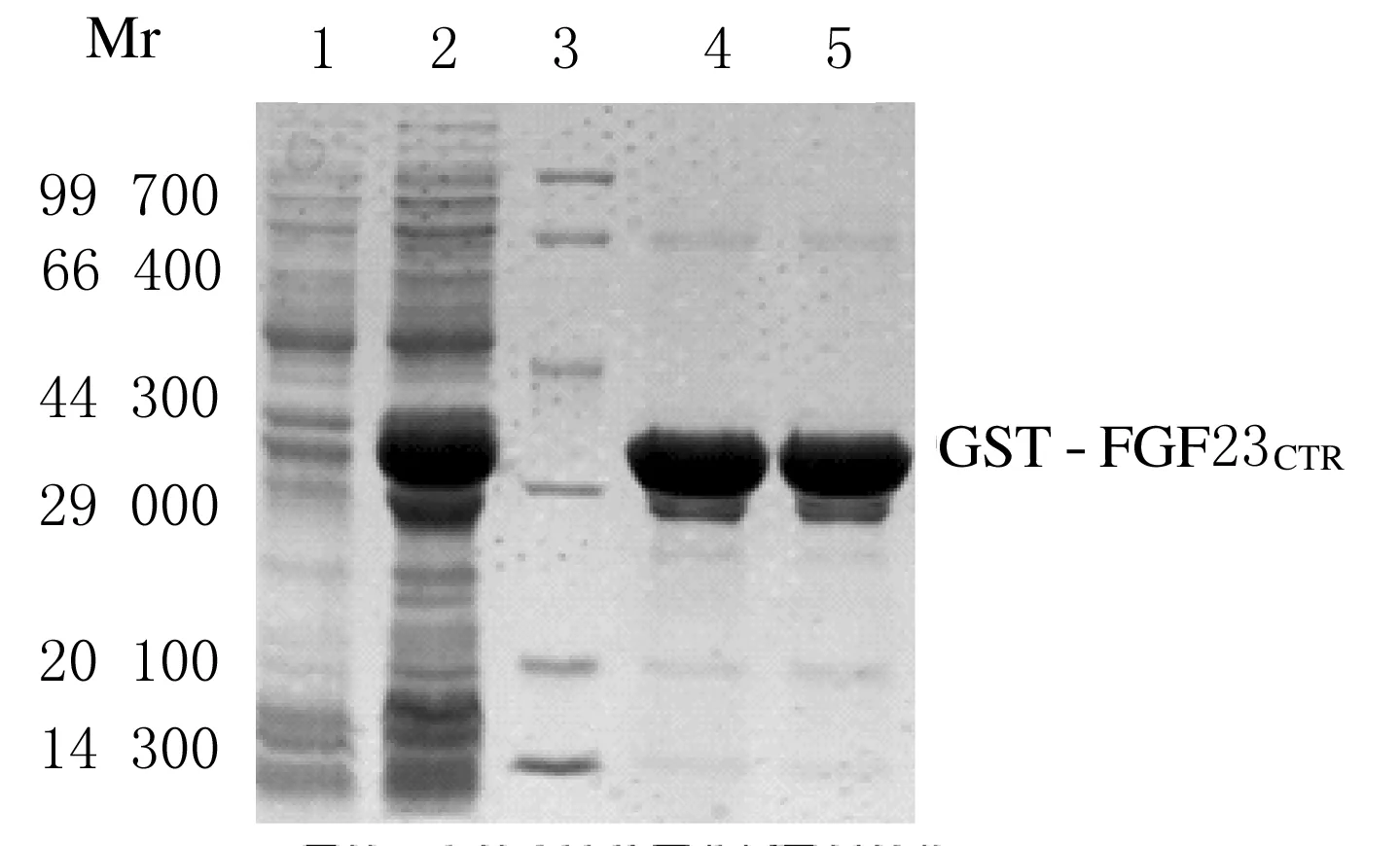
图5 目的蛋白的表达和纯化
2.6 Western blotting 鉴定结果表达的融合蛋白能够与FGF23多克隆抗体特异性结合,如图6所示,说明纯化出来的蛋白是GST-FGF23CTR融合蛋白,可以作为抗原免疫动物,用于FGF23CTR单克隆抗体的制备。

图6 纯化的GST-FGF23CTR的Western blotting分析结果
2.7 ELISA检测结果与免疫前血清(隐性对照)和水(空白对照)比较,4只免疫小鼠体内均获得较高效价的抗体,平均效价为1∶16 000。
为了验证所产生的抗体是针对于FGF23CTR的片段而并非全部是GST决定簇的抗体,又纯化出了GST蛋白(纯化的蛋白图片未显示),与融合蛋白分别包被,并随机抽取2只小鼠的抗血清,行ELISA检测,结果显示:融合蛋白的A490值几乎是GST蛋白所测值的2~3倍,说明免疫所产生的抗体有一部分是针对FGF23CTR片段的抗体,而且从FGF23CTR片段和GST蛋白的相对分子质量大小对比来看,FGF23CTR片段的免疫原性远远大于GST蛋白。
3 讨 论
FGF23是多肽激素成纤维细胞生长因子(FGFs)家族的成员,FGFs家族包括22个功能各异的成员。FGF23基因位于染色体12p13区,与FGF19 及FGF21 基因产物有着24%和22% 的氨基酸相似性。FGF23 蛋白含有251 个氨基酸,相对分子质量为32 000,除含有FGF 家族同源性结构域N 端外,还包含一个由71个氨基酸组成的特异性C端。FGF23的功能不同于家族其他成员,在肾脏中其主要作用是通过近曲小管上皮细胞刷状缘膜上的钠-磷协同转运蛋白Ⅱa(NPT2a)内移和降解,促进磷排泄和抑制1-羟化酶的活性,增加尿磷的排泄,减少肾脏无机磷重吸收从而调节磷的排泄[7]。血清中FGF23主要由成骨细胞分泌,肾脏是FGF23主要的靶器官,健康人尿中可以检测到FGF23,提示肾脏可能是FGF23清除的主要器官。因此,纯化出FGF23 C端的特异性片段(FGF23CTR),对于FGF23的研究尤为重要。
钙磷代谢紊乱是CKD 特别是终末期肾病患者重要的并发症之一。研究[14]表明:CKD 时长期的钙磷代谢紊乱可引发甲状旁腺功能亢进、矿物质和骨代谢异常,还可引起肺、心肌、心脏瓣膜、血管等转移性钙化,使患者的生存质量下降,而且与慢性肾功能衰竭的死亡率增加相关联。维持合适的钙磷代谢平衡及甲状腺激素水平已经成为改善CKD患者的生存质量和延长寿命极其重要的方法,作为调磷因子作用的FGF23为CKD患者的治疗带来了希望,并且由于FGF23的代谢水平与CKD不同时期的患病程度相关[13],FGF23水平检测可能起到诊断CKD的作用,用于特异性检测FGF23的单克隆抗体制备还未见报道。
本研究利用GST表达系统,成功构建了GST-FGF23CTR融合蛋白的表达载体,并且纯化得到纯度大于90%以上的融合蛋白,经ELISA法检测蛋白具有良好免疫原性。有关FGF23纯化表达方面的研究少有报道,尤其是FGF23 C末端的71个氨基酸方面的研究亦很少。
本研究对FGF23末端的71个氨基酸的表达方法做了详细研究,为FGF23生理功能的进一步研究提供了条件,特别是为制备特异性针对FGF23单克隆抗体及为将来研发CKD诊断试剂奠定了基础。鉴于本研究中表达的是带GST标签的融合蛋白,将来做FGF23单克隆抗体时是否把GST标签切掉会更好,尚需进一步研究证实。
[参考文献]
[1]Yamashita T,Yoshioka M,Itoh N.Identification of a novel fibroblast growth factor,FGF-23,preferentially expressed in the ventrolateral thalamic nucleus of the brain[J].Biochem Biophys Res Commun,2000,277(2):494- 498.
[2]Berndt TJ,Sehiavi S,Kumar R.“Phosphatonins” and the regulation of phosphorus homeostasis[J].Am J Physiol Renal Physiol,2005,289(6):F1170- F1182.
[3]Imel EA,Econs MJ.Fibroblast growth factor 23:Roles in health and disease[J].J Am Soc Nephrol,2005,16(9):2565- 2575.
[4]Jonsson KB,Zahradnik R,Larsson T.Fibroblast growth factor 23 in oncogenic osteomalacia and X-linked hypophosphatemia[J].N Engl J Med,2003,348(17):1656- 1663.
[5]Wolf M.Fibroblast growth factor 23 and the future of phosphorus management[J].Curr Opin Nephrol Hypertens,2009,18(6):463-468.
[6]Seiler S,Heine GH,Fliser D.Clinical relevance of FGF-23 in chronic kidney disease[J].Kidney Int Suppl,2009,76(114):S34-S42.
[7]Liu S,Quarles LD.How fibroblast growth factor 23 works [J].J Am Soc Nephrol,2007,18(6):1637-1647.
[8]Komaba H,Fukagawa M.FGF23-parathyroid interaction:implications in chronic kidney disease[J].Kidney Int,2010,77(4):292-298.
[9]Imanishi Y.Inaba M,Nakatsuka K,et al.FGF-23 in patients with end-stage renal disease on hemodialysis[J].Kidney Int,2004,65(5):1943-1946.
[10]Shigematsu T,Kazama JJ,Yamashita T,et al.Possible involvement of circulating fibroblast growth factor 23 in the development of secondary hy perparathy roidism assoeiated with renal insuffieieney[J].Am J Kidney Dis,2004,44(2):250-256.
[11]奥斯伯 F,布伦特 R,金斯顿 RE,等.颜子颖,王海林,译.新编分子生物学实验指南 [M].北京: 科学出版社,1998: 78-79.
[12]朱佳男,姚 娜,官丽莉,等.KGF-2单克隆抗体间接ELISA筛选方法的建立[J].北华大学学报:自然科学版,2010(3):1009-4822.
[13]Shimada T,Kakitani M,Yamazaki Y,et al.Targeted ablation of FGF23 demonstrates an essential physiological role of FGF23 in phosphate and vitamin D metabolism[J].J Clin Invest,2004,113(4):561-568.
[14]Liu S,Zhou J,Tang W,et al.Pathogenic role of FGF23 in Hyp mice [J].Am J Physiol Endocrinol Metab,2006,291(1):E38-E49.

