125I粒子对体外培养的A549细胞系和人胚肺二倍体细胞系2BS细胞生长的影响及临床安全使用剂量评估
边文超,戚良晨
(吉林大学中日联谊医院胸外科,吉林 长春 130033)
125I粒子是一种人工同位素,主要产生γ射线,破坏肿瘤细胞核的DNA双链,经过足够的剂量和足够的半衰期,能使肿瘤细胞全部失去繁殖能力,从而达到较彻底的治疗效果。125I粒子组织间植入治疗恶性肿瘤最早应用于前列腺癌,后逐渐应用于肺癌、消化道肿瘤、鼻咽癌及颅内肿瘤[1-3]等,取得了较好的疗效。近10年来,125I粒子组织间植入近距离治疗肺癌的临床应用发展较快,植入技术日趋成熟,国内外有学者[4-7]已对125I粒子植入治疗非小细胞肺癌的疗效和安全性进行了探索,初步结果尚满意,这种疗法具有并发症少、植入方式灵活、单个粒子射线量低、易于防护等优点,有良好的发展前景。但目前国内外还未见125I粒子对肺癌及正常肺组织影响的基础研究报道。临床应用的剂量均是借鉴治疗前列腺癌的剂量或参照外放射治疗的剂量移植而来,治疗剂量的确定缺乏理论依据。因此本文作者通过观察不同剂量125I粒子对体外培养的人肺癌A549细胞系及人胚肺二倍体细胞系2BS生长的抑制作用,对比125I粒子对肿瘤细胞及正常肺细胞影响程度的不同,并分别绘制细胞生长曲线,以确定治疗非小细胞肺癌的适当剂量。
1 材料与方法
1.1 细胞、主要试剂及实验分组人肺癌细胞系A549及人胚肺二倍体细胞系2BS,购自中国科学院上海生命科学研究院,在含15%热灭活的胎牛血清的RPMI-1640培养基(Gibco公司),5%CO2、37℃培养箱中培养。放射性粒子6711型125I购自中国原子能科学院北京原博生物医学工程有限公司。本实验选用0.2、0.4及0.8 mCi125I粒子分为低、中、高剂量组,以无粒子组、空粒子组分别作为阴性对照组及空白组。
1.2 单层细胞的培养传代镜下观察细胞生长密度达80%以上时需要传代。吸出培养皿中废液,2 mL PBS冲洗,加进混入EDTA 1∶1比例的胰蛋白酶2 mL,放入CO2孵育箱(温度37℃,湿度5%)孵育2~3 min。贴壁细胞脱落后,及时用10%RPMI-1640培养液2 mL终止酶作用,镜下观察形成单个细胞悬液。然后离心,弃上清,重新加入10% RPMI-1640培养液悬浮细胞沉淀混匀,用细胞记数板镜下记数估算浓度,一般在5×105mL-1为佳,重新加入培养皿中,加适当10%RPMI-1640培养液继续培养。
1.3 细胞冻存方法为保持细胞活力及数量,一般在细胞生长对数期进行冻存。培养传代细胞生长进入对数期后,离心,弃上清,加入适量冻存液(无血清10%RPMI-1640培养液∶胎牛血清∶DMSO为7∶2∶1),分装在1.5 mL冻存管中,放入4℃冰箱,半小时后移置-20℃冰箱隔夜,最后放入-80℃冰箱或液氮罐长期保存。
1.4 细胞排染实验细胞损伤或死亡后细胞膜完整性破坏。正常细胞拒染而死亡细胞则染成蓝色。取100 μL细胞悬液加等量0.4%台盼蓝染色液,混合均匀,滴入血球计数板,稳定2 min后进行观察,在5 min内计数200个细胞。活细胞不染色,死亡细胞呈蓝色。将细胞生长抑制率[细胞生长抑制率= (对照组活细胞数-实验组活细胞数)/对照组活细胞数×100%]为Y轴,药物浓度为X轴作图,绘出剂量反映曲线,计算半数抑制浓度(50% inhibitory concentration,IC50)值。
1.5 绘制细胞生长曲线选用对数生长期的肿瘤细胞3×104mL-1于35 mm平皿。细胞置于5%CO2、37℃温箱中培养过夜,次晨皿上平铺0.75%琼脂,厚度约为0.5 cm,不同剂量125I粒子置入平皿中央。在第2、4、6及8天收集细胞,台盼蓝染色,计数活细胞。每种处理于每个时间点设3个平行组,求均值及标准差,绘制细胞生长曲线。
2 结 果
2.1 体外细胞显微镜下观察结果置入125I粒子后第4天,高剂量组125I粒子附近区域出现区域性低密度区。低及中剂量组未见明显变化。第6天,在高剂量组125I粒子周围0.8 cm范围内可见明显细胞密度减少,细胞间隙增大,部分区域接近空白。此时,在中剂量组中可见125I粒子附近区域出现较明显的区域性低密度区,低剂量组可见125I粒子附近区域出现轻微的密度减低区,对照组及空白剂量组中未见明显细胞密度变化。
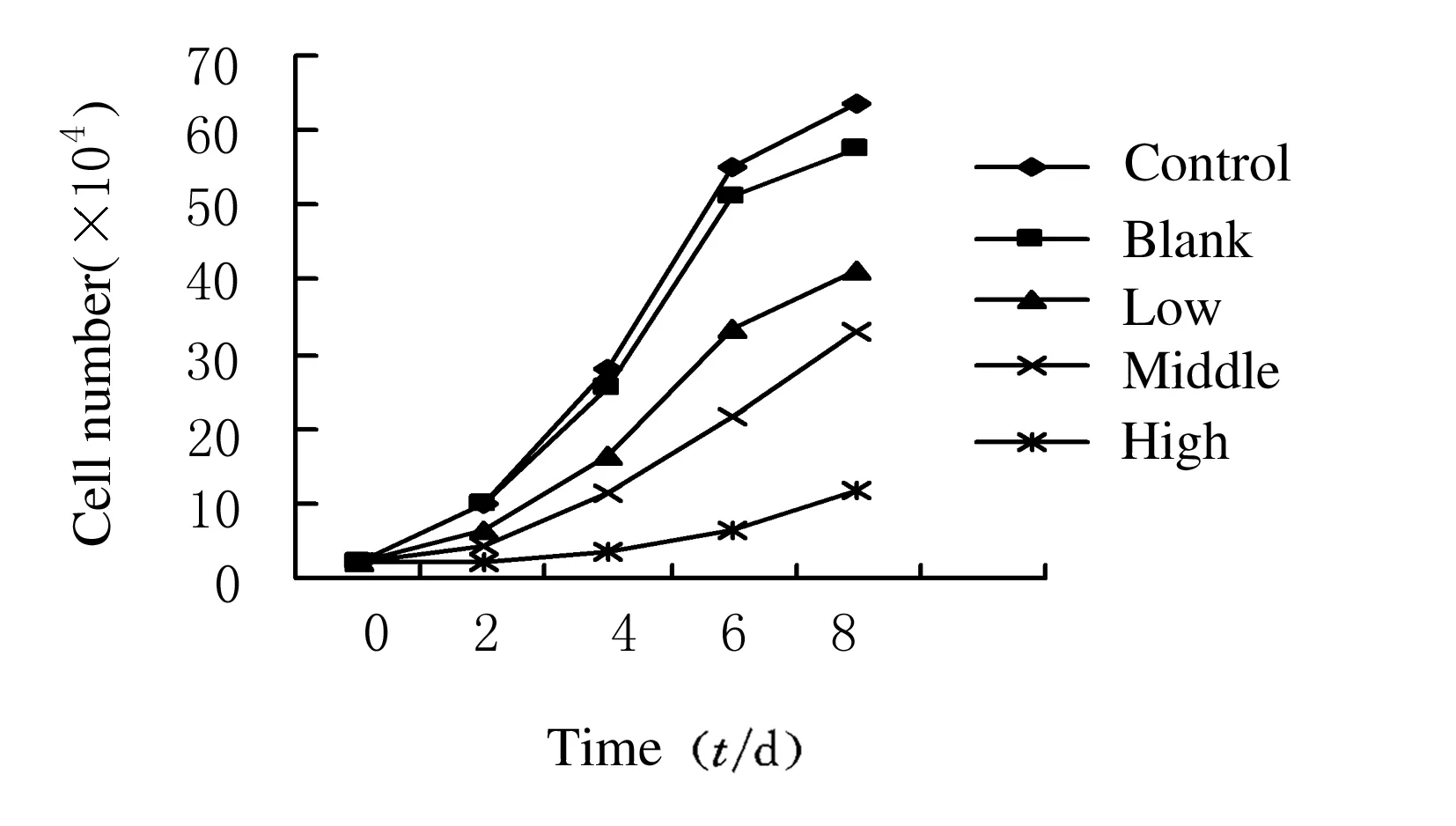
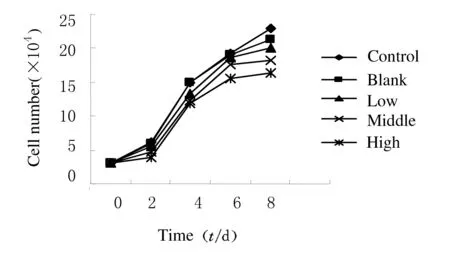
2.2 A549细胞和人胚肺二倍体细胞2BS生长曲线A549细胞在整个观察期内空白组、低剂量组和对照组的增殖趋势极为接近,而中、高剂量组细胞增殖明显受抑制,在第6天时最为明显;对照组,空白,低、中及高剂量组细胞数(×104mL-1)分别为55.23±1.62、51.16±1.81、33.41±1.24、21.62±0.41及6.51±0.39,对照组细胞数分别为空白,低、中、高剂量组的1.079、1.653、2.554和8.484倍。中、高剂量组与对照组、空白组及低剂量组比较差异有统计学意义 (P<0.05)。见图1A。空白,低、中剂量组和对照组的2BS细胞在整个观察期内增值趋势极为接近;高剂量组的增值速度略有减缓。与A549细胞比较,在第6天这种减缓细胞增殖的作用并不十分明显,对照组,空白,低、中、高剂量组细胞数(×104mL-1)分别为19.21±1.32、18.98±0.59、18.63±0.38、17.58±0.54及15.62±0.41;对照组细胞数分别是空白,低、中、高剂量组的1.012、1.031、1.092和1.230倍。各组间比较差异均无统计学意义(P>0.05)。见图1B。
A
B
2.3 A549和2BS细胞IC50的计算结果低、中、高剂量组A549细胞的抑制率分别为39.51%、60.85%和88.21%。将上述3组剂量所对应的抑制率连接成线,得出近似直线方程为:Y=aX+b,其中Y为抑制率,X为对应的剂量,a为系数,b为直线在Y轴上的截距。b=23.27,a=81.16。当Y=50时,X=0.334,即125I粒子对A549细胞的IC50值≈0.4 mCi。同理,低、中、高剂量组对2BS细胞的抑制率分别为11.26%、13.14%和23.98%。得出125I粒子对2BS细胞的IC50值≈1.65 mCi。
3 讨 论
125I粒子释放的γ射线破坏肿瘤细胞核的DNA双链,同时产生自由基使肿瘤细胞损伤,持续照射肿瘤细胞,使其氧增比减少、乏氧细胞减少,不断地消耗肿瘤干细胞而使肿瘤细胞死亡,失去增殖能力[8-9]。对处于DNA合成后期及有丝分裂期阶段的肿瘤细胞,少量的γ射线即能破坏其增殖能力;而处于增殖周期中其他阶段的肿瘤细胞,对γ射线敏感度较差;静止期的肿瘤细胞,对γ射线相对不敏感。肿瘤生长过程中只有一小部分细胞在持续增殖,因此分次、短时外照射只能对肿瘤繁殖周期中一部分时相的细胞起治疗作用,亚致死损伤的细胞快速修复,不同周期间细胞再分布,存活的活性细胞继续增殖,直接影响外照射的治疗效果[10]。将放射性粒子植入到瘤体和瘤周,低能量、持续照射肿瘤细胞,可使亚致死损伤细胞的修复率显著降低。因持续的组织间放射不可避免地影响着肿瘤细胞生长的微环境,将放大潜在致死损伤效应。肿瘤细胞处在不同的细胞周期,持续的照射可使较多处在敏感期的细胞被杀灭,使肿瘤细胞大部分迟滞于G2期[11-12],有效控制肿瘤的再群体化。
本实验中活度为0.2、0.4和0.8 mCi的125I粒子所辐射的γ射线造成的放射损伤多属亚致死性损伤和潜在致死性损伤,由于125I粒子置入培养皿,肿瘤细胞受到持续性损伤,得不到自我修复的机会。A549细胞生长曲线显示:高剂量组125I粒子对A549细胞有明显的杀伤作用,中剂量组125I粒子对A549细胞的增殖具有明显的抑制作用,低剂量组125I粒子对肿瘤细胞增殖抑制不明显,可能是其活度偏低的缘故。2BS细胞生长曲线显示:仅高剂量组125I粒子对细胞增殖有一定抑制作用,而低、中剂量组均无明显抑制细胞增殖作用。本文作者认为:正常组织对125I粒子所辐射的γ射线较为耐受,即要对正常组织产生放射损伤需要更高活度的125I粒子,这也是2BS细胞的IC50值远高于A549细胞的原因。
本研究结果表明:①体外实验证实放射性125I粒子的活度为0.4 mCi时已对A549细胞具有明显的杀伤效应,0.8 mCi时杀伤效应更强。故推荐临床使用粒子的有效活度范围是0.4~0.8 mCi。②放射性粒子125I对2BS细胞的IC50为1.6 mCi,临床应用放射性粒子125I的安全剂量应为0.4~0.8 mCi。
[参考文献]
[1]Langley SEM,Laing RW.Iodine seed prostate brachytherapy: An alternative first-line choice for early prostate cancer[J].Prostate Cancer Prostatic Dis,2004:7:201-207.
[2]Nag S,DeHaan M,Scruggs G,et al.Long-term follow-up of patients of intrahepatic malignancies treated with iodine-125 brachyt herapy[J].Int J Radiat Oncol Biol Phys,2006,64(3):736-744.
[3]Wang J,Yuan H,Li J,et al.Interstitial permanent implantation of125I seeds as salvage therapy for re-recurrent rectal carcinoma[J].Colorectal Dis,2009,24(4):391-399.
[4]刘 墨,樊喜文,王萍菊,等.放射性125I粒子组织间植入治疗非小细胞肺疗效分析[J].新疆医科大学学报,2011,34(8):876-878.
[5]王俊龙,张七一,任树云,等.CT导引下125I放射粒子植入结合化疗治疗晚期非小细胞肺癌的临床观察[J].昆明医学院学报,2006,53(2):55-58.
[6]张忠松,周万忠.肺癌手术中组织间植入放射粒子29例临床分析[J].齐鲁医学杂志,2005,20(6):527.
[7]Santos R,Colonas A,Parda D,et al.Comparison between sublobes resection and iodine-125 brachy therpy after sublobes resection in high-risk patients with stage Ⅰ non-small-cell lung cancer[J].Surgery,2003,13(4):691-697.
[8]Schneiderman MH,Schneiderman GS.Radioiododeoxyuridine in cancer therapy:an in vitro approach to developinginvivostrategies [J].J Nucl Med,1996,37(4 Suppl):6S-9S.
[9]王俊杰,修典荣,冉维强.放射性粒子组织间近距离治疗肿瘤[M].北京:北京大学医学出版社,2004:49-62.
[10]徐怀德,金护申.125I粒子治疗肿瘤的临床经验[A].见:王俊杰,唐劲天,黎 功.放射性粒子近距离治疗肿瘤[M] .北京:北京医科大学出版社,2001:172.
[11]于 雷,陈红红,程文英.125I籽源持续照射对人肺癌细胞凋亡及DNA-PK蛋白表达的影响[J].中国临床医学,2007,14(6):776-778.
[12]Nakamura H,Yasui Y,Saito N,et al.DNA repair defect in AT cells and their hypersensitivity to low-dose-rate radiation[J].Radiat Res,2006,165(3):277-282.

