系统性红斑狼疮患者静脉血BCMA和CD138+浆细胞的研究*
牛晓昶,曾照芳,贾 佳,李艳林,夏 季,黄恒柳,邓少丽△
(1.第三军医大学大坪医院野战外科研究所检验科,重庆400042;2.重庆医科大学检验系 400016;3.重庆医科大学附属儿童医院 400014)
系统性红斑狼疮(systemic lupus erythematosus,SLE)简称红斑狼疮,是由多克隆自身反应性B细胞介导的自身免疫性疾病,B细胞异常激活并异常分化为浆细胞和记忆性效应细胞,其直接的致病因子是多克隆自身抗体,并以免疫复合物的形式造成多种组织器官损伤。虽然目前对于引起SLE的确切病因仍不明确,但是SLE中异常浆细胞分泌多种致病性自身抗体导致SLE的发生已成共识,这些抗体主要来源于浆细胞。浆细胞存活及其抗体分泌功能主要由B淋巴细胞成熟抗原(B cell maturation antigen,BCMA)调控,虽然BCMA作用的相关机制至今尚未完全清楚,但是已有研究显示BCMA在浆细胞的存活中发挥重要作用[1]。因此,阻断BCMA可选择性抑制浆细胞的存活,减少抗体的分泌,BCMA成为治疗SLE的潜在靶点。白细胞分化抗原(cluster of differentiation,CD)138是浆细胞特异的膜抗原,是成熟浆细胞的标记。本研究从BCMA蛋白维持浆细胞存活的角度出发,探讨BCMA表达和CD138+浆细胞数量在SLE患者和健康人体内存在的差异,为研究SLE的发病机制提供新的思路。
1 材料与方法
1.1 主要试剂与仪器 主要试剂包括:人BCMA酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司,Ficoll细胞分离液购自美国GE公司,磷酸盐缓冲溶液(phosphate buffered solution,PBS)购自北京中衫金桥生物技术有限公司,Trizol为Invitrogen公司产品,焦碳酸二乙酯(diethypyrocarbonate,DEPC)原液为Sigma公司产品,实时聚合酶链反应(real time-polymerase chain reaction,RTPCR)试剂盒购自Promega公司。抗CD138-藻红蛋白(phycoerythrin,PE)、CD38-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、CD19-FITC、CD45-藻红蛋白-花青苷5(phycoerythrin cyanin 5,PC5)、CD56-PE、IgG1-PE/IgG1-FITC/IgG1-PC5抗体均购自BECKMAN公司,Taq酶购自Promega公司。主要仪器包括:CFX-96实时荧光定量PCR仪(Bio-Rad公司)、ND-1000微量紫外可见分光光度计(美国Nanodrop公司)、流式细胞仪(美国Backman公司),MK3酶标分析仪(芬兰雷勃公司)。
1.2 材料 选择2009年4月至2011年6月于第三军医大学大坪医院就诊的40例临床确诊的SLE患者作为SLE组,均符合1997年美国风湿病学会修订的SLE诊断标准,年龄15~54岁,平均(34.0±6.0)岁。将同期进行健康体检的30例健康人作为对照组,年龄26~49岁,平均(35.0±5.0)岁。取上述患者及健康人的静脉血进行研究,采集的血液标本用乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝。
1.3 引物 BCMA 引物:上游5′-GCA TCA AGA GCA AAC CGA AGG-3′,下游5′-TCT ATC TCC GTA GCA CTC AAA GC-3′;BCMA 荧光探针:FAM-5′-CGA CTC TGA CCA TTG CTT TCC ATC CCC A-3′。B2 M 引 物:上 游 5′-TCC ATC CGA CAT TGA AGT TGA C-3′,下 游 5′-ACT ATC TTG GGC TGT GAC AAA G3′;B2 M 探 针:FAM-5′-TGG TTC ACA CGG CAG GCA TAC TCA-3′。上述引物和荧光探针均购自上海生工生物工程技术服务有限公司。
1.4 ELISA法检测 BCMA (1)包被:以 PBS将72μg/mL捕获抗体稀释至终浓度为0.4μg/mL,将其加入空白微孔板(100μL/孔),室温过夜,0.05%Tween20洗涤液洗板3次,甩干;(2)封闭:以试剂稀释剂(含1%牛血清清蛋白的PBS液)封闭微孔,每孔300μL,室温放置至少1h,0.05%Tween20洗涤液洗板3次,甩干,备用;(3)加样:以试剂稀释剂稀释重组人BCMA标准品,对倍稀释,稀释后终浓度为31.25、62.50、125.00、250.00、500.00、1 000.00、2 000.00pg/mL,将其 分 别加入100μL标准液或待测血清,室温放置2h,以0.05%Tween20洗涤液洗板3次,甩干;(4)加入生物素化羊抗人BCMA抗体:以试剂稀释剂将36μg/mL检测抗体稀释至终浓度为200ng/mL,每孔100μL,室温放置2h,0.05%Tween20洗涤液洗板3次,甩干;(5)加入链霉亲和素-辣根过氧化物酶(streptavidin-horseradish peroxidase,SA-HRP):SA-HRP以试剂稀释剂按1∶200稀释后加入微孔中,每孔100μL,避免强光直射,放置室温20min,以0.05%Tween20洗涤液洗板3次,甩干;(6)显色、测定:每孔加入显色剂A和显色剂B各50μL,避免强光直射,放置室温20min后加入终止液50μL,在酶标仪上读取450nm处光密度(optical density,OD)值;绘制标准曲线,计算待测样本的BCMA含量。
1.5 单个核细胞RNA的提取 用Ficoll细胞分离液通过离心(离心半径9cm,2 000r/min离心20min),将标本中的单个核细胞分离出来,用1%PBS洗涤,然后再离心(2 500r/min离心10min),去上清液,留单个核细胞于管底。用Trizol破裂细胞,氯仿、异丙醇和75%乙醇萃取、沉淀,提取细胞RNA,将RNA溶解在无核酸酶水中,测定其浓度和纯度,为不影响实验结果,浓度应不小于300ng/μL,A260/A280不小于2.0。根据RT-PCR试剂盒说明书取1mg RNA进行逆转录得到cDNA,-20℃冻存备用。
1.6 荧光定量RT-PCR检测 反应体系:Free water 3.4μL、Mix混合液5.0μL、上游引物0.3μL、下游引物0.3μL、BCMA探针0.3μL、Taq酶0.2μL、cDNA 0.5μL、总体积10.0μL。PCR反应条件:95℃预变性3min后,95℃变性10s,58℃退火30s,共45个循环。计算的周期阈值(cycle threshold,Ct),根据相对定量2-ΔΔCt法计算SLE组和对照组静脉血BCMAmRNA的差异。
1.7 流式细胞术检测 将两组标本在Ficoll细胞分离液的作用下离心(离心半径9cm,2 000r/min离心20min),收集单个核细胞,用1%PBS洗涤。将 CD138-PE、CD38-FITC、CD19-FITC、CD45-PC5、IgG1-PE/IgG1-FITC/IgG1-PC5荧光抗体标记的单 个 核 细 胞 分 为 3 组:(1)CD38-FITC、CD138-PE 及CD45-PC5标记细胞组;(2)CD19-FITC、CD138-PE 及 CD45-PC5标记细胞组;(3)IgG1-PE/IgG1-FITC/IgG1-PC5及 CD45-PC5标记细胞组。3组细胞均孵育1~2h后上机检测。
1.8 统计学处理 应用SPSS12.0软件进行统计学处理,计量数据用±s表示,组间差异的比较用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 血清ELISA检测分析 SLE组患者血清BCMA水平显著高于对照组,差异有统计学意义(P<0.01),见表1。

表1 SLE患者与健康者血清BCMA水平的比较
2.2 荧光定量RT-PCR分析 经45次循环,荧光定量RTPCR反应曲线见图1。SLE组患者的ΔCt值明显高于对照组的ΔCt值,差异有统计学意义(P<0.05),SLE组为0.811,对照组为1.716。经2-ΔΔCt法计算(-ΔΔCt=SLE组-对照组),SLE组患者BCMA基因的含量是对照组的1.873倍,见图2。
图1 荧光定量RT-PCR反应曲线
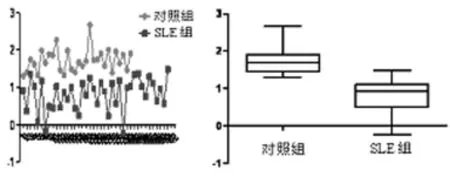
图2 SLE组和对照组的ΔCt分布情况和ΔCt值

图3 SLE组(左)和对照组(右)患者的流式细胞术检测结果
2.3 流式细胞术分析 流式细胞技术检测结果显示,SLE组患者静脉血浆细胞数量明显高于对照组,见图3。
3 讨 论
BCMA为B细胞表面分子,是由184个氨基酸残基组成的非糖基化单链Ⅰ型蛋白,属于肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)家 族,是 Ⅰ 型 跨膜受体[2]。BCMA 表达于 B细胞的生发中心[3]、成熟 B细胞[4-5]以及成熟浆细胞 表 面[1,6]。B 细 胞 激 活 因 子 (B cell activating factor,BAFF)是B细胞产生、发育和自身反应所必需[7-9]。BCMA可与BAFF配体相结合,其可能机制是BCMA与BAFF蛋白结合,使抗凋亡基因Bcl-2、Mcl-1的表达上调,维持浆细胞生长,成为长寿浆细胞,从而增加成熟浆细胞的数量及其抗体的分泌[9]。在自身免疫疾病患者,尤其是SLE患者体内可检测出高水平的BAFF[10-11],因此,在维持浆细胞的存活中BCMA 发挥了重要的作用。BCMA基因位于16p13,mRNA全长约1.2kb[12]。人类浆细胞、生发中心 B淋巴细胞[3]以及小鼠浆细胞的BCMA表达明显升高,其缺失会缩短骨髓长寿浆细胞生存时间[1]。分析B细胞发育过程的基因表达谱,发现BCMA随着B细胞的发育成熟而出现,其表达量逐渐增加,且只表达于成熟B淋巴细胞及浆细胞,为维持浆细胞存活所必需,在B细胞发育的时空性上具有一致性[13]。BCMA虽在生发中心B细胞中表达,但它对外周B细胞的数量、各种外周B细胞亚型的分布以及B细胞的寿命没有明显影响,在成熟B细胞分化到浆细胞阶段,其BCMA表达较多,BCMA可能与调控浆细胞存活及抗体分泌功能有关。浆细胞是致病性自身抗体的直接来源,40%自身抗体分泌性浆细胞是长寿命的,长寿浆细胞产生的自身抗体可反复激活潜在的病理免疫应答反应[14]。BCMA基因剔除小鼠有正常的脾结构,B细胞发育正常,T细胞非依赖性免疫反应和T细胞依赖性免疫反应未见明显异常,但浆细胞数量明显减少,这又证明BCMA在维持浆细胞存活中的重要性[1]。
CD138+能特异性地标记成熟浆细胞,本研究利用这一特征对SLE组和对照组静脉血的单个核细胞进行流式细胞术分析,比较两组CD138+浆细胞数量的差异。本研究将荧光定量RT-PCR技术、流式细胞术及ELISA结合,研究维持浆细胞存活的重要因子BCMA。其结果显示SLE组血清BCMA明显高于对照组,SLE组体内BCMA基因表达的相对量是对照组的1.873倍,且流式细胞术显示SLE组患者静脉血CD138+浆细胞的数量也明显高于对照组,提示在SLE患者体内BCMA基因高表达,SLE患者体内浆细胞数量的增加与BCMA高表达相关,这为进一步了解SLE发病机制提供了新的线索,为SLE治疗提供了新的方向和靶点。
[1] O′connor BP,Raman VS,Erickson LD,et al.BCMA is essential for the survival of long-lived bone marrow plasma cells[J].J Exp Med,2004,199(1):91-98.
[2] Lofton-Day C,Moore M,Littau A,et al.TACI and BCMA are receptors for a TNF homologue implicated in B-cell autoimmune disease[J].Nature,2000,404(6781):995-999.
[3] Ng LG,Sutherland AP,Newton R,et al.B cell-activating factor belonging to the TNF family (BAFF)-R is the principal BAFF receptor facilitating BAFF costimulation of circulating T and B cells[J].J Immunol,2004,173(2):807-817.
[4] Gras MP,LaâbiY,Linares-Cruz G,et al.BCMAp:an integral membrane protein in the Golgi apparatus of human mature B lymphocytes[J].Int Immunol,1995,7(7):1093-1106.
[5] Thompson JS,Schneider P,Kalled SL,et al.BAFF binds to the tumor necrosis factor receptor-like molecule B cell maturation antigen and is important for maintaining the peripheral B cell population[J].J Exp Med,2000,192(1):129-135.
[6] Avery DT,Kalled SL,Ellyard JI,et al.BAFF selectively enhances the survival of plasmablasts generated from human memory B cells[J].J Clin Invest,2003,112(2):286-297.
[7] Mackay F,Schneider P,Rennert P,et al.BAFF AND APRIL:a tutorial on B cell survival[J].Annu Rev Immunol,2003,21:231-264.
[8] Mackay F,Silveira PA,Brink R.B cells and the BAFF/APRIL axis:fast-forward on autoimmunity and signaling[J].Curr Opin Immunol,2007,19(3):327-336.
[9] Benson MJ,Dillon SR,Castigli E,et al.Cutting edge:the dependence of plasma cells and independence of memory B cells on BAFF and APRIL[J].J Immunol,2008,180(6):3655-3659.
[10]Cheema GS,Roschke V,Hilbert DM,et al.Elevated serum B lymphocyte stimulator levels in patients with systemic immune-based rheumatic diseases[J].Arthritis Rheum,2001,44(6):1313-1319.
[11]Zhang J,Roschke V,Baker KP,et al.Cutting edge:a role for B lymphocyte stimulator in systemic lupus erythematosus[J].J Immunol,2001,166(1):6-10.
[12]Shu HB,Johnson H.B cell maturation protein is a receptor for the tumor necrosis factor family member TALL-1[J].Proc Natl Acad Sci U S A,2000,97(16):9156-9161.
[13]Shapiro-Shelef M,Calame K.Regulation of plasma-cell development[J].Nat Rev Immunol,2005,5(3):230-242.
[14]Levesque MC,St Clair EW.B cell-directed therapies for autoimmune disease and correlates of disease response and relapse[J].J Allergy Clin Immunol,2008,121(1):13-21.

