Zn2+结合相关基因在耐药性癫痫患者颞叶组织中的表达
杨 柳,周月琴,张 敏
(重庆市急救医疗中心神经内科 400014)
癫痫是一组以反复发作的脑功能失常(神经元异常放电)为特征的慢性脑部疾病,全球约有5 000万左右的癫痫患者[1]。抗癫痫治疗后,70%~75%癫痫患者的病情可得到控制,但有25%~30%的患者产生耐药,耐药性癫痫严重危害人类健康。锌离子(Zn2+)存在于人体所有细胞,为生命所必需,是人体100多种酶的组成部分,锌指结构是由肽链中氨基酸残基的特征基团与Zn2+结合形成的一种很短的、可自我折叠成“手指”形状的多肽空间构型,具有该结构的蛋白多参与基因表达的调控、细胞分化及胚胎发育等过程。Zn2+主要分布在海马齿状回,尤其在苔藓纤维突触囊泡内分布较多[2]。许多研究表明,Zn2+含量的异常与癫痫的发生、发展相关[3-4],但目前关于Zn2+和耐药性癫痫的研究报道较少。本课题采用高通量研究方法寻找Zn2+相关基因的表达规律,以探讨耐药性癫痫的发病机制。
1 资料与方法
1.1 一般资料 选择2002年至2004年在重庆医科大学第一附属医院、首都医科大学天坛医院、北京宣武医院、卫生部北京医院及第三军医大学新桥医院就治的患者。将48例接受手术治疗的耐药性癫痫患者作为耐药性癫痫组,其中,男25例,女23例;平均年龄(24.10±9.13)岁;部分发作继发全身性强直-阵挛发作34例,复杂部分性发作13例,单纯部分性发作1例。对照组8例,其中,男2例,女6例;平均年龄(25.89±13.56)岁;2例为意外死亡后按相关规定进行尸检者,6例为接受颅内减压术患者。
1.2 入组条件 耐药性癫痫组入组条件:(1)具有癫痫发作的典型表现和脑电图特征;正规服用过3种或以上一线抗癫痫药(如苯妥英钠、卡马西平、丙戊酸镁、苯巴比妥等);除服用丙戊酸镁外,患者的血药浓度维持在正常高线;与发作前基线比较,服药后发作频率无明显减少。(2)无明确病因,体格检查提示无局灶性神经系统体征,或虽有体征但与癫痫发作无关;术后脑组织检查未发现能引起癫痫发作的病因。(3)头颅CT或磁共振成像检查除提示海马硬化外,无其他异常。(4)患者的发作类型符合国际抗癫痫联盟1981年有关癫痫发作类型分类的规定。(5)手术前1周放置硬膜下电极,术中用皮质电极进行监测,发现有明确且固定的癫痫放电部位,有手术适应证,且能进行手术者。对照组入组条件:(1)无中枢神经系统病史;(2)尸检未发现脑组织有能够引起癫痫发作的结构和功能损伤,取材与死亡的时间间隔小于5h。上述患者均获得家属同意,并签署知情同意书。
1.3 样本采集 耐药性癫痫组患者在手术中取颞叶组织待检,对照组尸检及手术患者的取材部位为颞叶组织。组织样本采集后立即放入液氮(-196℃)保存备用。
1.4 高通量基因芯片差异表达谱分析 由上海博星基因芯片有限责任公司进行芯片制备,将耐药性癫痫组及对照组样本总RNA配对,进行探针标记[芯片分别编号:芯片1(人H40s)、芯片2(人 H40s)、芯片3(人 H140s)]。用ScanArray 4000扫描仪扫描芯片,以GenePix Pro 3.0图像处理软件分析Cy3、Cy5两种荧光信号的强度和比值。筛选出Cy3、Cy5信号强度值均大于200的基因点,并将Cy5/Cy3比值大于2的基因点的基因作为差异表达基因。实验重复2次。
1.5 引物合成及逆转录聚合酶链反应(reverse transcriptasepolymerase chain reaction,RT-PCR) 根据 Genebank中基因的mRNA和DNA序列,引物的设计和合成都由Introvegen公司完成,引物序列见表1。按常规步骤使用BIOZOL试剂提取总RNA,然后进行逆转录合成cDNA第一链,操作参照TaKaLa产品说明书(大连宝生物工程有限公司),反应产物于-20℃保存。PCR反应参数:94℃预变性5min,94°变性30s,55~60℃退火30s,72℃延伸30s,共35个循环,最后72℃延伸10min。PCR产物在1.5%琼脂糖凝胶上电泳,采用Bio-rad凝胶成像系统软件分析电泳条带,分别检测TNF受体相关因子(TNF receptor associated factor,TRAF)3、Ring和YY1结合蛋白(ring and YY1binding protein,RYBP)、CCR4-NOT转录复合体亚基4(CCR4-NOT transcription complex,subunit 4,CNOT4)、核受体4A2(nuclear receptor subfamily 4,group A,member 2,NR4A2)、β-actin-f、β-actin-s mRNA 的光密度值,目的基因的相对光密度=目的基因光密度值÷β-actin光密度值。

表1 目的基因的引物序列
1.6 统计学处理 应用SPSS13.0软件进行统计分析,计量数据用±s表示,组间比较采用单因素t检验,单因素分析有显著性差异的指标,将其作为自变量进行多元线性回归分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 总RNA的抽提以及质控 耐药性癫痫组和对照组脑组织样本的总 RNA浓度分别为154.37μg/mL及167.21μg/mL。两组样本采用紫外分光光度计检测光密度(optical density,OD)值,其 OD260/OD280分别为1.834和1.908,均介于1.7~2.2;电泳结果显示RNA条带清晰,提示样本的总RNA质量合格,见图1。
2.2 基因芯片和RT-PCR结果 扫描的4 097条人类基因,耐药性癫痫组与对照组共有451条基因表达有差异,其中耐药性癫痫组患者脑组织中基因表达上调的有291条,下调的有160条,其中TRAF3、RYBP、CNOT4和NR4A2这4种与锌结合相关的基因在耐药性癫痫组患者脑组织中的表达较对照组明显增强(P<0.01),其Cy5/Cy3比值分别为2.451、2.228、2.516及2.445。RT-PCR的结果与芯片表达谱分析结果一致。耐药性癫痫组患者脑组织中TRAF3、RYBP、CNOT4和NR4A2基因的相对光密度分别为0.47±0.12、0.35±0.13、0.58±0.11及0.41±0.20,与对照组比较差异有统计学意义(P<0.01),见图2、3。

图1 总RNA电泳图

图2 耐药性癫痫和对照组患者脑组织中TRAF3、RYBP、CNOT4和NR4A2mRNA的表达
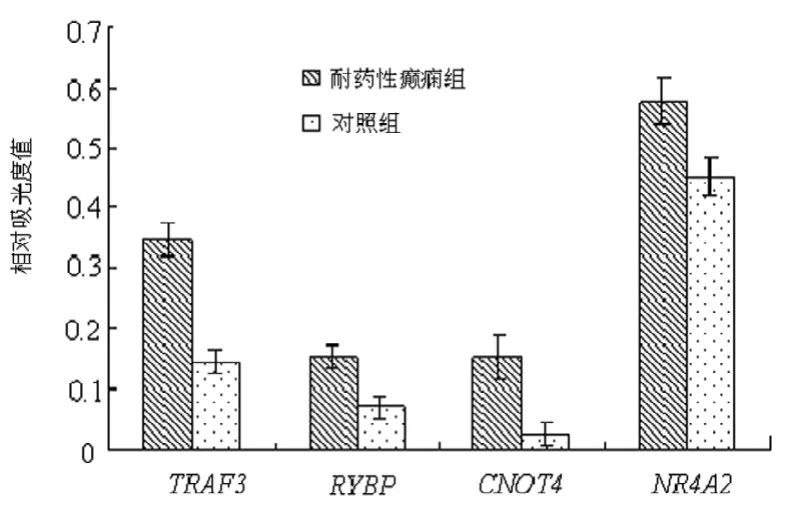
图3 耐药性癫痫和对照组患者脑组织中TRAF3、RYBP、CNOT4和NR4A2mRNA表达的相对光密度值比较
3 讨 论
癫痫是神经系统的常见病、多发病。癫痫发病机制的研究一直是国际神经科学研究的前沿,借助分子生物学、神经药理学、脑影像学、神经行为学以及基因工程动物模型等研究手段,人类在癫痫研究的许多方面取得了显著成绩,然而癫痫的发病机制难以完全归因于某一分子事件和基因的改变,神经网络自身稳态的破坏、异常神经网络的形成以及环境因素对癫痫的发生、发展都起着重要作用。
大通量检测基因表达的芯片技术成为研究癫痫发生、发展机制的重要手段,利用其可同时对成千上万基因进行同步检测的功能,使人们能够综合分析不同个体、组织的不同发育阶段的病变特征,高通量地研究基因功能,揭示疾病的发生机制,具有高效、快速及同步分析生物信息的特点。本课题利用基因芯片技术同步检测耐药性癫痫患者脑组织中4 097条基因表达的差异,发现有451条基因表达异常,TRAF3、RYBP、CNOT4和NR4A2这4种与Zn2+结合相关的基因在耐药性癫痫组患者脑组织中的表达较对照组明显增强,采用RT-PCR扩增证实这些差异表达基因的存在,说明耐药性癫痫患者脑组织中确实存在Zn2+相关基因的异常表达。
耐药性癫痫,又称难治性癫痫,是指临床上经合理使用多种抗癫痫药物治疗后,抗癫痫药物的血药浓度已达到患者的最大耐受剂量,但癫痫发作仍不能得到有效控制的癫痫。流行病学调查发现,大约有70%难治性癫痫为颞叶癫痫,颞叶癫痫最显著的临床特征是长期反复出现的自发性癫痫发作,颞叶癫痫患者脑组织出现明显病理改变,伴随不同临床和脑电图表现,颞叶癫痫患者对大部分抗癫痫药物产生了耐药性[5]。
人们发现Zn2+在脑组织内的分布主要集中在海马、颞叶、皮层和杏仁核,这与耐药性癫痫的好发部位基本一致。Bitanihirwe和Cunningham[3]向大鼠脑组织内注射小剂量Zn2+后,引起大鼠跳跃、奔跑、强直阵挛性抽搐;Pei和Kouama[6]通过在兔子海马内注射硫酸锌,成功建立了阵挛和继发性癫痫发作模型;还有研究发现,某些癫痫患者脑组织的Zn2+浓度明显高于正常人[7-8]。这些研究提示Zn2+与癫痫发作密切相关。本研究旨在从基因角度揭示Zn2+与耐药性癫痫的关系。
尽管Zn2+与癫痫发作关系的机制还不清楚,然而,目前的研究 发 现 Zn2+可 抑 制 γ-氨 基 丁 酸 (γ-aminobutyric acid,GABA)转运体活性,GABA能清除突触间隙内的GABA,而突触内存在大量GABA,使突触后GABA受体易被激活而发挥抑制作用。在神经元兴奋情况下,Zn2+浓度升高,可通过抑制N-甲基-D-天冬酰胺受体而降低神经元兴奋性;同时,通过增加GABA数量来增强其抑制作用[9]。
Zn2+还可影响电压门控离子通道的闭合。研究发现,Zn2+是 Na+-K+-ATP酶的竞争性抑制剂,可显著抑制 Na+-K+-ATP酶活性,使细胞膜的离子梯度受到破坏而失去稳定性,出现过度兴奋状态,导致癫痫发作[10]。
另外,Zn2+诱导神经元死亡也是其诱导癫痫发作的一个重要因素[11]。组织化学研究发现,在癫痫状态下,神经纤维内的Zn2+浓度明显减少(以苔藓纤维通路最为显著),而在受损的海马CA3、CA1区锥体细胞内出现大量Zn2+聚集,细胞内Zn2+聚集量与神经元受损程度明显正相关。Yokoyama等[12]认为30μmol/L Zn2+可使体外培养的神经元死亡。
研究发现耐药性癫痫可能的发病机制包括细胞能量代谢障碍、神经元凋亡、皮层发育异常和神经网络的重建[13-14]。在各种原因导致的耐药性癫痫患者的脑组织中均存在神经元的凋亡,而越来越多的研究证实细胞内Zn2+浓度的动态平衡与细胞凋亡密切相关。在临界值以下,Zn2+水平增加,可预防或改善与细胞凋亡有关的细胞退行性变,而超过临界值,Zn2+水平的增加,则可促进细胞凋亡,其机制可能是促进反应性氧化产物的产生和积聚,激活自杀相关因子(factor associated suicide,FAS)配体途径、肿瘤坏死因子(tumor necrosis factor,TNF)α及细胞色素C介导的Caspase-3活化途径,直接或间接激活细胞的凋亡[15-16]。本研究发现在耐药性癫痫患者脑组织中,与Zn2+代谢相关的基因表达异常,推测Zn2+异常导致的神经元凋亡可能参与了耐药性癫痫的发生、发展。
Zn2+代谢受到多种因素的调节。TRAF3属于TRAF超家族中的重要一员,是存在于细胞质的重要接头分子,它一方面接收外来刺激信号,另一方面又通过其TRAF同源结构域募集细胞质内其他含有TRAF结构域的蛋白分子传递信号。近年来,人们发现TRAF在细胞内发挥着两种截然不同的作用,它既是核因子kappa B通路的负向调控因子[17],又是正向调控I型干扰素产物的关键因子[18],二者都在先天和后天免疫中发挥重要作用。RYBP是一种多肽梳齿蛋白,它可通过与转录因子及多肽梳齿蛋白产物的结合,在胚胎发育、细胞凋亡等过程中发挥重要作用[19]。保守的CNOT4对于多种细胞功能具有重要作用,它参与mRNA调控[20]、蛋白泛素化/降解[21]及组氨酸甲基化等过程[22]。NR4A2在调节细胞增殖、分化及凋亡等过程中也发挥关键作用,它在调节血糖和血脂平衡、脂肪细胞分化、炎症及血管重建等方面发挥重要作用[23]。上述4个蛋白均属锌指蛋白,都含有与Zn2+结合的结构域,能够直接或间接影响Zn2+的结合[17,24],并都参与调节细胞的凋亡。有研究认为同属于锌指蛋白家族的NHLRC1(NHL repeat containing 1)[25]、锌指结构同源盒1B(zinc finger homeobox 1b,ZFHX1B)[26]、植物同源结构域指蛋白 6[plant homeodomain(PHD)-like finger 6,PHF6]等基因与癫痫也有着密切的联系[27],因此推测 与Zn2+结 合相 关 的TRAF3、RYBP、CNOT4和NR4A2基因也参与了癫痫的发生、发展。
目前对Zn2+结合相关基因的研究刚刚开始,在本研究中,基因芯片和RT-PCR检测结果提示耐药性癫痫患者脑组织中与Zn2+结合相关的4种基因有明显的异常表达,这从一个新的角度对耐药性癫痫的发生机制进行了初步探讨,但它们是否在蛋白质水平上也存在表达异常,其内在机制还有待进一步研究。
[1] de Boer HM,Mula M,Sander JW.The global burden and stigma of epilepsy[J].Epilepsy Behav,2008,12(4):540-546.
[2] Mitsuya K,Nitta N,Suzuki F.Persistent zinc depletion in the mossy fiber terminals in the intrahippocampal kainate mouse model of mesial temporal lobe epilepsy[J].Epilepsia,2009,50(8):1979-1990.
[3] Bitanihirwe BK,Cunningham MG.Zinc:the brain′s dark horse[J].Synapse,2009,63(11):1029-1049.
[4] Elsas SM,Hazany S,Gregory WL,et al.Hippocampal zinc infusion delays the development of afterdischarges and seizures in a kindling model of epilepsy[J].Epilepsia,2009,50(4):870-879.
[5] Xi ZQ,Xiao F,Yuan J,et al.Gene expression analysis on anterior temporal neocortex of patients with intractable epilepsy[J].Synapse,2009,63(11):1017-1028.
[6] Pei YQ,Koyama I.Features of seizures and behavioral changes induced by intrahippocampal injection of zinc sulfate in the rabbit:a new experimental model of epilepsy[J].Epilepsia,1986,27(3):183-188.
[7] Hamed SA,Abdellah MM,El-Melegy N.Blood levels of trace elements,electrolytes,and oxidative stress/antioxi-dant systems in epileptic patients[J].J Pharmacol Sci,2004,96(4):465-473.
[8] Armutcu F,Ozerol E,Gurel A,et al.Effect of long-term therapy with sodium valproate on nail and serum trace element status in epileptic children[J].Biol Trace Elem Res,2004,102(1/3):1-10.
[9] Cohen-Kfir E,Lee W,Eskandari S,et al.Zinc inhibition of gamma-aminobutyric acid transporter 4(GAT4)reveals a link between excitatory and inhibitory neurotransmission[J].Proc Natl Acad Sci USA,2005,102(17):6154-6159.
[10]Ribeiro MG,Pedrenho AR,Hassón-Voloch A.Electrocyte(Na(+),K(+))ATPase inhibition induced by zinc is reverted by dithiothreitol[J].Int J Biochem Cell Biol,2002,34(5):516-524.
[11]Koh JY,Suh SW,Gwag BJ,et al.The role of zinc in selective neuronal death after transient global cerebral ischemia[J].Science,1996,272(5264):1013-1016.
[12]Yokoyama M,Koh J,Choi DW.Brief exposure to zinc is toxic to cortical neurons[J].Neurosci Lett,1986,71(3):351-355.
[13]Bilevicius E,Yasuda CL,Silva MS,et al.Antiepileptic drug response in temporal lobe epilepsy:a clinical and MRI morphometry study[J].Neurology,2010,75(19):1695-1701.
[14]Wang L,Liu G,He M,et al.Increased insulin receptor expression in anterior temporal neocortex of patients with intractable epilepsy[J].J Neurol Sci,2010,296(1/2):64-68.
[15]Truong-Tran AQ,Carter J,Ruffin RE,et al.The role of zinc in caspase activation and apoptotic cell death[J].Biometals,2001,14(3/4):315-330.
[16]Zhou Z,Wang L,Song Z,et al.Zinc supplementation prevents alcoholic liver injury in mice through attenuation of oxidative stress[J].Am J Pathol,2005,166(6):1681-1690.
[17]Hauer J,Püschner S,Ramakrishnan P,et al.TNF receptor(TNFR)-associated factor(TRAF)3serves as an inhibitor of TRAF2/5-mediated activation of the noncanonical NF-kappaB pathway by TRAF-binding TNFRs[J].Proc Natl Acad Sci U S A,2005,102(8):2874-2879.
[18]Mao AP,Li S,Zhong B,et al.Virus-triggered ubiquitination of TRAF3/6by cIAP1/2is essential for induction of interferon-beta(IFN-beta)and cellular antiviral response[J].J Biol Chem,2010,285(13):9470-9476.
[19]Pirity MK,Wang WL,Wolf LV,et al.Rybp,apolycomb complex-associated protein,is required for mouse eye development[J].BMC Dev Biol,2007,7:39.
[20]Collart MA,Timmers HT.The eukaryotic Ccr4-not complex:a regulatory platform integrating mRNA metabolism with cellular signaling pathways[J].Prog Nucleic Acid Res Mol Biol,2004,77:289-322.
[21]Albert TK,Hanzawa H,Legtenberg YI,et al.Identification of a ubiquitin-protein ligase subunit within the CCR4-NOT transcription repressor complex[J].EMBO J,2002,21(3):355-364.
[22]Mulder KW,Brenkman AB,Inagaki A,et al.Regulation of histone H3K4tri-methylation and PAF complex recruitment by the Ccr4-Not complex[J].Nucleic Acids Res,2007,35(7):2428-2439.
[23]Zhao Y,Bruemmer D.NR4Aorphan nuclear receptors:transcriptional regulators of gene expression in metabolism and vascular biology[J].Arterioscler Thromb Vasc Biol,2010,30(8):1535-1541.
[24]Neira JL,Román-Trufero M,Contreras LM,et al.The transcriptional repressor RYBP is a natively unfolded protein which folds upon binding to DNA[J].Biochemistry,2009,48(6):1348-1360.
[25]Ianzano L,Zhang J,Chan EM,et al.Lafora progressive Myoclonus Epilepsy mutation database-EPM2Aand NHLRC1(EPM2B)genes[J].Hum Mutat,2005,26(4):397.
[26]Espinosa-Parrilla Y,Encha-Razavi F,Attié-Bitach T,et al.Molecular screening of the ZFHX1Bgene in prenatally diagnosed isolated agenesis of the corpus callosum[J].Prenat Diagn,2004,24(4):298-301.
[27]Lower KM,Turner G,Kerr BA,et al.Mutations in PHF6 are associated with Börjeson-Forssman-Lehmann syndrome[J].Nat Genet,2002,32(4):661-665.

