STC1及钙、磷离子在氟中毒致大鼠肾损伤中的作用
张永春,吴小候△,罗春丽
(1.重庆医科大学附属第一医院泌尿外科 400016;2.重庆医科大学检验系 400016)
肾脏是机体排氟最主要的脏器,也一直是氟中毒非骨相系统研究的热点,但其损伤机制仍未阐明。钙、磷离子的正常代谢对肾脏功能的正常运行非常重要,钙、磷离子相关的调控蛋白失稳态与钙、磷离子相关的信号调节蛋白功能失调是氟中毒损伤机制中重要的组成部分[1-2]。因此,本课题选择调控钙、磷代谢的斯钙素蛋白1(stanniocalcin 1,STC1)作为研究靶点,以Sprague-Dawley(SD)雄性大鼠作为研究对象,观察氟中毒大鼠肾损伤时肾组织STC1及钙、磷离子的变化,并探讨其机制。
1 材料与方法
1.1 主要试剂与仪器 氟化钠分析纯为北京化工厂产品,人抗鼠STC1抗体购自武汉博士德生物工程有限公司,胰蛋白酶、逆 转 录 聚 合 酶 链 反 应 (reverse transcriptase-polymerase chain reaction,RT-PCR)试剂盒为Gibco公司产品,总RNA抽提试剂Trizol购自上海申能博彩生物科技有限公司,STC1与甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物由北京赛百盛公司合成;主要仪器包括:低温离心机(Sigma 3-18k)、PCR 仪(Astec PC808)、凝胶成像分析系统(Syngene)及酶标仪(Bio-RAD model450)等。
1.2 实验动物与分组 24只SD雄性大鼠购自贵阳医学院实验动物中心,合格证号:SCXK(黔)2002-0001,体质量约80~100g,将其分为4组,每组6只,采用腹腔注射氟化钠溶液(按体质量比例)的方式为大鼠染氟。(1)对照组,注射生理盐水;(2)低氟组,注射氟化钠溶液5mg/kg;(3)中氟组,注射氟化钠溶液10mg/kg;(4)高氟组,注射氟化钠溶液20mg/kg。注射频次为每48h注射1次,自由进食鼠饵,饮用蒸馏水,建模周期为16周。采用股动脉放血法处死大鼠,左肾固定包埋,右肾迅速置于-80℃低温保存,待用。
1.3 检测指标与方法
1.3.1 肾组织STC1蛋白的检测 大鼠左肾经4%中性甲醛固定,石蜡包埋,切片(厚4μm),脱蜡,用新鲜配置的3%过氧化氢灭活内源性过氧化氢酶15min,微波炉加热15min进行修复抗原,自然冷却。采用第一抗体(人抗鼠STC1抗体)、第二抗体(羊抗人IgG)、链霉素抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)溶液进行免疫组织化学检测、用二氨基联苯胺(3,3′-diaminobenzidine,DAB)显色3~5min,苏木素复染、脱水、透明,中性树胶封片,显微镜下观察,对氟中毒大鼠肾组织STC1蛋白表达进行分析和定位。免疫组织化学检查结果根据染色阳性细胞数和染色强度分别评分,以随机200倍视野5个阳性细胞数所占百分比计分:≤5%为0分,>5%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。染色强度:无染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。染色阳性细胞数和染色强度分值的乘积大于1分者为阳性,≤1分者为阴性。每个标本镜下随机选取5个视野,读取阳性细胞数,将其与该镜下细胞总数相比,计算阳性表达细胞所占百分比作为阳性率。
1.3.2 肾组织STC1mRNA的检测 将低温保存的24例右侧肾脏缓慢复温,在肾脏中部横断面剖开,取组织约50mg,按Trizol试剂说明书提取总RNA。cDNA第一链的合成(反转录):所有标本各取5μg RNA,65℃预变性5min后,根据RTPCR试剂盒说明书进行cDNA第一链的合成。STC1引物:上游5′-ATG CTC CAA AAC TCA GCA GTG AT-3′,下游5′-GGG AGA GTC CCC CTC ACC TCG GAG GT-3′;β-actin引物:上游5′-ATG GAT GAC GAT ATC GCT GCG CT-3′,下游5′-CTC AAA CAT GAT CTG GGT CAT CTT TTC A-3′。PCR扩增参数:95℃预变性5min后,95℃变性30s,60℃退火40s,72℃延伸30s,共35个循环;最后72℃延伸5min。PCR产物用2%琼脂糖凝胶鉴定,80V电泳40min,用凝胶成像系统扫描并记录结果,以肉眼明确判定有226bp条带为阳性标准。
1.3.3 肾组织钙、磷含量的检测 将24例右侧肾脏缓慢复温,每例取0.5g,加入混合酸(HNO3∶HClO4=4∶1)6~10mL,冷消解24h后,放于电流板上加热消化,于组织溶解液中加入混合酸并加热,以产生较多白烟为终点。钙含量使用原子吸收分光光度计分析,磷含量使用钼兰比色法分析。
1.4 统计学处理 应用SPSS13.0软件进行统计学分析,计量数据用±s表示,组间比较采用t检验及方差分析,率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 染毒大鼠肾组织STC1蛋白的表达 对照组大鼠肾组织中偶可见STC1蛋白的表达,但表达强度和数量很少。3个实验组均可见到不同程度的STC1蛋白表达,且随着染氟浓度的增加,STC1蛋白的阳性表达强度和数量增加,STC1蛋白的表达主要定位于肾脏皮髓交界的近曲小管,见图1、表1。在高氟组大鼠中有2例发现远曲小管有少量表达,但为了回避假阳性和统计分析的定位统一性,未予列举和分析。
2.2 染氟大鼠肾组织中STC1mRNA的表达 RT-PCR检测结果显示,3个染氟组大鼠肾组织中STC1mRNA的表达水平均明显高于对照组(P<0.05),染氟组大鼠肾组织中STC1 mRNA的表达随着染氟剂量的增加而增强(P<0.05)。见图2、表2。

图1 各组大鼠肾脏STC1蛋白的表达(免疫组织化学)

表1 各组大鼠肾组织STC1蛋白的表达
2.3 染氟大鼠肾组织的钙、磷含量 各染氟组大鼠肾组织中钙含量均比对照组增加(P<0.05),且随着染氟剂量的递增,钙含量也显著升高。磷含量在各染氟组大鼠肾组织中表现不同,低氟组及高氟组大鼠肾组织磷含量明显低于对照组(P<0.05),而中氟组大鼠肾组织磷含量较低氟组及高氟组高(P<0.05),且与对照组比较,没有显著降低(P>0.05)。见表3。
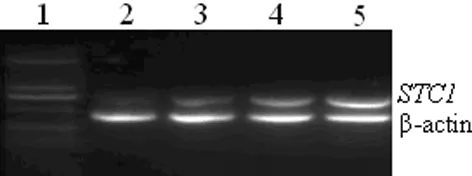
图2 STC1及β-actin mRNA的RT-PCR电泳图
表2 各组大鼠肾组织STC1mRNA的表达(±s)

表2 各组大鼠肾组织STC1mRNA的表达(±s)
组别 n 灰度值对照组6 0.51±0.36低氟组 6 1.89±1.75中氟组 6 3.23±1.19高氟组6 4.62±2.11
表3 各组大鼠肾组织的钙、磷含量(±s,μg/g)

表3 各组大鼠肾组织的钙、磷含量(±s,μg/g)
*:P<0.05,#:P>0.05,与对照组比较;△:P<0.05,与中氟组比较。
组别 n 钙含量 磷含量对照组6 55.2±3.31 2.32±0.12低氟组 6 69.7±5.27* 1.87±0.11*△中氟组 6 93.4±2.52* 2.29±0.19#高氟组 6 114.8±9.63* 1.79±0.26*△
3 讨 论
STC1是一种作用于线粒体的糖蛋白激素,最初仅在硬骨鱼和软骨鱼中发现,1995年 Wagner等[3]用鲑鱼的STC抗血清证明人类同样存在STC。在哺乳动物中,STC1多定位于肾脏、前列腺、卵巢及甲状腺组织。在大鼠肾脏中,STC1主要表达于近曲小管[4],其主要功能是调节肾脏的钙、磷离子代谢[5],并与肿瘤细胞的凋亡有关,哺乳动物肾组织STC1蛋白的表达会受细胞外钙离子浓度及1,25-二羟维生素 D3的影响[6-7],目前其生理功能尚未完全阐明。鉴于STC1具有调节肾脏钙、磷代谢的功能,本实验将其引入作为氟中毒肾损伤的研究靶点,从实验结果来看,随着染氟剂量的增加,STC1蛋白和mRNA的表达逐渐增加,并且其增加的幅度具有显著性;STC1蛋白主要定位于肾脏皮髓交界的肾小管上皮细胞。
钙、磷离子及相关蛋白的含量和功能失衡一直是氟中毒研究领域的一项重要内容,早在1948年国外学者就发现了氟中毒与钙元素的关系,长时间接触氟会导致人体钙离子代谢平衡失调,有研究指出钙在氟中毒的细胞损伤机制中发挥重要作用[1]。钙离子在细胞内、外信号转导机制中发挥触发点和调节剂的作用,协调、整合不同类型细胞的信号转导功能[8]。而氟中毒会影响不同类型细胞的钙离子含量,且这种改变与钙离子受体、钙调蛋白、钙泵及钙离子通道等密切相关[2]。
有人发现慢性氟中毒可造成大鼠肾脏各种细胞膜钙泵相关蛋白的减少[9],但也有研究发现,氟中毒可使肾小管上皮细胞钙离子相关蛋白表达水平增高[10],后继研究表明G蛋白途径可能是上述改变的机制之一[11]。相似的矛盾现象在心肌网状组织中也有发现,即氟既可以抑制心肌网状组织钙泵,又可刺激钙泵的功能和表达,这种不同的改变可能取决于钙泵处于何种易感状态[12]。由于高尔基体和过氧化物酶体与钙离子关系密切,所以有学者指出,不同类型组织氟中毒损伤后钙离子相关蛋白的改变应考虑高尔基体和过氧化物酶体的改变状态和反应途径[13]。
钙、磷在代谢平衡中是相互关联的,特别是在维持肾脏的正常生理功能方面[14]。目前,对氟中毒损伤机制中磷元素变化的研究并不多,1995年曾有学者对氟中毒过程中钠、磷代谢的改变进行研究,发现氟中毒会导致磷元素含量改变,相关信号转导蛋白功能失调[15]。慢性氟中毒会导致 Na+-K+-ATP酶的损伤和表达失调,使磷离子的功能失常,影响细胞信号转导功能[16],氟中毒的这种影响在肾小管上皮细胞、肾脏髓袢升枝粗段细胞中也有发现[17-18]。
本实验对氟中毒大鼠肾组织中钙、磷离子的含量进行了检测,钙离子含量随着染氟剂量的增加而升高,符合氟中毒钙矛盾性疾病的学说。但磷离子的改变却没有规律,中氟组出现了磷离子含量的回升,这种改变经过重复钙、磷检测均未获得扭转,这从另一个角度提示磷离子在氟中毒肾损伤中的改变可能与相关基因、蛋白的易感状态有关,这为下一步的深入研究指出新的途径。STC1的功能主要是调节钙、磷代谢,其本身也受到钙离子浓度的调控。在本研究中,STC1的表达上调是否由钙离子引起或是氟中毒直接造成,还需从基因层面进行研究,探讨STC1是否作为氟中毒损伤机制中的一个环节,以揭示氟中毒发生机制,防控氟中毒疾病。
[1] Ba Y,Zhu JY,Yang YJ,et al.Serum calciotropic hormone levels,and dental fluorisis in children exposed to different concentrations of fluoride and iodine in drinking water[J].Chin Med J(Engl),2010,123(6):675-679.
[2] Das TK,Susheela AK.Effect of long-term administration of sodium fluoride on plasma calcium level in relation to intestinal absorption and urinary excretion in rabbits[J].Environ Res,1993,62(1):14-18.
[3] Wagner GF,Guiraudon CC,Milliken C,et al.Immunological and biological evidence for a stanniocalcin-like hormone in human kidney[J].Proc Natl Acad Sci USA,1995,92(6):1871-1875.
[4] Olsen HS,Cepeda MA,Zhang QQ,et al.Human stanniocalcin:apossible hormonal regulator of mineral metabolism[J].Proc Natl Acad Sci USA,1996,93(5):1792-1796.
[5] Luo CW,Kawamura K,Klein C,et al.Paracrine regulation of ovarian granulosa cell differentiation by stanniocalcin(STC)1:mediation through specific STC1receptors[J].Mol Endocrinol,2004,18(8):2085-2096.
[6] Ookata K,Tojo A,Onozato ML,et al.Distribution of stanniocalcin 1in rat kidney and its regulation by vitamin D3[J].Exp Nephrol,2001,9(6):428-435.
[7] Sheikh-Hamad D,Rouse D,Yang Y.Regulation of stanniocalcin in MDCK cells by hypertonicity and extracellular calcium[J].Am J Physiol Renal Physiol,2000,278(3):F417-424.
[8] Berridge MJ,Lipp P,Bootman MD.The versatility and universality of calcium signalling[J].Nat Rev Mol Cell Biol,2000,1(1):11-21.
[9] Borke JL,Whitford GM.Chronic fluoride ingestion decreases 45Ca uptake by rat kidney membranes[J].J Nutr,1999,129(6):1209-1213.
[10]Dominguez JH,Garcia JG,Rothrock JK,et al.Fluo ride mobilizes intracellular calcium and promotes Ca2+influx in rat proximal tubules[J].Am J Physiol,1991,261(2Pt 2):F318-327.
[11]Hughes BP,Barritt GJ.The stimulation by sodium fluoride of plasma-membrane Ca2+inflow in isolated hepatocytes.Evidence that a GTP-binding regulatory protein is involved in the hormonal stimulation of of Ca2+inflow[J].Biochem J,1987,245(1):41-47.
[12]Narayanan N,Su N,Bedard P.Inhibitory and stimulatory effects of fluoride on the calcium pump of cardiac sarcoplasmic reticulum[J].Biochim Biophys Acta,1991,1070(1):83-91.
[13]Davies SA,Terhzaz S.Organellar calcium signalling mechanisms in Drosophila epithelial function[J].J Exp Biol,2009,212(Pt 3):387-400.
[14]Caverzasio J,Bonjour JP.Characteristics and regulation of Pi transport in osteogenic cells for bone metabolism[J].Kidney Int,1996,49(4):975-980.
[15]Peerce BE.Effect of substrates and pH on the intestinal Na+/phosphate cotransporter:evidence for an intervesicular divalent phosphate allosteric regulatory site[J].Bio-chim Biophys Acta,1995,1239(1):1-10.
[16]Murphy AJ,Hoover JC.Inhibition of the Na,K-ATPase by fluoride.Parallels with its inhibition of the sarcoplasmic reticulum CaATPase[J].J Biol Chem,1992,267(24):16995-17000.
[17]Suketa Y,Suzuki K,Taki T,et al.Effect of fluoride on the activities of the Na+/glucose cotransporter and Na+/K(+)-ATPase in brush border and basolateral membranes of rat kidney(in vitro and in vivo)[J].Biol Pharm Bull,1995,18(2):273-278.
[18]Cittanova ML,Estepa L,Bourbouze R,et al.Fluoride ion toxicity in rabbit kidney thick ascending limb cells[J].Eur J Anaesthesiol,2002,19(5):341-349.

