系统性炎症反应综合征患者血浆D-二聚体与细胞因子动态变化的研究*
龙 鼎,喻 莉,武晓灵
(湖北省武汉市中心医院重症医学科 430014)
系统性炎症反应综合征(systemic inflammatory response syndrome,SIRS)是危重病医学最常见的临床综合征之一,其显著特点是炎症介质、细胞因子的失控性释放。多种炎症介质、细胞因子可以直接或间接激活凝血系统及干扰机体的抗凝系统,从而导致机体凝血功能的失调[1-2]。本研究检测不同程度SIRS患者血浆 D-二聚体、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)的含量,观察其动态变化,探讨SIRS患者血浆D-二聚体与IL-6、TNF-α之间的关系及其与病情严重程度、预后的联系。
1 资料与方法
1.1 一般资料 选择30例近期无感染表现的来本院体检的健康人,将其作为对照组,其中,男15例,女15例;平均年龄(63.87±4.06)岁。选择2008年1月至2010年1月于本院普通内科住院的无感染、无SIRS表现的患者35例,将其作为非SIRS组,其中,男17例,女18例;平均年龄(65.69±7.90)岁;原发疾病:原发性高血压6例,心律失常5例,心绞痛5例,糖尿病6例,消化性溃疡6例,胃癌3例,脑梗死4例。选择2008年1月至2010年1月在本科住院的SIRS患者50例,将其作为SIRS组,其中,男26例,女24例,平均年龄(66.20±7.90)岁;其诊断符合1991年美国胸科医师协会和危重病医学会制定的SIRS诊断标准[3];原发疾病:多发性创伤15例,慢性支气管炎伴感染12例,外科手术后10例,急性胰腺炎6例,有机磷农药中毒4例,脑梗死3例。依据多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的诊断标准[4],将所有SIRS组患者按是否发生MODS分为单纯SIRS组(n=26)和 M ODS组(n=24);按预后分为存活组(n=35)和死亡组(n=15)。排除标准:(1)年龄小于18岁的孕产妇;(2)恶性肿瘤;(3)转入重症监护病房(intensive care unit,ICU)后7d内死亡;(4)心肺复苏术后;(5)既往无血液系统疾病;(6)入住ICU时即有SIRS的患者。
1.2 方法 对照组患者于体检时、非SIRS组患者于入院当天抽取静脉血,均按照急性生理功能和慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)进行评分。所有SIRS组患者于SIRS发生后的第1、3、5、7天进行APACHEⅡ评分,并抽取静脉血。采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法,用罗氏诊断公司试剂盒检测血浆D-二聚体;TNF-α、IL-6采用上海太阳生物技术公司试剂盒检测,首先将静脉血用枸橼酸钠抗凝、轻摇、分离血浆和红细胞,保存于-70℃冰箱,以双抗体夹心抗生物素蛋白-生物素-过氧化物酶复合物(avidin-biotin-peroxidase complex,ABC)-ELISA法及相应试剂盒检测,美国伯乐550酶标仪测定 T NF-α、IL-6的血浆浓度。
1.3 统计学处理 应用SPSS17.0软件进行统计学分析,计量数据用±s表示,组间比较采用独立样本t检验,相关分析应用Pearson相关系数法,以P<0.05为差异有统计学意义。
2 结 果
2.1 对照组、非SIRS组、单纯SIRS组及 MODS组患者APACHEⅡ评分、D-二聚体、IL-6、TNF-α的比较 对照组、非SIRS组、单纯SIRS组及MODS组患者年龄和性别差异均无统计学意义(P>0.05)。MODS组患者APACHEⅡ评分为(21.96±4.18)分,显著高于单纯SIRS组[(19.00±3.51)分]、非SIRS组[(13.97±2.22)分]和对照组[(6.63±1.10)分](P<0.01)。MODS组和单纯SIRS组患者血浆D-二聚体的差异无统计学意义(P>0.05),但明显高于对照组及非SIRS组(P<0.01)。MODS组和单纯SIRS组患者血浆IL-6、TNF-α含量比较,差异有统计学意义(P<0.01),且两组患者血浆IL-6、TNF-α含量均明显高于非SIRS组和对照组(P<0.01)。见图1。
2.2 存活组与死亡组患者 APACHEⅡ评分、D-二聚体、IL-6及TNF-α的比较 SIRS发生后第3天与第1天比较,存活组与死亡组患者APACHEⅡ评分均下降(P<0.01),SIRS发生后第5天和第7天死亡组患者APACHEⅡ评分均呈现上升趋势,而存活组患者APACHEⅡ评分一直较死亡组低(P<0.01)。SIRS发生后第3天与第1天比较,存活组与死亡组患者血浆D-二聚体含量差异无统计学意义(P>0.05),SIRS发生后第5、7天,死亡组患者血浆D-二聚体含量明显高于存活组(P<0.05)。SIRS发生后第1、3、5、7天,存活组与死亡组患者血浆IL-6和TNF-α含量比较,差异有统计学意义(P<0.01)。见图2。
2.3 SIRS患者血浆D-二聚体含量与APACHEⅡ评分、IL-6、TNF-α的相关性分析 SIRS患者血浆D-二聚体含量与APACHEⅡ评分、IL-6、TNF-α呈正相关,见表1。

图1 各组患者 APACHEⅡ评分、D-二聚体、IL-6、TNF-α的比较
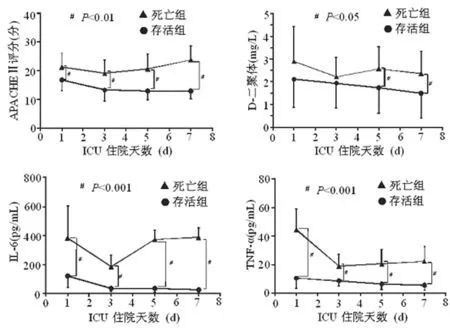
图2 死亡组和存活组患者APACHEⅡ评分、D-二聚体、IL-6、TNF-α的比较

表1 D-二聚体与 APACHEⅡ评分、IL-6、TNF-α的相关性
3 讨 论
MODS是危重患者死亡的主要原因,研究发现几乎所有MODS患者在疾病发展过程中都出现了SIRS[4]。发生SIRS时,机体炎症细胞过度激活,失控性释放大量细胞因子,如IL-6、IL-8、TNF-α等[5-6],继而发展为 MODS,本研究进一步证实了这一过程。SIRS时,患者血浆IL-6、TNF-α均明显高于对照组和非SIRS组患者(P<0.01)。SIRS合并MODS时,患者血浆IL-6、TNF-α水平进一步升高,MODS组患者血浆IL-6、TNF-α水平明显高于单纯SIRS组;死亡组患者血浆IL-6、TNF-α水平明显高于存活组。随着时间推移和病情的变化,存活组患者血浆IL-6、TNF-α水平呈逐渐下降趋势,而死亡组患者血浆IL-6、TNF-α水平虽有所下降,但仍保持高水平,无法降至正常范围,在SIRS发生后第5、7天又出现上升趋势,且血浆IL-6水平在第7天出现的差异性较前更加明显。这表明这些细胞因子在SIRS的发生、发展过程中起着非常重要的作用,持续高浓度的IL-6、TNF-α提示患者预后不良。研究证明全身性感染患者血浆IL-6水平与疾病严重程度相关,IL-6可用于评价SIRS和 MODS的程度,可作为其监测指标[7-8]。
在SIRS时,过度释放的细胞因子通过多种途径激活凝血系统,形成复杂的炎症介质、细胞因子、补体网络的反应体[9-10],严重者可导致弥散性血管内凝血(disseminated or diffuse intravascular coagulation,DIC)。D-二聚体是血浆交联纤维蛋白原被纤维蛋白酶降解的特异性标记物,现已被公认为是反映纤维蛋白溶解、降解程度的重要指标之一[11],也是目前诊断DIC前期最有价值的指标之一。作者发现SIRS组患者血浆D-二聚体水平明显高于非SIRS组和对照组,说明SIRS患者存在凝血和纤维蛋白溶解紊乱的现象,继发的纤维蛋白溶解系统活化在SIRS发生、发展的病理生理中起着重要作用。而且随着MODS的出现,血浆D-二聚体水平进一步升高,但在本研究中单纯SIRS组和MODS组患者血浆D-二聚体水平没有明显差异,这可能与样本量不足有关,有多项报道证实患者发生 MODS时,血浆D-二聚体水平显著升高[12-13]。但随着病情进展,死亡组与存活组比较,SIRS发生后第5、7天患者血浆D-二聚体水平出现明显差异,这提示凝血功能紊乱与SIRS病情严重程度密切相关,死亡组患者凝血系统被激活的程度较存活组高,微循环障碍更严重,这增加了患者的病死率。这一结果与以往的报道基本一致[14]。本研究发现血浆D-二聚体水平和APACHEⅡ评分呈正相关,这也与上述观点一致。
TNF-α是诱导细胞反应的最初炎症因子,具有广泛生物学效应,在细胞和亚细胞水平激发一系列“瀑布效应”,诱导IL-1β、IL-6等多种炎症因子作用于内皮细胞,增加毛细血管通透性,并导致局部缺血和血栓形成[15]。有学者认为,“凝血瀑布”被激活与凝血功能紊乱的起始因素是细胞因子[4]。作者观察到SIRS患者血浆D-二聚体水平与IL-6、TNF-α水平呈正相关,说明IL-6、TNF-α在微循环障碍中扮演了重要角色。有人认为D-二聚体水平明显升高,一方面反映体内纤维蛋白水平较高,易形成血栓;另一方面提示D-二聚体过多,可促进局部炎症细胞,特别是单核细胞合成并释放某些细胞因子,导致凝血亢进,加重血栓形成倾向,加剧微循环障碍,使病情恶化[16]。
综上所述,作者认为在SIRS患者中广泛存在凝血功能紊乱及微循环障碍,IL-6、TNF-α参与了此过程,并与疾病严重程度有关。动态监测血浆D-二聚体、IL-6、TNF-α的变化可灵敏地反映SIRS患者的病情严重程度、凝血功能及微循环状况,对判断预后也有一定价值。
[1] Asakura H,Wada H,Okamoto K,et al.Evaluation of haemostatic molecular markers for diagnosis of disseminated intravascular coagulation in patients with infections[J].Thromb Haemost,2006,95(2):282-287.
[2] Nielsen JS,Larsson A,Rix T,et al.The effect of activated protein C on plasma cytokine levels in a porcine model of acute endotoxemia[J].Intensive Care Med,2007,33(6):1085-1093.
[3] American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference:definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J].Crit Care Med,1992,20(6):864-874.
[4] 王可富,田锁臣.多器官功能障碍综合征[M].北京:人民卫生出版社,2007:13-23.
[5] 虎晓岷,尹文,宋祖军,等.危重病患者多器官功能障碍综合征细胞因子变化的意义[J].中国急救医学,2001,21(12):683-685.
[6] 方步武,邱奇,崔乃强,等.急腹症全身炎症反应综合征阶段细胞因子及炎症介质的变化特点[J].中国危重病急救医学,2001,13(9):542-544.
[7] Stenvinkel P,Heimbürger O,Jogestrand T.Elevated interleukin-6predicts progressive carotid artery atherosclerosis in dialysis patients:association with Chlamydia pneumoniae seropositivity[J].Am J Kidney Dis,2002,39(2):274-282.
[8] 谭佩仪,吴沃栋,许耘红.D-二聚体及与纤溶酶原激活物抑制剂-1比值评价合并糖耐量减低急性冠状动脉综合征患者纤溶受抑的研究[J].中国危重病急救医学,2003,15(8):472-475.
[9] Münzel T,Sinning C,Post F,et al.Pathophysiology,diagnosis and prognostic implications of endothelial dysfunction[J].Ann Med,2008,40(3):180-196.
[10]Herzum I,Renz H.Inflammatory markers in SIRS,sepsis and septic shock[J].Curr Med Chem,2008,15(6):581-587.
[11]Lowe GD.How to search for the role and prevalence of defective fibrinolytic states as triggers of myocardial infarction?The haemostasis epidemiologist′s view[J].Ital Heart J,2001,2(9):656-657.
[12]丁欢,马希刚,马玉杰,等.脓毒症患者血浆抗凝血酶Ⅲ及D-二聚体与SOFA评分的相关性研究[J].中国实用内科杂志,2008,28(2):113-115.
[13]黄顺伟,管向东.重症脓毒症患者动态监测血乳酸及D-二聚体的临床研究[J].中国呼吸与危重监护杂志,2009,8(5):492-494.
[14]Querol-Ribelles JM,Tenias JM,Grau E,et al.Plasma ddimer levels correlate with outcomes in patients with community-acquired pneumonia[J].Chest,2004,126(4):1087-1092.
[15]Bhatia M,Moochhala S.Role of inflammatory mediators in the pathophysiology of acute respiratory distress syn-drome[J].J Pathol,2004,202(2):145-156.
[16]Radenkovic D,Bajec D,Karamarkovic A,et al.Disorders of hemostasis during the surgical management of severe necrotizing pancreatitis[J].Pancreas,2004,29(2):152-156.

