人TIM-1和TIM-3mRNA实时SYBR GreenⅠ定量RT-PCR检测方法的建立
陈治中,卿吉琳,覃桂芳,胡丽华
(1.华中科技大学同济医学院附属协和医院 检验科,湖北 武汉430022;2.广西壮族自治区人民医院 检验科,广西 南宁530021;3.广西壮族自治区人民医院 妇科,广西 南宁530021)
最近一个新的T细胞表面受体家族-T淋巴细胞免疫球蛋白黏蛋白 (T cell immunoglobulin mucin)家族已经引起广大研究者的兴趣[1,2]。研究表明TIM家族与多种疾病如自身免疫病、哮喘等发病机制相关[2-4]。最新研究表明TIM基因家族可能是PS的一个新的受体家族,与PS结合介导凋亡细胞的识别与清除[5]。人TIM家族蛋白属于I型膜蛋白,由 TIM-1、TIM-3和 TIM-4组成。研究表明TIM-1优先表达于人和鼠的Th2细胞表面,而TIM-3偏爱表达于人和鼠的Th1细胞表面,并且它们分别调节Th1与Th2细胞的免疫应答,可能对维持体内的Th1/Th2间的平衡起重要作用[2,6]。
通过对机体TIM-1和TIM-3mRNA表达水平的检测,我们可以对机体内Th1与Th2细胞状况作一分析,从而对机体免疫系统的活化程度进行初步评价。目前,检测mRNA的方法有多种,由于实时荧光定量逆转录聚合酶链反应(Real-time quantitative,fluorescence-based reverse transcription polymerase chain reaction,real-time RT-PCR)具有高度敏感性、准确度高、动态监测和高通量等特点,已经在科研和临床中得到广泛应用,成为目前直接检测机 体 mRNA 水 平 的 一 个 主 流 方 法[7,8]。SYBR Green I是荧光定量PCR最常用的DNA结合染料,与双链 DNA(dsDNA)非特异性结合[7]。与TaqMan探针比较具有设计简单、低成本和能够进行熔点曲线分析检验扩增反应的特异性等优点[7,9]。因此,本研究旨在建立人 TIM-1和 TIM-3 mRNA实时 SYBR Green I定量 RT-PCR 检测方法,为研究组织和细胞中的TIM-1和TIM-3mRNA的表达变化和它们在免疫调控中的作用提供一个技术平台。
1 材料与方法
1.1 引物设计和合成
应用生物信息学知识,从Genbank中查阅出人TIM-1和TIM-3基因mRNA序列,根据引物设计原则,并利用Primer5.0设计软件,自行设计人TIM-1和TIM-3基因克隆引物和 mRNA扩增引物,并由上海生物工程有限公司合成。
1.2 外周血单个核细胞(PBMC)的获取及总RNA的提取与逆转录
采用Ficoll法外周血单个核细胞。依据Trizol试剂(Invitrogen)说明书提取总mRNA。人TIM基因的cDNA文库按照逆转录说明书(Takara)合成。
1.3 PCR扩增及纯化
用 TIM-1 基 因 的 克 隆 引 物,KTIM-1PF:5-CTAGCTAGCGCCACCATGCATCCTCAAGTGG TCATCT-3(含 Nhe I 位 点 )与 KTIM-1PR:5-GGGGTACCTTAGTCCGTGGCATAAAGACTA TTC-3(含 Kpn I位点);用 TIM-3基因的克隆引物, KTIM-3PF: 5-CCGCTCGAGGCCACCATGTTTTCACATCTTCCCTTTGAC-3(含 Xho I位点)与 KTIM-3PR:5-GGGGTACCGTTGGCATTGCAAAGCGACA-3(含 Kpn I位点),按 Prime-STAR HS DNA 聚合酶(Takara)说明书分别扩增人TIM-1和TIM-3全长片段,退火温度为60℃。扩增产物分别按。按DNA纯化回收试剂盒(天根,中国)使用说明书纯化PCR产物。然后分别按加A反应试剂盒(Takara)说明书进行加A反应。
1.4 cDNA目的片段克隆
按照pMD18-T Simple载体说明书(Takara),连接上述人TIM-1和TIM-3加A的片段。并转化感受态 DH5α(天根,中国),在含有 X-Gal、IPTG、Amp的L-琼脂平板培养基上培养,按蓝白斑实验挑选几个白色菌落,并用PCR菌液PCR证实。将PCR阳性菌液送上海生物工程有限公司测序证实。
1.5 重组质粒浓度测定及标准曲线的建立
采用质粒提取试剂盒(天根,中国)提纯质粒,测定OD260/OD280分析纯度,备用。根据重组质粒提取物OD260nm吸光度,并通过如下公式计算纯化产物原液的浓度。并按下面公式计算:
DNA 模板浓度(copies/μl)=[A260×0.05×10-6g/μl×50 (稀释倍数)/(660g/mol×碱基对数)]×6.02×1023。其中,1OD260=0.05g/L 双链DNA;1对碱基平均分子量=660g/mol;TIM-1重组质粒3 810bp,TIM-3重组质粒3 620bp;6.02×1023为阿佛加德罗常数。
将备用的人TIM-1和TIM-3的质粒制备成1010copies/μl数量级的溶液作为标准品原液,贮于-80℃。将重组质粒标准品原液10倍梯度稀释成1010-100copies/μl数量级的标准品,取107-103copies/μl数量级的标准品进行人 TIM-1和 TIM-3的实时荧光定量PCR检测,每个样品3次重复,根据临界循环数(Threshold cycle,Ct)以及模板起始拷贝数制作标准曲线和标准方程。
1.6 实时荧光定量PCR检测
在Lightcycler荧光PCR仪 (瑞士Roche公司)上扩增并检测荧光。用TIM-1基因的mRNA引物 MTIM-1FP:5-AACTGTCTCTACCTTTGTTCCTCC-3 与 MTIM-1FR:5-GTTCTCTCCTTATTGCTCCCTG-3,用 TIM-3基因的 mRNA 引物 MTIM-3FP:5-CAGATACTGGCTAAATGGGGAT-3 与 MTIM-3FR:5-ACCTTGGCTGGTTTGATGAC-3扩增。Real-time PCR 反应体系:10×PCR缓 冲 液 2μl,25mmol/L Mg2+3.5μl,10 mmol/L dNTPs 0.4μl,10μmol/L引物各0.5μl,普通 Taq DNA 聚合酶 1U(1U/μl),质粒 DNA 1 μl,BSA(1mg/ml)2μl,SYBR Green I(20×)1 μl,灭菌 H2O 8.1μl.空白对照管加1.0μl灭菌DEPC水代替质粒DNA,盖上盖后瞬间离心,使样品聚集在毛细管底部,然后上机扩增。扩增条件为:94℃2min,然后循环(94℃10sec;59℃(TIM-1)或者60℃(TIM-3)15sec;72℃15sec)40次,再分别进行荧光检测,并做熔解曲线对PCR产物的特异性进行鉴定,最后反应冷却至40℃。
1.7 重复性与精密度的测定
将1.0×105copies/μl的标准品平行操作8次或在8d内分别测定,获取其批内与批间变异系数(CV)。
2 结果
2.1 人TIM-1和TIM-3基因片段的扩增与重组质粒的构建
采用特异性引物,以cDNA为模板进行PCR扩增,获得了与各自预期片段大小一致目的条带。对构建的重组质粒进行PCR和酶切鉴定,与预期结果一致(见图1)。重组质粒DNA的测序结果表明,插入片段与原始片段的序列同源性为100%。

图1 人TIM-1和TIM-3基因T载体双酶切。1:TIM-3基因T载体XhoI/KpnI双酶切;2:TIM-3基因T载体NheI/KpnI双酶切;M:DNA Marker
2.2 人TIM-1和TIM-3Real-time RT-PCR标准曲线的建立
将含有目的基因片段的重组质粒进行10倍系列稀释5个梯度(103-107拷贝/μl),进行 Real-time RT-PCR 扩增,获得 TIM-1和 TIM-3的 Real-time RT-PCR标准曲线和直线回归方程。标准曲线图显示,起始模板浓度与Ct值之间呈良好的线性关系;TIM-1和TIM-3标准曲线的线性回归分析表明,相关系数 (Coefficient of correlation,r)分别为1.00和1.00,直线回归方程分别为:TIM-1,y=-3.165x+37.56,误差(error)=0.0724,Efficiency E:E=10-1/slope-1=1.070;TIM-3,y=-3.268x+37.55,误差(error)=0.0452,Efficiency E:E=10-1/slope-1=1.023。由此推测试验的过程和数据是非常可信的,可用于待测样本初始模板含量的测定。
2.3 人TIM-1和TIM-3Real-time RT-PCR熔解曲线的分析
熔解曲线分析确认人TIM-1和TIM-3基因PCR产物的特异性。人TIM-1和TIM-3基因特异性产物都呈单一的荧光峰。峰值之前曲线平滑,未见其他明显的非特异性荧光峰,可反映出扩增产物的特异性强。人TIM-1和TIM-3各自的熔解温度(Tm)分别约为87℃和84.5℃。特异性产物经过2.5%的凝胶电泳,证实扩增特异性产物的片段大小与待扩增的片段大小一致(图2)。
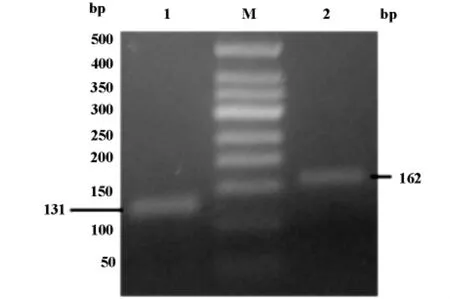
图2 人TIM-1和TIM-3基因检测mRNA的PCR产物凝胶电泳图。1:人TIM-1的PCR产物;2:TIM-3的PCR产物;M:DNA Marker
2.4 重复性与精密度
SYBR GreenI实时定量PCR分别检测人TIM-1和TIM-3基因1.0×105copies/μl标本的精密度。TIM-1基因批内与批间的CV分别为1.55%和2.20%,TIM-3基因批内与批间的CV分别为1.68%和2.01% (表1)
3 讨论
目前研究表明新鉴定的TIM家族在免疫应答和免疫耐受中起重要作用[10-12]。鼠类由8个成员组成(Tim1~8),位于鼠类染色体11B1.1上;人类由3个成员组成(TIM-1、TIM-3和TIM-4),位于人类染色体5q33.2上[2]。TIM基因编码一类具有共同基序的跨膜糖蛋白,其结构包括潜在的信号肽区、免疫球蛋白(IgV)样区、黏蛋白样区、跨膜区和胞内区五部分[2]。TIM-1优先表达于人和鼠的Th2细胞表面,作为一个潜在的共刺激分子调节T细胞的活化,是一个哮喘和过敏症等的易感基因[2,13,14]。TIM-3偏爱表达于Th1细胞表面,与其配体半乳凝素-9(galectin-9)结合产生抑制信号,负调节 Th1免疫应答[15-18]。TIM-4在抗原提呈细胞上高表达,与其配体TIM-1结合调节T细胞增殖[19-21]。TIM 基因晶体结构显示在其IgV区有一个特征性的FGCC'结构,可能是配体PS结合位点[22]。最新研究表明TIM基因家族可能是PS的一个新的受体家族,与PS结合介导凋亡细胞的识别与清除[5]。因此,TIM基因参与调节Th1和Th2细胞免疫应答,与自身免疫病、哮喘和过敏症等疾病发病机制相关。
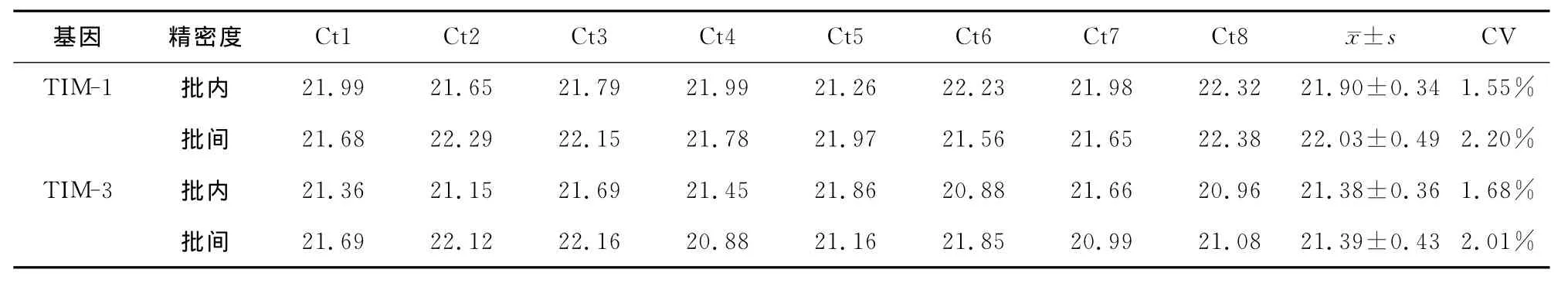
表1 人TIM-1和TIM-3基因标准品1.0×105copies/μl的批内与批间精密度检测结果
实时荧光定量RT-PCR由于其具有高度敏感性和动态实时检测等优势而在科研和临床中得到广泛应用[9,23]。主要应用于定量分析各种基因的表达、基因分型和多态性分析、免疫组分分析、肿瘤研究和临床疾病早期诊断与病原体检测[24-26]。目前,实时荧光PCR的定量方法主要有为绝对定量和相对定量两大类,各自具有优缺点[25]。定量PCR需要实时检测反应中所形成的扩增产物,而目前多采用与DNA非特异性结合的荧光染料或者标记的序列特异性的探针来完成实时检测[27]。与探针比较,荧光染料设计简单、低成本、易操作和可以用熔解曲线分析特异性等优点[25]。SYBR Green I是荧光定量PCR最常用的DNA结合染料,与双链DNA(ds-DNA)非特异性结合[27]。在本研究中我们利用构建的人TIM-1和TIM-3重组质粒,成功建立人TIM-1和TIM-3mRNA 实时SYBR Green I绝对定量RT-PCR检测方法。结果表明建立的人TIM-1和TIM-3Real-time RT-PCR定量技术具有很好的敏感性、特异性、线性范围,为研究组织和细胞中的TIM-1和TIM-3mRNA的表达变化和了解它们在免疫调控中的作用机制进一步奠定实验基础。
[1]Kuchroo VK,Umetsu DT,DeKruyff RH,et al.The TIM gene family:emerging roles in immunity and disease[J].Nat Rev Immunol,2003,3:454.
[2]Meyers JH,Sabatos CA,Chakravarti S,et al.The TIM gene family regulates autoimmune and allergic diseases[J].Trends Mol Med,2005,11:362.
[3]Umetsu DT,Umetsu SE,Freeman GJ,et al.TIM gene family and their role in atopic diseases[J].Curr Top Microbiol Immunol,2008,321:201.
[4]Anderson AC,Anderson DE.TIM-3in autoimmunity[J].Curr Opin Immunol,2006,18:665.
[5]Freeman GJ,Casasnovas JM,Umetsu DT,et al.TIM genes:a family of cell surface phosphatidylserine receptors that regulate innate and adaptive immunity[J].Immunol Rev,2010,235:172.
[6]Su EW,Lin JY,Kane LP.TIM-1and TIM-3proteins in immune regulation[J].Cytokine,2008,44:9.
[7]Smith CJ,Osborn AM.Advantages and limitations of quantitative PCR (Q-PCR)-based approaches in microbial ecology[J].FEMS Microbiol Ecol,2009,67:6.
[8]Bustin SA,Mueller R.Real-time reverse transcription PCR(qRT-PCR)and its potential use in clinical diagnosis[J].Clin Sci(Lond),2005,109:365.
[9]VanGuilder HD,Vrana KE,Freeman WM.Twenty-five years of quantitative PCR for gene expression analysis[J].Biotechniques,2008,44:619.
[10]Rodriguez-Manzanet R,DeKruyff R,Kuchroo VK,et al.The costimulatory role of TIM molecules[J].Immunol Rev,2009,229:259.
[11]Su EW,Lin JY,Kane LP.TIM-1and TIM-3proteins in immune regulation[J].Cytokine,2008,44:9.
[12]Kuchroo VK,Meyers JH,Umetsu DT,et al.TIM family of genes in immunity and tolerance[J].Adv Immunol,2006,91:227.
[13]McIntire JJ,Umetsu DT,DeKruyff RH.TIM-1,a novel allergy and asthma susceptibility gene[J].Springer Semin Immunopathol,2004,25:335.
[14]Umetsu SE,Lee WL,McIntire JJ,et al.TIM-1induces T cell activation and inhibits the development of peripheral tolerance[J].Nat Immunol,2005,6:447.
[15]Sanchez-Fueyo A,Tian J,Picarella D,et al.Tim-3inhibits T helper type 1-mediated auto-and alloimmune responses and promotes immunological tolerance[J].Nat Immunol,2003,4:1093.
[16]Monney L,Sabatos CA,Gaglia JL,et al.Th1-specific cell surface protein Tim-3regulates macrophage activation and severity of an autoimmune disease[J].Nature,2002,415:536.
[17]Sabatos CA,Chakravarti S,Cha E,et al.Interaction of Tim-3 and Tim-3ligand regulates T helper type 1responses and induction of peripheral tolerance[J].Nat Immunol,2003,4:1102.
[18]Zhu C,Anderson AC,Schubart A,et al.The Tim-3ligand galectin-9negatively regulates T helper type 1immunity[J].Nat Immunol,2005,6:1245.
[19]Meyers JH,Chakravarti S,Schlesinger D,et al.TIM-4is the ligand for TIM-1,and the TIM-1-TIM-4interaction regulates T cell proliferation[J].Nat Immunol,2005,6:455.
[20]Yang PC,Xing Z,Berin CM,et al.TIM-4expressed by mucosal dendritic cells plays a critical role in food antigen-specific Th2 differentiation and intestinal allergy[J].Gastroenterology,2007,133:1522.
[21]Rodriguez-Manzanet R,Meyers JH,Balasubramanian S,et al.TIM-4expressed on APCs induces T cell expansion and surviv-al[J].J Immunol,2008,180:4706.
[22]Anderson AC,Xiao S,Kuchroo VK.Tim protein structures reveal a unique face for ligand binding[J].Immunity,2007,26:273.
[23]Bustin SA.Developments in real-time PCR research and molecular diagnostics[J].Expert Rev Mol Diagn,2010,10:713.
[24]Ratcliff RM,Chang G,Kok T,et al.Molecular diagnosis of medical viruses[J].Curr Issues Mol Biol,2007,9:87.
[25]Wong ML,Medrano JF.Real-time PCR for mRNA quantitation[J].Biotechniques,2005,39:75.
[26]Johnson VJ,Yucesoy B,Luster MI.Genotyping of single nucleotide polymorphisms in cytokine genes using real-time PCR allelic discrimination technology[J].Cytokine,2004,27:135.
[27]Bustin SA,Benes V,Nolan T,et al.Quantitative real-time RTPCR-aperspective[J].J Mol Endocrinol,2005,34:597.

