嘌呤核苷酸对海洛因依赖及戒断大鼠垂体嘌呤核苷酸代谢关键酶基因表达的影响
崔佳乐,洪新雨,赵丽艳,,刘剑凯,洪 敏*
(1.吉林大学白求恩医学院 组织学与胚胎学教研室,吉林 长春130021;
2.吉林大学第一医院 神经外科,吉林 长春130021;3.吉林大学第二医院 检验科,吉林 长春130041;4.吉林大学白求恩医学院 生物化学与分子生物学教研室,吉林 长春130021)
毒品的滥用成瘾是严重的医学和社会问题,海洛因是具有代表性的阿片类毒品,对机体多个系统的器官都有较严重的毒性和潜在的危害[1,2],神经系统常受损严重。以往的研究表明海洛因可造成机体嘌呤核苷酸的分解代谢增强,表现为血尿酸明显增高[3],并且发现阿片类药物使大鼠大部分组织器官中次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT)的基因表达下降,同时给予腺苷或嘌呤核苷酸则可逆转或缓解阿片类物质所致的某些损害[4-6]。有学者报道ATP和它的代谢产物通过激活腺苷和/或嘌呤受体而调节下丘脑功能,这些受体表达在神经内分泌细胞和内分泌细胞,包括下丘脑神经元,有分泌作用的垂体细胞和支持细胞[7]。这些都提示核苷酸的代谢情况会与海洛因成瘾及戒断情况下垂体的功能状态密切相关。本文通过检测海洛因成瘾、戒断及补偿嘌呤核苷酸大鼠垂体嘌呤核苷酸代谢关键酶基因表达情况的变化,观察海洛因对嘌呤核苷酸代谢的影响,及嘌呤核苷酸的治疗干预作用,为探讨补偿嘌呤核苷酸作为海洛因戒瘾的新疗法及其将来应用于临床提供依据。
1 材料与方法
1.1 动物、药品及试剂
实验选用清洁级健康成年雄性Wistar大鼠80只,体重为200±20g,由吉林大学实验动物中心提供(动物合格证号:吉检证字第2003-0001号)。海洛因(纯度98%)由吉林省公安厅禁毒办公室提供,临用时用生理盐水溶解、抽滤除菌。嘌呤核苷酸:腺苷一磷酸(adenosine monophosphate,AMP),鸟苷一磷酸(guanosine monophosphate,GMP)为 AMRESCO公司产品。PCR引物:特异引物由赛百盛基因技术有限公司合成,引物设计根据Primer 5.0设计软件完成。β-肌动蛋白Ⅰ(β-actinⅠ)扩增产物长度为511bp,上游引物:5′-GAAATCGTGCGTGACATTAA-3′, 下 游 引 物:5′-CTAGAAGCATTTGCGGTGCA-3′;β-肌动蛋白Ⅱ(β-actinⅡ)扩增产物长度为218bp,上游引物:5′-AAGAGAGGCATCCTGACCCT-3′,下 游 引 物:5′-TACATGGCTGGGGTGTTGAA-3′;ADA 引物扩增产物长度 为 258bp,上 游 引 物:5′-GCAACATTATCGGCATGGAC-3′,下 游 引 物:5′-CAAGATCCACAACCTCATCAG-3′;HGPRT引物扩增产物长度为410bp,上游引物:5′-GCTGACCTGCTGGATTACATTA-3′,下 游 引 物:5′-CCACTTTCGCTGATGACACAA-3′。
1.2 动物分组与给药
80只雄性Wistar大鼠随机分成8组,每组10只,喂食普通固体饲料,自由饮水,同条件饲养,自然昼夜采光。①对照组(C):第1-10天每日2次腹腔注射生理盐水,注射体积及时间与当日海洛因给药体积及时间相同,第11天处死。②核苷酸组(N):第1-10天每日2次(AM7:00和PM19:00)腹腔注射核苷酸(AMP与GMP等摩尔混合),每日次剂量均为7.5mg·kg-1体重,第11天处死。③海洛因组(H):第1-10天每日2次(AM7:00和PM19:00)腹腔注射海洛因,每日次剂量依次为0.50、0.75、1.25、2.00、3.00、4.25、5.75、7.50、7.50和7.50mg·kg-1体重,第11天处死。④海洛因+核苷酸组(NH):第1-10天每日2次(AM7:00和PM19:00)腹腔注射核苷酸和海洛因(核苷酸剂量同当日核苷酸组,海洛因剂量同当日海洛因组),第11天处死。⑤海洛因戒断3d组(W3):第1-10天每日2次腹腔注射海洛因(同海洛因组),第11-13天停药,第14天处死。⑥海洛因戒断9d组(W9):第1-10天每日2次腹腔注射海洛因(同海洛因组),第11-19天停药,第20天处死。⑦核苷酸3d组(N3):第1-10天每日2次腹腔注射海洛因(同海洛因组),第11-13天每日2次腹腔注射核苷酸(给药剂量及时间同核苷酸组),第14天处死。⑧核苷酸9d组(N9):第1-10天每日2次腹腔注射海洛因(同海洛因组),第11-19天每日2次腹腔注射核苷酸(给药剂量及时间同核苷酸组),第20天处死。
1.3 RT-PCR法检测垂体组织的 ADA mRNA和HGPRT mRNA含量
异硫氰酸胍法提取大鼠垂体组织的总RNA,经逆转录获得cDNA。PCR反应在0.2ml Eppendorf管中建立反应混合物包括:10×PCR Buffer 5μl,dNTP(10mmol·L-1)1μl,β-actin上下游引物各10pmol,ADA和HGPRT的PCR反应上下游引物(ADA的PCR反应上下游引物各50pmol,HGPRT的PCR反应上下游引物各10pmol),cDNA 1 μl,Taq DNA聚合酶(5U·μl-1)0.5μl,加三蒸水补足体积至50μl。ADA扩增的PCR反应条件:①95℃,3min;②95℃,35s;③64℃,1min;④72℃,1 min;⑤重复步骤②-④,34个循环;⑥72℃,10 min。HGPRT扩增的PCR反应条件:①95℃,3 min;②95℃,35sec;③58℃,1min;④72℃,1min;⑤重复步骤②-④,27个循环;⑥72℃,10min。RT-PCR产物的定量鉴定:PCR产物在1.5%琼脂糖凝胶上电泳,溴化乙锭染色后用Kodak凝胶电泳呈像分析系统进行电泳结果的拍照及电泳条带的强度分析,分别计算每一条泳道的目地基因扩增产物与内参β-actin扩增产物的强度比值,表示该目的基因的相对表达水平。
1.4 统计学分析
采用SPSS 8.0统计软件,垂体组织的ADA mRNA及HGPRT mRNA含量以¯x±s表示,组间比较采用t检验。
2 结果
2.1 各组大鼠垂体组织中ADA基因表达水平
与对照组比较,海洛因组、戒断3d组大鼠垂体ADA mRNA相对表达量数值上有所增高,但各组均未见明显差异(P>0.05)。见图1,表1。
2.2 各组大鼠垂体组织中HGPRT基因表达水平
与对照组比较,核苷酸组HGPRT mRNA增多(P<0.05),海洛因组未见到显著改变(P>0.05)。见图1,表1。
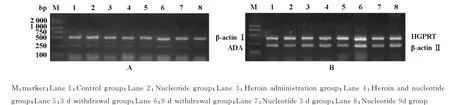
图1 各组大鼠垂体组织中ADA和HGPRT基因表达水平
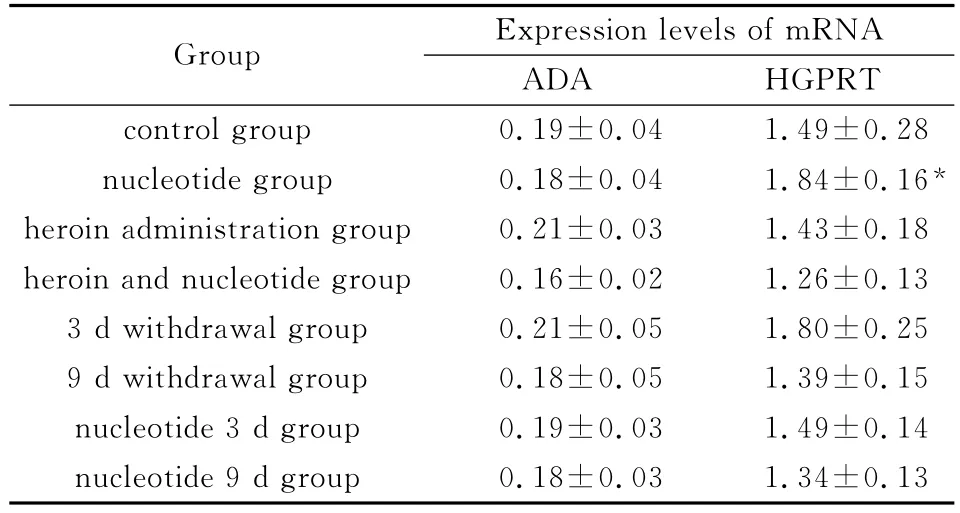
表1 各组大鼠垂体组织中ADA和HGPRT基因表达水平(n=3,x—±s,λB/U·L-1)
3 讨论
嘌呤核苷酸(AMP和GMP)作为RNA/DNA的组成成分,是细胞内非常重要的分子,同时在细胞间嘌呤核苷与核苷酸又是递质,通过嘌呤能受体引起细胞内信号传递,参与几乎所有的生命活动。腺苷脱氨酶(adenosine deaminase,ADA)是降解嘌呤核苷酸的关键酶之一,催化腺嘌呤核苷转化为次黄嘌呤核苷,进而分解成次黄嘌呤。次黄嘌呤鸟嘌呤磷酸核糖转移酶(hypoxanthine-guanine phosphoribosyl transferase,HGPRT)是嘌呤核苷酸补救合成关键酶,由于在脑组织内嘌呤核苷酸仅有补救合成途径,因而HGPRT的作用很重要。
实验结果显示,与对照组比较,海洛因组、海洛因戒断3d组大鼠垂体ADA mRNA相对表达量数值上有所增高,海洛因戒断9d组又下降,但各组均未见明显差异(P>0.05)。这种变化的趋势与以往文献中睾丸、附睾组织相似[8],但不同在于幅度较小。同时,与对照组比较,核苷酸组、核苷酸3d组、及核苷酸9d组ADA mRNA相对表达量的数值相近,也无统计学差异(P>0.05)。可以观察到海洛因成瘾和戒断时,同时给予嘌呤核苷酸能够使ADA mRNA水平保持相对的稳定。
同时,与对照组比较,除核苷酸组HGPRT mRNA增多(P<0.05),其他各组未见到显著改变(P>0.05)。虽然相对于对照组,海洛因组 HGPRT mRNA水平较低,但海洛因戒断3d组数值上升,说明可能对于不同的酶,海洛因作用的起效时间有所差异。且在海洛因戒断的同时给予嘌呤核苷酸(即核苷酸3d组),HGPRT mRNA水平更加接近于对照组。这提示补偿核苷酸组依然表现出“对抗”海洛因的作用。
以往的研究表明,海洛因给药加强了多种组织内嘌呤核苷酸的分解,并且降低了补救合成[3],继而导致了嘌呤核苷酸的代谢失衡。由于脑组织的特殊性,其内部仅有嘌呤核苷酸的补救合成,而缺乏从头合成,使得脑组织内嘌呤核苷酸缺失。研究认为补偿嘌呤核苷酸恰恰可以抑制这种缺失情况,从而抵抗了海洛因依赖导致的各种毒副作用[4]。同时海洛因依赖会使包括垂体的多种组织内细胞的超微结构造成损害[8],而补偿嘌呤核苷酸后可以缓解或抑制这种损害。海洛因成瘾及戒断的情况很复杂,同时补偿嘌呤核苷酸是否可能从多个途径进行调节和作用,垂体内嘌呤核苷酸的代谢情况及具体作用机制还有待于深入的研究。
[1]Goletiani NV,Mendelson JH,Sholar MB,et al.Opioid and cocaine combined effect on cocaine-induced changes in HPA and HPG axes hormones in men[J].Pharmacol Biochem Behav,2009,91(4):526.
[2]Graziani M,Antonilli L,Togna AR,et al.Non-opioid induction of morphine-6-glucuronide synthesis is elicited by prolonged exposure of rat hepatocytes to heroin[J].Drug Alcohol Depend,2008,98(3):179.
[3]Yang YD,Zhang JZ,Sun C,et al.Heroin affects purine nucleotides catabolism in rats in vivo[J].Life Sci,2006,78(13):1413.
[4]阚慕洁.嘌呤核苷酸补偿对阿片类药物与毒物作用的干预性研究[D].长春:吉林大学,2008.
[5]何海涛,孙 婷,崔佳乐,等.嘌呤核苷酸补偿对吗啡依赖大鼠嘌呤核苷酸分解代谢的影响[J].中国药理学通报,2008,24(8):1081.
[6]崔佳乐,刘昕鸣,王 巍,等.嘌呤核苷酸对海洛因依赖及戒断大鼠心肌酶学的影响[J].吉林大学学报(医学版),2009,35(3):474.
[7]Stojilkovic SS.Purinergic regulation of hypothalamopituitary functions.Trends Endocrinol Metab[J].2009,20(9):460.
[8]崔佳乐.海洛因及补偿嘌呤核苷酸对雄性大鼠生殖内分泌系统的影响[D].长春:吉林大学,2008.

