靶向抑制皮层肌动蛋白与Arp2/3复合物结合对结肠癌侵袭和转移的抑制作用
吴寒 袁岱岳 贾晓斌 钱飞 朱建伟
(1.南通大学附属医院普外科,江苏 南通 226001;2.江苏省南通市第一人民医院普外科,江苏 南通 226001)
侵袭伪足(invadopodia)的形成是癌细胞发生侵袭转移的至关重要的条件之一,该过程有赖于皮层肌动蛋白(cortactin)的装配作用。作为侵袭性伪足形成的重要调控者,Arp2/3 复合物 (Arp2/3 complex)的主要作用是促进肌动蛋白的聚合和延长,这是肌动蛋白装配过程的主要限速步骤。虽然Wiskott-Aldrich综合征蛋白(Wiskott-Aldrich Syn-drome protein,WASPs)是Arp2/3复合物最强的激活蛋白,但是cortactin亦可通过加强Arp2/3复合体和肌动蛋白母链结合的关键步骤,促进Arp2/3复合物介导的分支肌动蛋白的成核。
cortactin有4个主要的功能区,其中与Arp2/3复合物结合的氨基末端酸性区域(NTA)和与肌动蛋白结合的一段串联的重复序列区域(ABR)需同时存在,才能参与Arp2/3复合物介导的分支肌动蛋白的装配[1-2]。我们的前期研究已成功设计仅包含ABR但无NTA的重组cortactin质粒[3]。本研究将仅包含ABR的重组质粒,命名为EGFP/N2/ABR,将其转染高侵袭性人大肠癌细胞株LoVo,期望通过靶向抑制肌动蛋白装配而控制其所依赖的肿瘤细胞膜活动,抑制肿瘤细胞的侵袭和转移,同时观察半乳糖凝集素(galectin-1)表达的变化。
1 资料与方法
1.1 材料 4~6周龄BALB/C裸小鼠36只,雌性,体质量(18.0±2.0)g,购自中科院上海实验动物中心。人大肠癌细胞株LoVo购自中科院上海细胞所。大肠杆菌DH5α由实验室自备。仅包含ABR的重组cortactin质粒由本课题组前期构建[3]。galectin-1抗体购自美国R&D公司。Taq酶、限制性内切酶、T4连接酶、LipofectamineTM2000均购自美国Invitrogen公司。胎牛血清购自杭州四季青生物工程材料技术有限公司。胰蛋白胨、酵母提取物系美国Sigma公司产品。质粒抽提试剂盒系美国Axygen公司产品。胶回收试剂盒购自美国Watson公司。
1.2 细胞培养 结肠癌LoVo细胞株用含10%小牛血清的DEME培养液培养,培养条件为37℃、CO2体积分数为5%。取对数生长期细胞进行实验。
1.3 转染及稳定株筛选 在转染前1 d将生长良好、处于对数生长期的LoVo细胞以2×105/cm2接种于24孔培养板,待细胞融合度均达60%~75%时进行转染。转染的方法为:(1)配置溶液A 用DEME培养基稀释3.2μLDNA(浓度为250 g/L的EGFP/N2/ABR)至50μL并轻柔混匀;(2)配置溶液B用DEME培养基稀释LipofectamineTM2000(1∶25)至50μL并轻柔混匀,室温下孵育5 min;(3)将上述两种溶液轻柔混匀,室温下孵育20 min;(4)将总体积为100μL的混合液加入培养孔中,轻柔混匀,在37℃孵箱中孵育4~6 h后更换为含10%小牛血清的DEME培养液;(5)转染1 d后在激光共聚焦显微镜下观察转染效果;(6)转染24 h后用含G418的筛选培养基进行筛选,构建稳定表达外源基因的细胞株。G418筛选浓度为500 mg/L,该浓度可以使细胞在10 d内全部死亡。具体方法见参考文献[3]。
1.4 抑制体内肿瘤转移实验 采用脾内注射法制备大肠癌肝转移模型。将36只裸鼠随机分为3组,每组12只,分别为未转染重组质粒组(LoVo组)、转染空质粒组和转染重组质粒组(EGFP/N2/ABR组)。将各组待转染的细胞调整细胞密度为2×106/mL。无菌条件下,2%戊巴比妥钠腹腔注射麻醉裸鼠,取左腹部切口进腹,显露脾脏,于脾脏上极以50μL微量注射器缓慢进针,注入癌细胞悬液0.3 mL。用75%乙醇浸湿的纱布局部压迫并擦拭以杀灭可能存在的游离癌细胞。然后将脾脏置于原位,关腹。待裸鼠濒临死亡或自然死亡时,对其进行解剖。对8周后仍存活的小鼠,颈椎脱臼处死,剖腹观察肿瘤转移情况,比较裸鼠的生存期。为便于计测肝转移瘤结节,将肝脏表面转移瘤结节数量分为4级:0级0个;Ⅰ级1~5个;II级6~10个;III级>50个或转移瘤结节呈块状融合,弥漫生长。
1.5 肿瘤组织中galectin-1蛋白的检测 按常规蛋白印迹方法进行。
1.6 统计学处理 用SPSS 13.0软件进行统计分析。个变量以均数±标准差表示,各组间采用t检验,等级资料采用Mann-Whitney U检验,生存分析通过软件绘制Kaplan-Meier生存曲线,并采用Wilcoxon检验(Gehan比分法)进行生存率的比较。P<0.05为差异有统计学意义。
2 结 果
2.1 转染细胞结果鉴定 EGFP/N2自身带有绿色荧光蛋白,在激光共聚焦显微镜下可见众多绿色荧光,结合同视野光镜下的细胞形态,证实荧光均来自细胞,证明转染成功。
2.2 裸鼠生存期观察 Kaplan-Meier生存分析显示,LoVo组、空质粒组和EGFP/N2/ABR组裸鼠的中位生存时间分别为(30.00 ± 3.40)d、(32.00±2.27)d和 (48.0 ± 10.39)d。Wilcoxon检验(Gehan比分法)结果显示,EGFP/N2/ABR组的生存率显著高于LoVo组,差异有统计学意义(u=10.78,u=13.31,P<0.05),LoVo组和空质粒组的差异无统计学意义(u=0.10,P>0.05)。
2.3 裸鼠肝脏转移瘤结节的差异 发生肝转移的裸鼠肝脏表面及切面均可见大小不等的灰黄色转移灶,呈弥散分布,部分转移瘤结节融合成块。脾脏表面均可见二三个散在的直径3 mm左右的瘤结节。HE染色显示,肝脏转移瘤组织癌细胞聚集成团,异形性明显,胞质少,核大,核分裂像易见。脾脏种植瘤癌细胞形态与肝脏转移瘤癌细胞形态相似,符合低分化腺癌的特征。见图1。
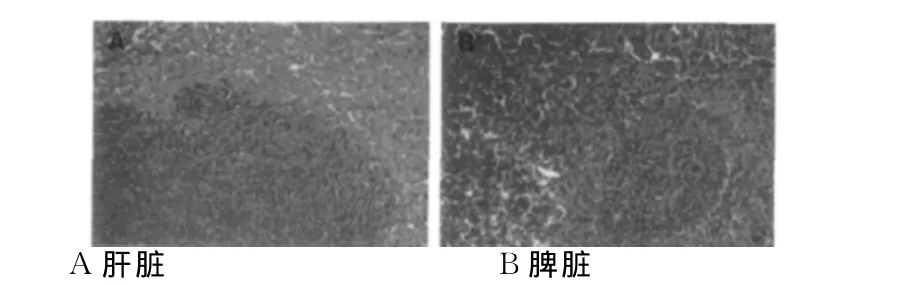
图1 裸鼠成瘤的肝脏和脾脏的病理切片
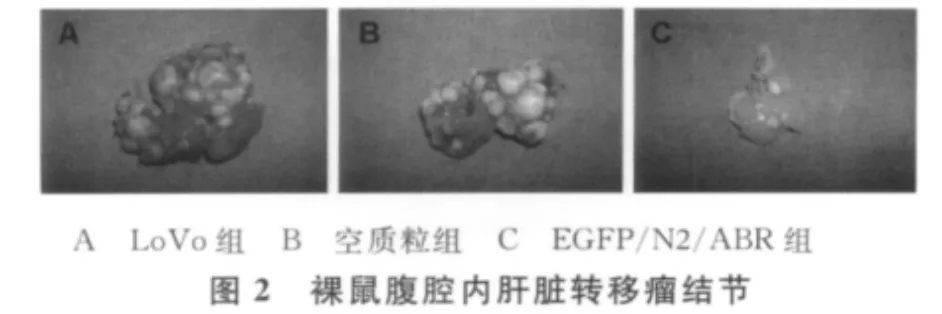
为了将肝脏转移瘤结节量化,按数量和是否有融合分为4级,进行分级计数。结果显示,EGFP/N2/ABR组肝脏表面的转移瘤结节数少于LoVo组和空质粒组,差异有统计学意义(P<0.05),LoVo组和空质粒组的差异无统计学意义(P>0.05)。见表1、图2。
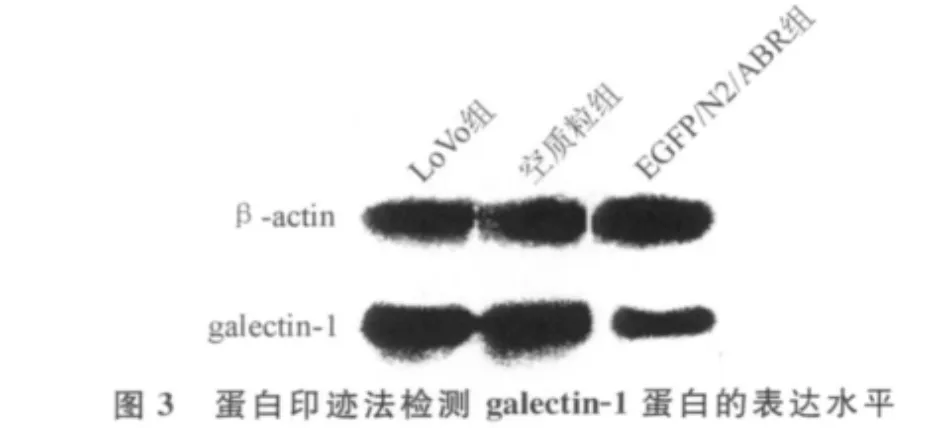
2.4 galectin-1蛋白的表达水平 蛋白印迹结果显示,EGFP/N2/ABR组galectin-1蛋白的表达水平显著低于LoVo组和空质粒组(P<0.05)。LoVo组和空质粒组galectin-1蛋白的表达水平差异无统计学意义(P>0.05)。见图3。
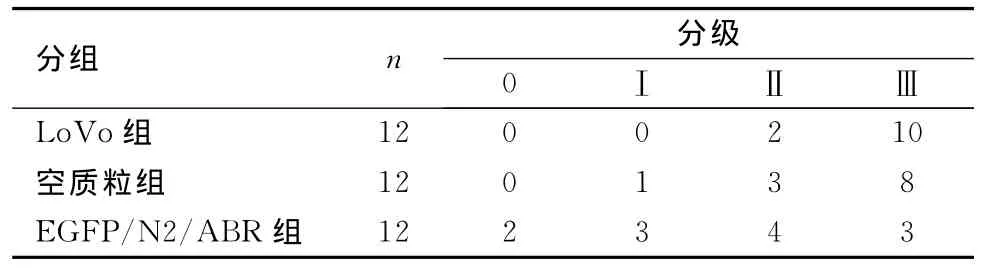
表1 3组裸鼠肝脏表面转移瘤结节的计数表
3 讨 论
恶性肿瘤细胞的浸润和转移与其细胞内肌动蛋白细胞骨架的重构密切相关[4]。细胞骨架的改变影响癌细胞的运动和迁移,其中包括细胞膜的伪足样伸展、膜流动性及细胞极性的变化等,是癌细胞侵袭转移各步骤的共同特征,其中的一个显著特点是癌细胞膜形成侵袭伪足[5-6]。癌细胞首先侵袭伪足插入细胞外基质,并在插入部位分泌蛋白酶降解周围的基质,使癌细胞突破基质屏障向纵深侵犯,最终进入循环播散到其他组织和器官[6]。本研究发现,通过靶向抑制cortactin与Arp2/3复合物的结合,转染重组EGFP/N2/ABR质粒组裸鼠肝脏表面的转移瘤结节数较未转染组显著减少。这表明人为地阻断肌动蛋白的装配过程,可以下调侵袭突触的产生,抑制肿瘤的转移。
近来的研究[7]表明,肿瘤细胞表面糖蛋白通过与凝集素结合,调控着许多生物学进程。galectins有保守的糖结合域和折叠结构,其与细胞膜糖基化蛋白的N-聚糖结合,形成半乳凝素-聚糖网格(galectin-glycan lattice),从而传导生物学信息,调控细胞功能[8]。目前已发现有多种galectins在固有免疫和适应性免疫中介导不同的免疫反应,并参与肿瘤的侵袭和转移[9]。Wu等[10]发现,galectin-1通过重塑肌动蛋白细胞骨架促进口腔鳞状细胞癌的浸润和转移。Saravanan等[11]敲除β-1、6-N-乙酰葡糖胺转移酶Ⅴ后,发现外源性galectins通过与角膜上皮细胞表面N-聚糖结合而促进侵袭伪足的形成。galetin-1的表达似与肿瘤细胞板状突触和(或)带状突触的数量相关,这表明其可能通过重塑肌动蛋白细胞骨架,促进肿瘤的转移,但在结肠癌中鲜见类似的相关报道。本研究中,LoVo组中肺转移结节的galectin-1的表达水平显著高于EGFP/N2/ABR组。因此,可以认为galectin-1的表达可能与结肠癌细胞骨架的重建以及浸润突触的形成有关,其中的机制值得我们进一步探讨。
随着对结肠癌细胞骨架和细胞运动研究的进一步深入,阐明肿瘤异常糖基化对其影响的具体机制,可为肿瘤的早期诊断、预后及分子靶向治疗提供新的依据。
[1]Weaver A M,Karginov A V,Kinley A W,et al.Cortactin promotes and stabilizes Arp2/3-induced actin filament network formation[J].Curr Biol,2001,11(5):370-374.
[2]Uruno T,Liu J,Zhang P,et al.Activation of Arp2/3 complex-mediated actin polymerization by cortactin[J].Nat Cell Biol,2001,3(3):259-266.
[3]丛纲,徐美荣,朱建伟,等.靶向抑制皮层肌动蛋白装配对大肠癌细胞侵袭作用的影响[J].中华实验外科杂志,2009,26(2):156-158.
[4]Hayashi H,Nabeshima K,Aoki M,et al.Overexpression of IQGAP1 in advanced colorectal cancer correlates with poor prognosis-critical role in tumor invasion[J].Int J Cancer,2010,126(11):2563-2574.
[5]Yoshio T,Morita T,Kimura Y,et al.Caldesmon suppresses cancer cell invasion by regulating podosome/invadopodium formation[J].FEBS Lett,2007,581(20):3777-3782.
[6]Vishnubhotla R,Sun S,Huq J,et al.ROCK-II mediates colon cancer invasion via regulation of MMP-2 and MMP-13 at the site of invadopodia as revealed by multiphoton imaging[J].Lab Invest,2007,87(11):1149-1158.
[7]van Kooyk Y,Rabinovich G A.Protein-glycan interactions in the control of innate and adaptive immune responses[J].Nat Immunol,2008,9(6):593-601.
[8]Rabinovich G A,Toscano M A.Turning'sweet'on immunity:galectin-glycan interactions in immune tolerance and inflammation[J].Nat Rev Immunol,2009,9(5):338-352.
[9]Salatino M,Croci D O,Bianco G A,et al.Galectin-1 as a potential therapeutic target in autoimmune disorders and cancer[J].Expert Opin Biol Ther,2008,8(1):45-57.
[10]Wu M H,Hong T M,Cheng H W,et al.Galectin-1-mediated tumor invasion and metastasis,up-regulated matrix metalloproteinase expression,and reorganized actin cytoskeletons[J].Mol Cancer Res,2009,7(3):311-318.
[11]Saravanan C,Liu F T,Gipson I K,et al.Galectin-3 promotes lamellipodia formation in epithelial cells by interacting with complex N-glycans on alpha3beta1 integrin[J].J Cell Sci,2009,122(Pt 20):3684-3693.

