高压氧对大鼠T淋巴细胞和细胞因子的影响
刘志红 冯芳 王钢


【摘要】目的 研究高压氧对健康大鼠以及全身炎症反应综合征(SIRS)大鼠T淋巴细胞和细胞因子(IL-6、IL-10、TNF-α)等的影响。方法 40只雄性SD大鼠随机(随机数字法)分为5组。A组:腹腔注射生理盐水(0.9% NaCl, 5 ml/kg)作为对照组;B组:腹腔注射等量生理盐水,做3次高压氧治疗;C组:腹腔注射酵母多糖-石蜡悬液(500 mg/kg);D组:腹腔注射等量酵母多糖-石蜡悬液,做1次高压氧治疗;E组:腹腔注射等量酵母多糖-石蜡悬液,做3次高压氧治疗。所有大鼠均于腹腔注射24 h后处死,门静脉取血,标本采用流式细胞技术对CD3+CD4+CD8+进行计数,应用ELISA方法检测IL-6、IL-10、TNF-α血浆水平,以单因素方差分析及LSD-t检验分析数据。结果 高压氧治疗可显著降低健康大鼠外周血CD4 T细胞百分比(P<0.01),使CD4/CD8T细胞比值下降(P<0.05)。酵母多糖腹腔注射使大鼠外周血CD4、CD8 T细胞均减少(P<0.01)。1次和3次HBO治疗可使酵母多糖所致CD4 T细胞减少明显恢复(P<0.01,P<0.05)。对于未出现高炎症反应的大鼠,HBO治疗可增加IL-6(P<0.05)和TNF-α(P<0.01),而减少IL-10(P<0.05)。结论 高压氧可降低健康大鼠外周血CD4T细胞百分比。当出现高炎症反应时,高压氧可以明显抑制细胞因子TNF-α、IL-6和IL-10的爆发增多。高压氧对健康大鼠和未出现高炎症反应的SIRS大鼠起促炎作用。
【关键词】高压氧;SIRS;T淋巴细胞;细胞因子;免疫功能;TNF-α
Effect of hyperbaric oxygen on T-lymphoid cells and cytokines in rats LIU Zhi-hong, FENG Fang, WANG Gang. Emergency Department, First Affiliated Hospital, China Medical University, Shenyang 110001, China
Corresponding author: WANG Gang,Email:wg5385@sohu.com
【Abstract】Objective To investigate the effects of hyperbaric oxygen therapy on T-lymphocytes l and cytokines including IL-6, IL-10 and TNF-α as indicators well representing immune function and inflammation in normal rats and rats with systemic inflammatory response syndrome. Methods Forty Sprague-Dawley male Rats were randomly (random number) divided into five groups. Rats of group A were treated by saline solution(0.9℅ NaCl, 5 ml/kg), and served as control group; rats of group B were treated with saline solution and hyperbaric oxygen therapy three times; rats of group C were treated with zymosan (500 mg/kg); rats of group D were treated with zymosan and hyperbaric oxygen therapy once; and rats of group E were treated with zymosan and hyperbaric oxygen therapy three times. At 24 hours after saline or zymosan administration, rats were sacrificed and blood samples were collected from the portal vein. CD3+,CD4+,CD8+cells were counted by flow cytometer, and plasma levels of IL-6, IL-10 and TNF-α were measured by ELISA . The results were analyzed by one-way ANOVA and LSD post-hoc test. Results CD4 T cell of normal rats was decreased by hyperbaric oxygen (P<0.01), CD4/CD8 T cell ratio was also decreased (P<0.05). Of rats with zymosan administration, CD4 T cells and CD8 T cells were both decreased on a parallel (P<0.01). A single one HBO and HBO for three times both raised the percentage of CD4 T cells which was significantly decreased by zymosan administration (P<0.01 and P<0.05). In rats without hyper-inflammation, hyperbaric oxygen therapy showed a pro-inflammatory effect by elevating TNF-α (P<0.01), IL-6(P<0.05) and reducing IL-10 (P<0.05). Conclusions HBO reduces CD4 T cells in normal rats. HBO reduces the production of TNF-α,IL-6 and IL-10 during hyper-inflammation. HBO is pro-inflammatory in normal rats and minor SIRS rats withourt appreciable hyper-inflammation in circulation.
【Key words】Hyperbaric oxygen;Systematic inflammatory response syndrome;T- lymphocyte; Cytokine; Immune function ;TNF-α
高压氧(HBO)作为一种治疗手段,广泛应用于临床。它可以促进受伤部位纤维母细胞、上皮细胞和血管的增值,增强白细胞的氧化杀伤能力,对特殊厌氧菌有致命的杀伤力[1]。高压氧还表现出广泛的细胞分子学反应,包括细胞内信号转导和基因功能调节,高压氧的生化作用包括调节黏附分子、生长因子和细胞因子的表达,微循环的灌注和细胞能量的干预等[2]。然而,高压氧在免疫调节和抗炎作用方面的研究以及在全身炎症反应综合征(SIRS)中的应用尚不多见。SIRS从一个新的角度阐明多器官功能障碍综合征(MODS)的重要病理生理及发生发展过程。创伤、感染、休克发展到 MODS存在着一条共同通路,即SIRS[3]。本实验探讨高压氧作为辅助治疗手段对一些以炎症反应为病理基础的疾病是否具有普遍的治疗意义。
1 材料与方法
1.1 材料
健康雄性SD大鼠40只,体质量150~190 g。购自中国医科大学实验动物中心。酵母多糖-A(购自Sigma公司,美国),细胞亚群的分析使用以下特殊的单克隆抗体:抗大鼠FITC-CD3,PE-CD4,PE-CD8(购自biolegend公司,美国),TNF-α,IL-6,IL-10 的ELISA试剂盒购自欣博盛公司(R&D;公司分装,美国)。
1.2 实验动物与分组
健康雄性SD大鼠40只随机(随机数字法)分为5组,每组8只。A组:腹腔注射生理盐水(0.9% NaCl, 5 ml/kg)作为对照组;B组:腹腔注射等量生理盐水(0.9%NaCl),做3次高压氧(2ATA)治疗,时间分别为腹腔注射后4 h、10 h、18 h。C组:腹腔注射酵母多糖-石蜡悬液(500 mg/kg);D组:腹腔注射等量酵母多糖-石蜡悬液,4 h以后做1次高压氧治疗(2ATA);E组:腹腔注射等量酵母多糖-石蜡悬液后,做3次高压氧治疗(2ATA),时间分别为腹腔注射后4、10、18 h。注射之前,酵母多糖-石蜡悬液于100 ℃水浴 80 min灭菌。饲养条件:温度(21±1 )℃,相对湿度60%。规律光照,7:00-19:00。自由进水和进食。
1.3 动物SIRS模型的建立及模型成功的标准
通过腹腔注射酵母多糖引起大鼠系统性炎症反应综合征,通过观察对比腹腔注射24 h后大鼠的呼吸频率增加50%,体温上升或下降1 ℃,以及皮肤发紺作为模型成功的标准。
1.4 高压氧治疗方案
在透明动物氧舱内(DWC400A/0.2-1,华信氧业有限公司,潍坊,山东)进行。加压之前,100%纯氧洗舱5 min,以清除舱内原有空气。匀速15 min加压至2ATA。所有的动物经过60 min的稳压治疗,之后以同样的速度减压出舱。治疗期间,舱内以4 L/min的速度通氧以避免CO2蓄积。
1.5 干预
所有大鼠均于固定时间点处死(腹腔注射后24 h),乙醚麻醉,门静脉取血,血标本EDTA抗凝。以红细胞裂解液去除红细胞,采用流式细胞技术,以荧光标记抗体标准操作流程,对CD3+CD4+CD8+进行计数,使用中国医科大学中心实验室Becton/Dickenson FACScan型流式细胞仪,每个标本选取5000个细胞进行分析。血浆IL-6、IL-10、TNF-α按照ELISA试剂盒说明书操作进行。
1.6 统计学方法
各组数值用均数±标准差(x±s )表示,运用SPSS 13.0 for Windows软件,以单因素方差分析及LSD-t检验对数据进行分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 酵母多糖对T细胞和细胞因子的影响
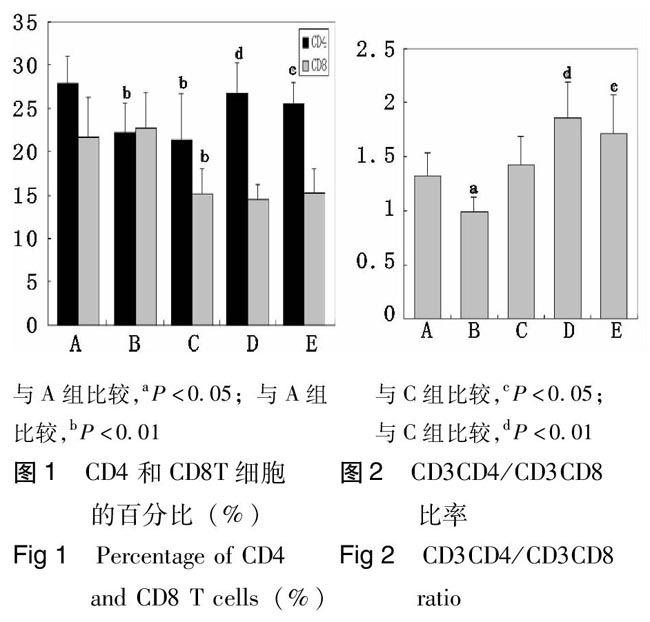
注射酵母多糖的大鼠CD4和CD8 T细胞均较对照组明显减少(P<0.01),减少程度基本平行,所以CD3+CD4+/CD3+CD8+无变化(表1图1、2)。本实验中,只有部分大鼠出现细胞因子明显增多,其余与对照组比较无明显变化(表2、图3)。所以本研究将C组D组分别再分成C0和C1组、D0和D1组,C1同D1组作为亚组单独分析(图4)。
2.2 高压氧对健康大鼠T细胞和细胞因子的影响
B组CD4 T细胞比例同对照组(A组)相比明显减少(P<0.01),CD8 T细胞基本无变化,CD3+CD4+/CD3+CD8+比值明显下降(P<0.05)(表1、图1、2)。高压氧明显增加IL-6 (P<0.05)和减少IL-10(P<0.01)。TNF-α基本无变化(表2、图3)。
2.3 高压氧对SIRS大鼠T细胞的影响
高压氧使酵母多糖导致的CD4T细胞减少明显恢复(P<0.05)。同高压氧对健康大鼠T细胞的影响一样,高压氧几乎不影响CD8 T细胞,故CD3+CD4+/CD3+CD8+比值升高(P<0.05)(表1、图1、2)。
2.4 高压氧对SIRS大鼠细胞因子的影响
一方面,与未产生高炎症反应的大鼠组(C0组)比较,三次高压氧(E组)明显增加IL-6(P<0.05)和TNF-α(P<0.01),而减少IL-10(P<0.05),这种影响类似于正常组大鼠(图3)。
另一方面,高压氧(D1组)明显下调高炎症反应组(C1组)增多的TNF-α,IL-6和IL-10的趋势。由于亚组的数据过少不能进行有效统计学分析,不能得出确定的结论。但不可忽视C1和D1组中确实存在高压氧显著抑制高炎症反应中细胞因子的趋势。见表2和图4。
2.5 一次高压氧和三次高压氧对T细胞和
细胞因子的不同影响D组和E组的CD4 和CD8T细胞比例差异无统计学意义(表1图1、2)。也就是说,三次高压氧治疗对于CD4 T细胞的恢复并不比一次高压氧治疗具有更好的效果。与未产生高炎症反应的高压氧处理大鼠组(D0组)比较,三次高压氧(E组)明显上调TNF-α(P<0.01)、IL - 6(P<0.05)和下调IL-10(P<0.05)。因此,在无高炎症反应时,三次高压氧治疗较一次有更明显的促炎症作用(图3)。由于E组未出现高炎症反应大鼠,可以推断,三次高压氧在减轻高炎症反应方面可能比一次更有效。
3 讨论
研究表明酵母多糖致大鼠SIRS严重程度具有剂量依赖性[5-6],本实验参考相关文献[7-10]选取500 mg/kg体重进行酵母多糖腹腔注射,但只有部分大鼠出现高炎症反应。这一现象可以由SIRS的发生机制来解释。根据Bone的SIRS5个时期的分期理论[4-5],在本实验中,同对照组(A组)相比注射酵母多糖大鼠(C0组)的细胞因子没有明显增多意味着仅处于SIRS的第一阶段,即局限性炎症反应阶段,另一部分大鼠(C1组)则出现经典SIRS,所以我们能在循环中检测出高水平的细胞因子。经典SIRS发生机制可能具有类似“全或无”效应。当刺激强度不足以使所有大鼠均发生过度炎症反应时,具有较强抵抗力的动物仅处于SIRS第1期,表现为局部炎症反应。我们推测引起不同反应的差异主要在于免疫功能,但其中不一定与经典的CD4,CD8T细胞直接相关,因为本实验中CD4,CD8T细胞比例在所有注射酵母多糖的大鼠中均减少,其程度与是否出现高炎症反应无相关。说明CD4,CD8T细胞是比细胞因子更早反应的免疫细胞,在未出现全身炎症反应时已经受累,并且可能这种受累是相对独立的,不因炎症反应的加重而加重。推测CD4、CD8T细胞的这种减少可能是在对抗局部炎症反应过程中消耗的,也有可能是SIRS本身引起的细胞凋亡,并认为这种凋亡可能是全身炎症反应中调节促炎与抗炎反应平衡的关键因素[11-13]。
高压氧对正常机体和疾病状态机体表现出截然不同的作用[14]。一方面,在机体处于高炎症状态时,高压氧可以减少炎症介质的合成和释放,增加SOD活性,清除过多氧自由基,减轻脂质过氧化,提高脓毒症生存率,改善缺血再灌注损伤[10,14-18]。另一方面,高压氧对内源性免疫和适应性免疫产生广泛抑制。包括减少抗原合成,抑制B细胞产生抗体;损伤Th1型细胞介导的促炎型免疫反应;高压氧可以非特异性刺激T细胞产生大量IL-10,以产生强大的免疫抑制作用[18-19]。在本实验中,高压氧对健康组大鼠(B组)和酵母多糖组(D组和E组)大鼠有不同的作用效果,类似 “双刃剑”作用。造成高压氧这种“双刃剑”作用的原因可能是:a)压力, 2.5ATA高压氧时脓毒症大鼠病死率降低,3ATA时病死率明显增高,说明高压氧和免疫功能改变之间可能存在剂量-依赖关系[14,16,20];b)暴露时间,有体外实验显示[18],高压氧在最初的几个小时可以使外源性刺激后TNF-α的合成减少,但是长时间暴露之后其合成又表现出显著的增加[16]。
短暫的高压氧暴露作为一种细胞信号刺激可通过影响IL-10的产生来发挥其作用[14],其机制可能是直接影响IL-10的基因转录或是通过增加或抑制其他的细胞因子来间接改变分泌IL-10 细胞的表型[21]。有研究表明,高压氧可以影响巨噬细胞在细胞氧化状态下的表型。巨噬细胞可被分类为还原型巨噬细胞或氧化型巨噬细胞,氧化型巨噬细胞受刺激后表达IL-6和IL-10增强,还可以引导Th2型T细胞反应,具有明显的抗炎作用[22]。但高压氧介导的IL-10变化并不都是由巨噬细胞特异性完成的,IL-10可以由许多细胞型产生,包括树突细胞、T细胞、B细胞[14],说明高压氧对免疫细胞没有特殊的影响。高压氧暴露后,由单核巨噬细胞系统受刺激产生的促炎性细胞因子明显减少。高压氧可诱导抗氧化酶和具有抗炎作用的蛋白[23]。高压氧通过抑制cox-2表达从而下调前列腺素E2的产生,或诱导热休克蛋白的合成来抑制TNF-α的产生[16]。刺激迷走神经也可以明显抑制脓毒症时TNF的合成和释放[24]。在本实验中,单次高压氧暴露就具有明显的抗炎以及恢复CD4T细胞的作用,说明高压氧这种有益作用可以长期持续[25]至少24 h。虽然一次高压氧同三次高压氧的作用无统计学差异,但三次高压氧治疗组未现出高炎症反应大鼠,这说明在抑制高炎症爆发方面,三次高压氧比一次高压氧可能更有效。
高压氧抑制TNF-α和IL-6增多的作用可能拓展出一个新的临床应用方向——慢性炎症性疾病,这是一类背景不同、症状各异但病理基础相似的疾病。在慢性炎症疾病中,几乎都有不同程度的循环TNF-α和IL-6水平升高[26]。笔者推测高压氧引起的抗炎作用是非特异性的,虽然具体机制尚不完全清楚,但至少提示了高压氧对各种急慢性以炎症反应为主要临床特点的疾病可能具有普遍的辅助治疗意义。
參考文献
[1]Noori A, Glenn B, Richard P, et al. Hyperbaric oxygen and lymphoid system function: A review supporting possible intervention in tissue transplantation [J]. Technol Health Care, 2006, 14(6): 489-498.
[2] Oter S, Radermacher P, Matejovic M. Can (hyperbaric) oxygen turn off the motor of multiorgan dysfunction ?[J]. Intensive Care Med, 2006, 32(11): 1694-6.
[3] 邱春兰.全身炎症反应综合征发病机制研究进展[J]. 西部医学, 2009, 21(4): 662-666.
[4] 田中秋,邓立普. TNF-α、IL-6在全身炎症反应综合征表达的研究进展[J]. 蛇志, 2008, 20(4): 275-278.
[5] 孙琦,汤仁仙,范兴丽,等.葛根素对炎症反应综合征大鼠的治疗作用[J]. 中华急诊医学杂志, 2008, 17(2): 158-161.
[6] 朱庆磊,钱小顺,杨洁,等.酵母多糖致老年大鼠多器官功能不全模型细胞因子的变化[J]. 中国老年学杂志, 2007, 27(7): 618-619.
[7] Imperatore F, Cuzzocrea S, Luongo C, et al. Hyperbaric oxygen therapy prevents vascular derangement during zymosan-induced multiple-organ-failure syndrome [J]. Intensive Care Med, 2004, 30(6): 1175-1181.
[8] Imperatore F,Cuzzocrea S,De Lucia D,et al. Hyperbaric oxygen therapy prevents coagulation disorders in an experimental model of multiple organ failure syndrome [J]. Intensive Care Med, 2006, 32(11): 1881-1888.
[9] 黄志英.感染性休克研究进展[J]. 中国卫生检验杂志, 2009, 19(3): 709-711.
[10]Luongo C, Imperatore F, Cuzzocrea S, et al. Effects of hyperbaric oxygen exposure on a zymosan-induced shock model [J]. Crit Care Med, 1998; 26(12): 1972-1976.
[11] 曲度,胡葆枫,曲强,等. 多系统危象综合征、机体损伤反应综合征细胞生物学机制(淋巴细胞及其辅助 T细胞作用—兼述SIRS、CARS与MARS问题) [J]. 黑龙江医学, 2007, 32(11): 801-807.
[12] 罗锐军,苏磊,刘志锋.脓毒症免疫抑制的细胞机制[J].岭南急诊医学杂志, 2009, 14(2): 157-158.
[13] 许国根, 王弋, 缪群,等. 全身炎症反应综合征患者抗炎因子对T淋巴细胞凋亡的影响[J]. 中华急诊医学杂志, 2002, 11(4): 249-251.
[14] Jon A. Buras, Douglas Holt, Daniel Orlow, et al. Hyperbaric oxygen protects from sepsis mortality via an interleukin-10-dependent mechanism [J]. Crit Care Med, 2006, 34(10): 2624-2629.
[15] 王林贵,淤淑英,王钢. 高压氧对失血性休克复苏后炎症反应的影响[J]. 中华急诊医学杂志, 2007, 16(12): 1283-1288.
[16] Benson RM, Minter LM, Osborne BA, et al. Hyperbaric oxygen inhibits stimulus-induced proin-flammatory cytokine synthesis by human blood-derived monocyte-macrophages [J]. Clin Exp Immunol, 2003, 134(1): 57-62.
[17] Bitterman H, Muth CM.Hyperbaric oxygen in systemic inflammatory response [J]. Intensive Care Med, 2004, 30(6): 1011-1013.
[18] Kudchodkar B, Jones H, Simecka J, et al. Hyperbaric oxygen treatment attenuates the pro-inflammatory and immune responses in apolipoprotein E knockout mice [J]. Clin Immunol, 2008, 128(3): 435-441.
[19] Ackland GL, Gutierrez Del Arroyo A, Yao ST, et al. Low-molecular-weight polyethylene glycol improves survival in experimental sepsis [J]. Crit Care Med, 2010, 38(2): 629-636.
[20] Xu WG, Tao HY, Liu Y, et al. Immune function in rats following repetitive exposures to 7 ATA air [J]. Aviat Space Environ Med, 2007, 78(4): 368-373.
[21] Oberholzer A, Oberholzer C, Bahjat KS, et al. Increased survival in sepsis by in vivo adenovirus-induced expression of IL-10 in dendritic cells [J]. J Immunol, 2002, 168(7): 3412-3418.
[22] Grünenfelder J, Miniati DN, Murata S, et al. Up-regulation of Bcl-2 through hyperbaric pressure transfection of TGF-a ameliorates ischemia-reperfusio injury in rat cardiac allografts [J]. J Heart Lung Transplant, 2002, 21(2): 244-250.
[23] Thom SR. Oxidative stress is fundamental to hyperbaric oxygen therapy [J]. J Appl Physiol, 2009, 106(3): 988-995.
[24] Tracey KJ.Physiology and immunology of the cholinergic antiinflammatory pathway [J]. J Clin Invest, 2007, 117(2): 289-296.
[25] Pedoto A, Nandi J, Yang ZJ, et al. Beneficial effect of hyperbaric oxygen pretreatment on lipopolysaccharide-induced shock in rats [J]. Clin Exp Pharmacol Physiol, 2003, 30(7): 482-488.
[26] Ploeger HE, Takken T, de Greef MH. The effects of acute and chronic exercise on inflammatory markers in children and adults with a chronic inflammatory disease: a systematic review [J]. Exerc Immunol Rev, 2009, 15(1): 6-41.
(收稿日期:2012-04-01)
(本文编辑:何小军)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.011
作者单位:110001 沈阳,中国医科大学附属第一医院急诊科(刘志红、王钢);沈阳市苏家屯区中心医院(冯芳)
通信作者:王钢,Email:wg5385@sohu.com
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P846-850

