多器官功能障碍综合征大鼠肾组织细胞外基质损伤
袁玉荣 滕林 余旻 刘先哲

【摘要】目的 检测Ⅳ型胶原及基质金属蛋白酶-9在多器官功能障碍综合征(MODS)大鼠肾组织及血清中变化,探讨细胞外基质的破坏与MODS肾功能衰竭的关系。方法 实验在三峡大学医学院实验中心完成。将40只成年雄性SD大鼠(随机数字表法)分为健康对照组(8只)、MODS模型组(32只),模型组又分为造模后6、12、24、48 h不同时点,每组8只。 采用“二次打击”即眼球失血加腹腔注射脂多糖(LPS)制备MODS模型:大鼠左眼球取血2 ml/100g,在放血4 h后予无菌腹腔注射LPS 5 mg/kg。对照组予以腹腔注射等量的生理盐水,造模完成后在不同的时相点搜集标本。血生化检测各组血清肌酐(Cr)及尿素氮(BUN)的变化;光镜及电镜观察肾组织的形态及超微结构变化;酶联免疫吸附试验(ELISA)法检测血清中Ⅳ型胶原及MMP-9的浓度变化;western印迹技术测定肾组织中Ⅳ型胶原及MMP-9的蛋白水平。组间比较采用单因素方差分析(SNK法)。结果 (1)与对照组相比,MODS组各个时点肾功能损害较为明显,Cr及BUN均明显增高(P<0.05)。(2)光镜下对照组肾组织结构无改变;MODS组肾组织损伤较重。电镜下对照组肾组织基底膜胶原纤维连续完整,MODS组肾组织基底膜水肿、胶原纤维分布缺损明显。(3)与对照组比较,造模后6~48 h,MODS组大鼠血清中MMP-9水平均明显增高,于造模后12 h达到高峰(P<0.05)。造模后血清Ⅳ型胶原的质量浓度各组均高于对照组,6~12 h组升高不明显(P>0.05),24~48 h显著高于对照组(P<0.01)。(4) 造模后肾组织MMP-9的浓度6~12 h比对照组明显增加(P<0.01),24 h达到高峰(P<0.01),随后48 h下降。造模后各组肾组织Ⅳ型胶原的质量浓度均较对照组明显降低 (P<0.05)。结论 细胞外基质的破坏是引起MODS肾损伤的一个重要因素,可能成为MODS 早期肾功能损害的诊疗和干预靶点。
【关键词】多器官功能障碍综合征;基质金属蛋白酶-9 ;内皮细胞;细胞外基质;Ⅳ胶原;脂多糖;全身炎症反应综合征;二次打击;大鼠
Observation of extracellular matrix damage in the kidney of rats with multiple organ dysfunction syndrome YUAN Yu-rong, TENG Lin,YU Min, LIU Xian-zhe. The People's Hospital of Three Gorges University, The first People's Hospital of Yichang , Yichang 443000, China
Corresponding author: LIU Xian-zhe, Email: yxylxz@ctgu.edu.cn
【Abstract】Objective To determine the levels of type Ⅳ collagen and matrix metalloproteinase-9(MMP-9)in the serum and kidney of rats with the multiple organ dysfunction syndrome (MODS)and investigate the mechanism of extracellular matrix damage in renal failure of MODS. Methods Forty adult male Sprague-Dawley(SD)rats were randomly (ramdom number) divided into two groups, namely the normal control group (n=8) and the MODS model group (n=32). The rats of model group were further divided into four sub-groups as per different intervals, 6 h, 12 h, 24 h and 48 h, after modeling (n=8 in each). The animal models of MODS were established by two hits, the left eyeball of each model rat was removed to bleed to 2 ml blood/100 g body weight and lipopolysaccharide (LPS, 5 mg/kg) was injected into intraperitoneal cavity of model rats four hours later. The same volume of saline instead was injected intraperitoneally into rats of control group. All rats were sacrificed at different intervals. Creatinine (Cr)and blood urea nitrogen (BUN) were determined by using a Hitachi Automatic Biochemical Analyzer. The histological changes in renal tissue were observed under light microscope and transmission electronic microscope. The levels of serum type Ⅳ collagen and MMP-9 protein were measured by using enzyme linked immunosorbent assay (ELISA). Type Ⅳ collagen and MMP-9 protein levels in renal tissue were detected by western blot. One-way ANOVA was used for comparison among multiple groups. Results Compared with the control group, Cr and BUN were significantly higher in MODS group (P<0.05). There were no histopathological changes in kidney of rats in control group, and the renal injury was serious in rats with MODS. The remarkable edema of basement membrane and defect of collagen fibers in renal tissue were observed in MODS group. Compared with the control group, the levels of MMP-9 in serum increased 6-48 hours after modeling and peaking at interval of 12 hours after modeling (P<0.05). The protein levels of type Ⅳ collagen increased not significantly in 6 h group and 12 h group in comparison with control group (P>0.05), while those in 24 h group and 48 h group significantly increased (P<0.01). The levels of MMP-9 in renal tissue of rats with MODS increased in 6 h group and 12 h group(P<0.05), peaked in 24 h group(P<0.05), and decreased in 48 hours. However, the level of Ⅳ collagen in serum of rats with MODS decreased significantly 6-48 hours after modeling(P<0.05) Conclusions The injury of extracellular matrix is an important factor to the kidney damage in MODS and it may be used for early diagnose and as a treatment target for kidney injury in MODS.
【Key words】Multiple organ dysfunction syndrome;Matrixmetalloproteinase-9;Endothelial cell;Extracellular matrix; Collagen Ⅳ; Lipopolysaccharide; Systemic inflammatory response syndrome;Two hits;Rat
多器官功能障碍综合征是临床危重患者死亡的主要原因之一[1]。业已证明,内皮细胞的激活和损伤是引起MODS器官功能障碍的基础[2-4] , 而细胞外基质(ECM)作为内皮细胞直接生存和活动的场所,对细胞的一切生理活动具有重要的影响,目前关于ECM的损伤在MODS病理过程中的作用及其与组织器官损伤衰竭之间的关系仍不清楚。笔者以往的临床和基础研究发现,通过对脓毒症和MODS发病过程中内皮损伤及降解ECM的主要标志物——血栓调节蛋白(TM)以及基质金属蛋白酶-9(MMP-9)的检测,初步验证了内皮细胞和ECM的损害可能是导致MODS器官损伤的共同环节[5-8] 。
ECM 由胶原、非胶原糖蛋白和蛋白多糖构成,在胶原成分中,最重要的是Ⅳ胶原蛋白,是ECM主要骨架蛋白之一。Ⅳ型胶原是典型的基质胶原,在肾组织中可由活化的肾小球系膜细胞、内皮细胞、上皮细胞、肾小管上皮细胞等合成和分泌[9]。因此,Ⅳ型胶原的合成及降解是许多肾脏疾病发展、ECM 损伤、终至肾小球硬化和肾间质纤维化的主要原因或重要参与因素之一。MMP-9作为ECM的主要降解酶之一,其主要作用底物正是ECM中的结构成分Ⅳ型胶原,目前关于MODS时直接观察损伤衰竭器官ECM的状态改变国内外尚未见报道。因此,本研究在前期研究的基础上,选择了Ⅳ型胶原作为观察ECM损伤的指标,并与其主要的降解酶MMP-9同时检测分析,进一步探讨ECM的破坏在MODS肾功能衰竭中的作用。
1 材料与方法
1.1 实验动物
40只健康雄性Sprague-Dawley(SD)大鼠,体质量250~300 g,由华中科技大学同济医学院动物实验中心提供,符合国家医用动物使用标准(许可证号:SCXK(鄂)2010-0007,等级:SPF),动物予以标准饲料喂养,自由摄食饮水,22~30 ℃条件下饲养两周后实验,实验前禁食12 h,禁饮4 h。
1.2 材料
脂多糖(LPS,E.coli.O55:B5)由美国Sigma公司提供;血清MMP-9 及Ⅳ型胶原ELISA试剂盒由上海西唐生物科技有限公司提供;MMP-9、Ⅳ型胶原抗体由武汉博士德试剂公司提供。日本Olympus公司光学显微镜,日本日立公司H-7500透射电镜,美国宝特800酶标仪,德国Leica公司TP1020型脱水机、德国Leica公司CM1800型恒冷箱切片机、德国Leica公司DMR型多功能显微镜及图象分析系统。
1.3 动物的分组和模型制备
实验动物称重后按随机数字表法将大鼠分为健康对照组(8只)、MODS模型组(32只),模型组又分为造模后6,12,24,48 h不同时相,每组8只。参照并改良陈德晖等 [10]“二次打击”方法和标准制备MODS大鼠模型:采用左眼球取血2 ml/100 g,4 h后以5 mg/kg无菌腹腔注射LPS。对照组予以腹腔注射等量的生理盐水。造模后在各时相点将动物腹腔注射3%戊巴比妥钠(30 mg/kg)麻醉后,常规消毒皮肤, 对应时间点迅速打开胸腔及腹腔,立即心脏采血4 ml,离心提取血清,冰箱保存,备查MMP-9及Ⅳ型胶原。取肾脏,用生理盐水洗去血液,按免疫组化、光镜及电镜切片要求,取适量肾组织,置于10%甲醛溶液固定,尽量做到取材部位大致相同。
1.4 肾功能测定
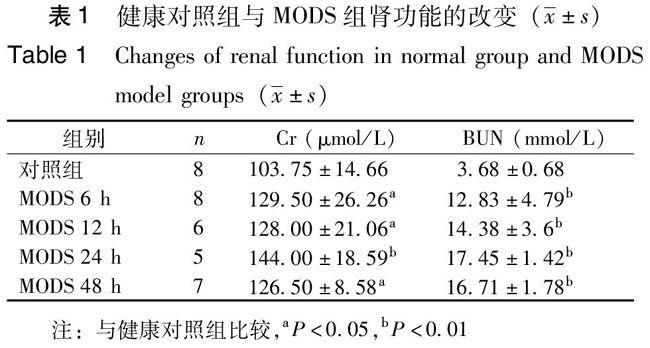
采用全自动生化分析仪检测各組大鼠血清肌酐(Scr)及尿素氮(BUN)。
1.5 肾脏病理形态学检查
(1)光镜观察 将所取肾组织浸泡在10%中性甲醛中固定24 h,常规梯度酒精脱水,二甲苯透明,石蜡包埋,作厚为4 μm的连续切片。切片贴于经10%多聚赖氨酸处理过的玻片,60 ℃烤片过夜,HE染色,在光镜下观察其组织形态学改变。
(2)透射电镜观察 标本经2.5%戊二醛前固定,1%的锇酸缓冲液4 ℃后固定2 h,乙醇梯度脱水,环氧树脂(Epon812)渗透,平板包埋,用超薄切片机切厚约70 nm的超薄切片,载膜铜网捞片,醋酸双氧铀和柠檬酸铅双重染色,透射电镜观察各组肾组织超微结构并摄片。
1.6 ELISA检测血清中MMP-9及Ⅳ型
胶原的水平严格按照ELISA试剂盒操作说明书进行检测。(1)建立标准曲线。(2)试剂盒平衡至室温,配置工作液。(3)加入100 μl标准品、血清于反应板孔中,将反应板充分混匀后置37 ℃120 min。(4)洗板:用洗涤液将反应板充分洗涤5次,向滤纸上印干。(5)每孔加入第一抗体工作液Biotinylated Antibody 100 μl ,将反应板充分混匀后置37 ℃ 60 min后洗涤5次。(6)每孔加酶标抗体工作液Enzyme Conjugate 100 μl。将反应板置37 ℃ 30 min,再洗涤5次。(7)每孔加入底物工作液TMB Solution 100 μl,置37 ℃暗处反应15 min。(8)每孔加入100 μl终止液,30 min内用酶标仪在450 nm处测吸光值。ELISA结果计算与判断:所有OD值减除空白值后再行计算,以标准品20、10、5、2.5、1.25、0.625、0.312、0 ng/ml为横坐标,OD值为纵坐标,在坐标纸上作图,画出标准曲线。根据样品OD值在该曲线图上查出相应含量以OD值为纵坐标,以标准品浓度为横坐标,绘制标准曲线,根据OD值在标准曲线上查出相应的浓度。
1.7 western印迹技术检测肾组织中MMP-9
及Ⅳ型胶原的蛋白水平应用western印迹技术检测肾组织中MMP-9及Ⅳ型胶原的蛋白表达。组织块用冷TBS洗涤2~3次,去除血污,剪成小块置于匀浆器。加入10倍组织体积组织裂解液体,提取组织总蛋白溶液, 采用Bradford方法进行蛋白定量。制备分离胶进行电泳,每孔加入蛋白含量约20 μg,8%质量浓度的SDS-PAGE电泳后PVDF转膜。5%脱脂奶室温封闭1 h后加入一抗(1∶ 200稀释),4℃摇床过夜,用TBST室温下脱色摇床下洗涤3次,再加入生物素标记的二抗(1∶ 3000),摇床常温孵育1 h , TBST洗涤,ECL发光,X线底片曝光, 显影及定影, 条带的灰度值以β-actin作为内参。对电泳条带扫描及图像分析,重复3次后得出条带的平均吸光度(A)分析。
1.8 统计学方法
所有数据采用SPSS 17.0软件包进行统计分析,计量数据用均数±标准差(x±s)表示,先进行数据的正态分布检验(Kolmogorov-Smirnov),方差齐性检验,组间比较采用单因素方差分析(SNK-q法),以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠基本情况
对照组大鼠无死亡,MODS模型组12 h死亡2只,24 h死亡3只,48 h死亡1只。对照组活动如常,精神可,无拉稀便。6~24 h存活大鼠均精神萎靡,少动,反应迟钝;毛松,毛色无光泽;拉稀便,进食少,体质量减轻。48 h组动物有所恢复,精神状态开始好转,毛色转有光泽。
2.2 对照组与MODS组肾功能的变化
与对照组相比较,MODS模型组各时间点Cr及BUN均显著升高(P<0.05),24 h肾功能损害达到高峰(P<0.01),其后48 h组有所下降,但仍高于对照组(P<0.05)。见表1。
2.3 对照组与MODS组肾组织病理形态学检查
2.3.1 光镜观察 对照组肾小球、肾小管结构基本正常。6 h可见肾单位萎缩,大小不一,部分代偿性扩大。12~24 h肾小球毛细血管多扩张充血,出血,毛细血管腔内有中性粒细胞浸润。系膜细胞轻至中度增生,系膜区扩大。肾小管内皮细胞显示广泛而显著的浊肿、空泡变性和坏死,肾间质及集合管血管扩张,充血。48 h肾小球扩张充血,少部分肾小球萎缩,肾小管上皮轻度浊肿。见图1。
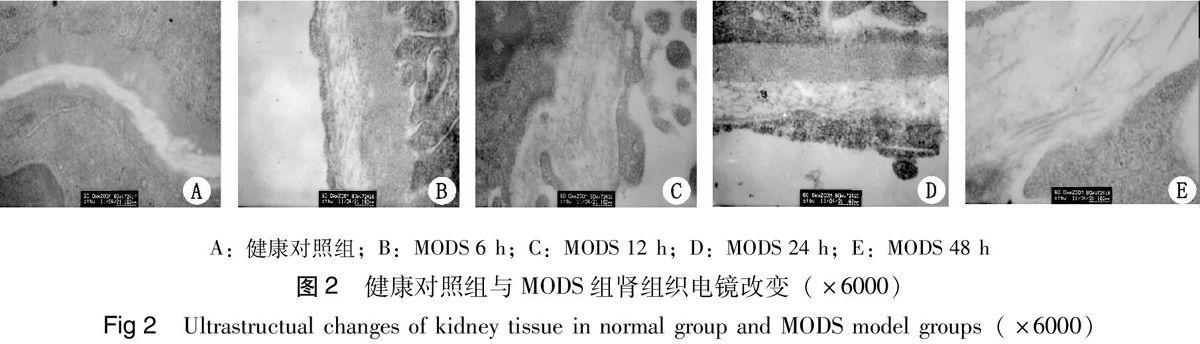
2.3.2 电镜观察 电镜下对照组基底膜胶原纤维连续完整,近、远曲小管细胞规整,近曲小管细胞微绒毛排列整齐紧密,线粒体无肿胀,基质丰富均匀,肾小球滤过膜3层结构完整清晰。6 h可见基底膜疏松轻度水肿,近曲小管上皮细胞微绒毛轻度肿胀增粗, 肾小球基本正常。12~24 h可见肾组织基底膜水肿、胶原纤维分布缺损明显。大部分肾小球上皮细胞足突有不规则融合。上皮细胞变性、坏死,肾小球毛细血管内皮细胞基质水肿, 个别退变坏死;48 h仍可见肾小球毛细血管内皮细胞及足突水肿,基底膜胶原纤维稀疏。见图2。
2.4 血清中MMP-9及Ⅳ型胶原的蛋白质量浓度变化
与对照组比较,造模后6~12 h,MODS组大鼠血清中MMP-9质量浓度即高于对照组(P<0.05),于造模后12 h达到高峰(P<0.01),24~48 h开始下降,但仍然高于对照组(P<0.01)。见图3。造模后血清Ⅳ型胶原的质量浓度各组均高于对照组。6~12 h开始升高,但幅度较缓,与对照组比较,差异无统计学意义(P>0.05),24 h升高明显(P<0.01),至48 h上升变缓,但仍显著高于对照组(P<0.01)。见图4。
2.5 肾组织MMP-9及Ⅳ型胶原的蛋白表达
各组大鼠肾组织中均能观察到MMP-9的蛋白表达,与对照组比较,在造模后6~12 h MMP-9的浓度比对照组明显增加(P<0.01),24 h达到高峰(P<0.01),随后48 h下降,仍显著高于对照组(P<0.01)。见图5。与对照组相比,造模后各组肾组织Ⅳ型胶原的质量浓度明显降低,6 h组与对照组比较,差异具有统计学意义(P<0.05),其最低值见于造模后24 h(P<0.01),至48 h肾组织Ⅳ型胶原的质量浓度有轻度升高,但仍显著低于对照组(P<0.01)。见图6。
3 讨论
MMPs是一组能降解ECM分子的锌依赖性蛋白酶,对ECM有广泛的降解作用是调节ECM动态平衡的最重要的一大酶系。在肾组织中,MMP-9主要由肾小球系膜细胞、肾小管上皮细胞、内皮细胞、巨噬细胞、中性粒细胞等合成及分泌[11]。Ⅳ型胶原是一种大分子物质,是基底膜的固有成分,也是构成肾小球ECM骨架的主要成分。MMP-9的水平可以反映肾基底膜胶原蛋白特别是Ⅳ型胶原的代谢状态,随着胶原合成增加及降解减少,MMP-9在血清中水平会相应降低和升高[12-13]。正常情况下MMP-9的表達量很少, 但在细菌毒素、细胞因子等外源性和内源性因素的刺激下, 活化的中性粒细胞、内皮细胞等可释放大量的MMP-9, 从而破坏血管基底膜及组织结构, 导致组织损伤[14-15];同时内皮细胞失去了生存和活动的依托, 促进了内皮细胞的凋亡, 使内皮细胞产生不可逆的损伤[16-17]。
在本研究中造模后不同时相点肾组织Ⅳ型胶原的质量浓度均比对照组明显降低,且电镜观察发现,MODS组肾组织基底膜水肿、胶原纤维分布稀疏,部分缺损明显,提示在MODS病变发生发展过程中存在Ⅳ型胶原代谢及调节异常情况。在靶器官内皮损伤的过程中,伴随着细胞外骨架蛋白Ⅳ型胶原的破坏,且随着时间的延长,Ⅳ型胶原的组织浓度越来越低,说明ECM的破坏逐渐加重,而且与不同时相点的肾功能、病理损伤程度和表现相一致,研究结果表明,在MODS 肾衰竭发生的早期由于大量炎症介质的释放而导致ECM的破坏,ECM的破坏参与了MODS肾损伤至衰竭的病理过程。正常情况下血清中Ⅳ型胶原的浓度很低,在本研究中,MODS模型组血清Ⅳ型胶原的浓度伴随着病情的进展逐渐升高,在最初的6~12 h变化幅度较小,24 h显著增高并达到高峰,至48 h上升变缓,但仍显著高于对照组。已有报道证实在基底膜受到损伤时,Ⅳ型胶原从基底膜降解脱落,其抗原决定簇进入外周血中,通过放射免疫学检测可发现其血清浓度升高[17],这是ECM损伤的一面,与本实验检测的结果相一致。另外笔者考虑,在MODS病情发生发展的早期,由于受到外界因素导致内皮细胞和基质的损伤,机体保护性代偿机制来不及完善。但是随着外界刺激及病情的加重,机体出现了保护代偿性修复,体内有许多细胞合成分泌Ⅳ型胶原也相应增多,这也极有可能是机体防御性修复导致血清Ⅳ型胶原增高的因素之一。因此在本实验中观察到了Ⅳ型胶原血清学与组织中的浓度背道而驰的现象。作为ECM的主要降解酶之一,血清及肾组织中MMP-9质量浓度亦有显著性升高。在造模后6~48 h均高于对照组,而且血清和肾组织中的浓度在各个时相点的增加具有同步性,这说明在肾功能障碍的过程中,由于MMP-9的大量释放引起ECM降解导致肾脏损伤逐渐加重,ECM的破坏是引起MODS肾损伤并最终导致衰竭的密切相关因素,可以通过检测Ⅳ型胶原的浓度来反应ECM的破坏情况,对MODS 的组织器官功能损伤做出早期诊断,为及时干预ECM的过度降解、保护组织器官的功能提供重要依据。
参考文献
[1]周荣斌, 于学忠. 多器官功能障碍综合征——困惑与思考,挑战与对策[J]. 中华急诊医学杂志,2007,16(12):1237-1238.
[2] William CA. The role the endothelium in severe sepsis and multiple organ dysfunction syndrome [J]. Blood, 2003, 101 (23): 3765-3777.
[3] Hack CE, Zeerleder S. The endothelium in sepsis: source of and a target for inflammation [J]. Crit Care Med, 2001, 29 Suppl 7: 21-27.
[4] Vallet B. Bench-to-bedside review: endothelial cell dysfunction in severe sepsis: a role in organ dysfunction? [J]. Crit Care, 2003, 7(2): 130-138.
[5] 余旻, 刘先哲, 邓群,等. 血栓调节蛋白和基质金属蛋白酶在脓毒症及多器官功能障碍综合征中的意义[J]. 中华急诊医学杂志,2006,15(6):558-561.
[6] 滕林, 余旻, 李俊明,等. 多器官功能障碍综合征大鼠血清及肝组织中基质金属蛋白酶9的表达及意义[J]. 中国急救医学, 2011, 31(4):331-334.
[7] 滕林, 余旻, 李俊明,等. 基质金属蛋白酶9在多器官功能障碍综合征大鼠肾组织的表达[J]. 中华肾脏病杂志, 2010, 26(3):223-224.
[8] 滕林, 余旻, 李俊明,等. 多器官功能障碍综合征大鼠肺组织血栓调节蛋白和基质金属蛋白酶-9的表达[J]. 中华急诊医学杂志, 2009, 18(10): 1031-1036.
[9] Erickson AC, Couchman JR. Still more complexity in mammalian basement membranes [J]. J Histochem Cytochem., 2000, 48 (10): 1291-1306.
[10]陈德晖,黎毅敏,陈福雄,等. 两次打击大鼠所致多器官功能障碍综合征动物实验模型的建立及病理观察[J]. 热带医学杂志, 2006, 5(3): 273-275.
[11] Suzuki D, Miyazaki M, Jinde k,et al. In situ hybridization studies of matrix metalloproteinase. Tissue inhibitor of metalloproteinase-l and type Ⅳcollagen in diabetic nephropathy [J]. Kidney Int, 1997, 52(11):111-119.
[12] Sheu JR,Fong Th,Liu CM,et al.Expression of matrix metalloproteinase-9 in human platelets:regulation of platelet activation in in vitro and vivo studies[J]. Pharmacol, 2004,143(1):193-201.
[13] Wilson SR,Gallagher S,Warpeha K,et al.Amplification of MMP-2 and MMP-9 production by prostate cancercell lines via activation of protease-activated receptors[J] .Pro-state,2004,60(2):168-174.
[14] Brew K, Dinakarpandian D,Nagase H. Tissue lnhibitors of metalloproteinases: evolution , structure and function [J] . Biochim Biophys Acta , 2000 , 1477 (12) : 267-283.
[15] Gando S, Nanzaki S, Morimoto Y, et al. Out of hospital cardiac arrest increases soluble vascular endothelial adhesion molecules and neutrophil elastase associated with endothelial injury [J].Intensive Care Med, 2000, 26(1):38-44.
[16] Chen H, Inocencio R, Alam HB, et al. Differential expression of extracellular matrix remodeling genes in rat model of hemorrhagic shock and resuscitation [J].Surg Res , 2005 , 123 (2) : 235-244.
[17] 李敬兰,赵纯平,林治库,等.血清层粘连蛋白、透明质酸检测在癌症与肝病的临床意义[J].中国综合临床,2002,18(2):126-127.
(收稿日期:2012-01-04)
(本文编辑:何小军)
DOI:10.3760/cma.j.issn.1671-0282.2012.08.005:
作者单位:443000 湖北省宜昌,三峡大学人民医院/湖北省宜昌市第一人民医院(袁玉荣为三峡大学医学院硕士研究生,现在湖北枝江七星台医院工作,滕林为上海交通大学医学院2010级博士研究生,刘先哲、余旻)
通信作者:刘先哲,Email: yxylxz@ctgu.edu.cn
中华急诊医学杂志2012年8月第21卷第8期Chin J Emerg Med,August 2012,Vol.21,No.8
P819-824

