葡萄卷叶伴随病毒4和5简并引物和多重PCR检测
范旭东, 董雅凤, 张尊平, 任 芳, 裴光前
(中国农业科学院果树研究所国家落叶果树脱毒中心,兴城 125100)
葡萄卷叶病在全世界普遍发生,危害极其严重。现已报道的葡萄卷叶伴随病毒共有11种,分别为GLRaV-1~9、GLRaV-Dr和 GLRaV-De[1]。裴 光前[2]等人于2010年在国内首次报道了葡萄卷叶伴随病毒4和5,至此我国已鉴定明确的葡萄卷叶伴随病毒种类共有6种,即GLRaV-1~5和7。目前,检测葡萄卷叶病毒的方法主要有指示植物法、酶联免疫吸附法(ELISA),反转录聚合酶链式反应(RTPCR)和实时荧光PCR法。指示植物法是把待检材料嫁接到敏感寄主上,通过寄主症状表现来鉴定其带毒情况。指示植物法不能有效地区分葡萄卷叶伴随病毒的种类,且耗时较长。目前,国内外已经制备出多种葡萄卷叶伴随病毒抗体,用于ELISA检测[3-5]。ELISA 方 法 可 以短时间 内 检 测 较 多 的 样品,但需要依赖商品化检测试剂盒,费用较高,且灵敏度不及RT-PCR方法。RT-PCR具有快速、高效、灵敏的特点,已广泛运用于葡萄卷叶病毒的检测[6-7]。实时荧光 PCR 法是在 RT-PCR方法基础上发展起来的一种可以封闭、实时定量的检测方法,具有较高的灵敏度,目前主要运用于单一葡萄病毒的检测[8]。采用简并引物和多重PCR可以同时检测2种以上病毒,能够大幅度提高检测效率,降低检测费用。对于葡萄卷叶伴随病毒的相关研究已有部分报道[2,10-11],但针对 GLRaV-4和5的研究报道极少[9]。我国葡萄卷叶伴随病毒4和5的研究刚开始起步,简便、快速、灵敏、高效的检测方法的建立对今后这两种病毒的田间调查及脱毒检测具有重要意义。因此,作者在前人研究的基础上,研究建立了GLRaV-4和5快速、灵敏、可靠的简并引物和多重PCR检测方法。
1 材料和方法
1.1 材料
1.1.1 葡萄样品
2010年于中国农业科学院果树研究所国家落叶果树脱毒中心样品保存圃采集健康及带卷叶病症状的葡萄休眠枝条,于4℃冰箱内保存待用。上述样品均采用ELISA和单一PCR方法明确了携带葡萄卷叶伴随病毒的状况[7]。
1.1.2 试剂
PCR Fragment Recovery Kit、pMD18-T Vector和感受态细胞DH5α购自大连宝生物公司(TaKa-Ra),M-MLV逆转录酶购自普洛麦格(Promega)公司。10×PCR Buffer(含20mmol/L Mg+)、Taq酶、dNTPs购自北京鼎国昌盛生物技术有限公司。DNA Mark-D、Random Primer 6购自生工生物工程(上海)有限公司。
1.1.3 引物
GLRaV-4引物为 5′-CTCAAACCAGCGGCTGTTG-3′ 和 5′-GTGATACCATATACATACCGACC-3′[9],GLRaV-5引物为5′-CCCGTGATACAAGGTAGGACA-3′和 5′-CAGACTTCACCTCCTGTTAC-3′[10],GLRaV-4和5简并引物为5′-TAGACAACCATGTAYTCTATG-3′和5′-GGTATGAACAARTTCAATGC-3′[9]。上述引物均由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 RNA提取与cDNA合成
刮取葡萄休眠枝条韧皮部100mg,采用二氧化硅吸附法[12]进行总RNA提取。反转录在1.5mL灭菌离心管中进行,依次加入纯水9.0μL、Random Primer 6 1.0μL、总 RNA 5.0μL,离心混匀,95 ℃水浴5min,冰上放置2min。加入5×M-MLV buffer 5.0μL、10mmol/L dNTPs 1.5μL、200U/μL MMLV逆转录酶0.8μL、灭菌纯水2.7μL。37℃水浴10min,42℃水浴50min,70℃水浴5min。立即用于PCR扩增或-20℃保存。
1.2.2 PCR反应体系
单一PCR反应体系(25μL):含10×Taq酶buffer 2.5μL、10μmol/L dNTPs 0.5μL、10μmol/L互补引物各0.5μL、5U/μL Taq酶0.375μL、模板cDNA 2.5μL、灭菌纯水18.125μL。PCR反应程序为:94℃5min;94℃40s,56℃45s,72℃1min,循环35次;72℃7min;4℃终止反应。
多重PCR反应体系(25μL):含10×Taq酶buffer2.5μL、10μmol/L dNTPs 1μL、10μmol/L互补引物(2对)各0.5μL、5U/μL Taq酶0.5μL、模板cDNA 5μL、灭菌纯水14μL。PCR反应程序与单一PCR相同。
简并引物PCR反应体系与单一PCR反应体系相同。PCR反应程序为:94℃5min;94℃40s,50℃45s,72℃1min,循环35次;72℃7min;4℃终止反应。
1.2.3 三种PCR反应体系检测灵敏度比较
将提取的总RNA依次稀释至10-1~10-6倍,反转录成cDNA,分别采用单一、多重、简并引物PCR反应体系进行扩增,比较其检测灵敏度。
1.2.4 简并引物的特异性
采用简并引物对16个携带 GLRaV-1、2、3、4、5、7的葡萄样品进行RT-PCR检测,扩增获得的目的条带切胶回收后,克隆测序,以明确简并引物扩增产物的特异性。
2 结果
2.1 三种PCR反应体系检测灵敏度
单一PCR结果显示GLRaV-4扩增片段为442 bp,GLRaV-5扩增片段为690bp,可以检测出GLRaV-4和5的RNA最高稀释倍数为10-4(图1a和b)。多重PCR能够同时扩增出GLRaV-4和5,能够检测出GLRaV-4和5的RNA最高稀释倍数为10-4(图1c)。采用简并引物从携带GLRaV-4和5的样品中扩增出371bp的目的片段,能检测出上述2种病毒的RNA最高稀释倍数也为10-4(图1d和e)。上述结果表明,三种PCR反应体系检测GLRaV-4和5的灵敏度相同。
2.2 简并引物的特异性
采用简并引物对16个分别带有GLRaV-1、2、3、7、4、5的样品进行 RT-PCR扩增,结果显示:阴性样品、1~3号样品(携带 GLRaV-1)、4~6号样品(GLRaV-2)、7~9号样品(GLRaV-3)和10~12号样品(GLRaV-7)均未扩增出371bp的目的片段。仅13~14号样品(GLRaV-4)和15~16号样品(GLRaV-5)扩增出371bp的目的片段,表明该简并引物仅能对GLRaV-4、5进行有效扩增(图2)。克隆测序结果也表明,扩增获得的目的片段为GLRaV-4和5的特异性片段。其中GLRaV-5基因序列 登 录 号 为 JN226658 (590bp)、JN226660(371bp)、JN226661(371bp);GLRaV-4基因序列登录号为JN226659(442bp)、JN226662(371bp)、JN226663(371bp)。
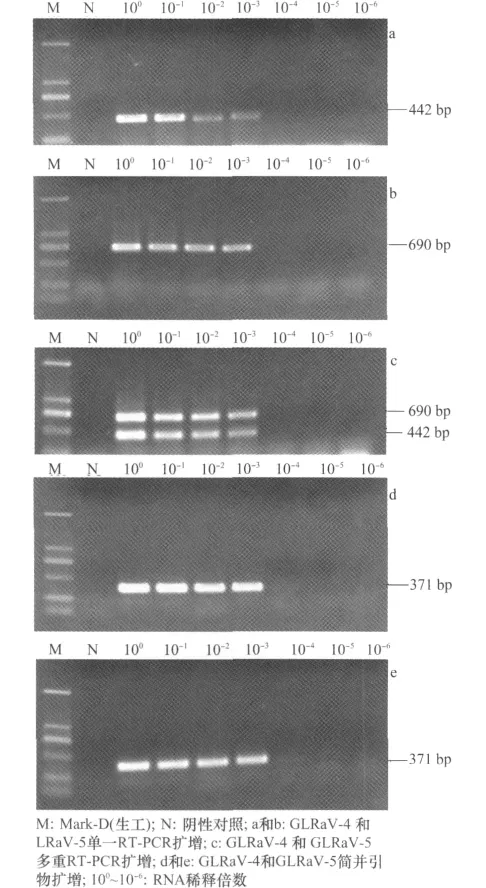
图1 单一、多重、简并PCR灵敏度比较
3 讨论
本研究采用二氧化硅吸附法提取总RNA,建立了GLRaV-4和5简并引物和多重RT-PCR检测方法。二氧化硅吸附法可以快速获得高质量的RNA[13]。采用建立的多重PCR检测方法能同时鉴定这两种病毒,节约检测时间及费用,并且其检测灵敏度不低于单一PCR方法。本文采用Routh等人[9]已报道的简并引物,对GLRaV-4和5检测灵敏度与单一PCR相同,特异性测试表明该简并引物仅能对GLRaV-4、5为阳性的样品进行有效扩增,能够运用于脱毒工作中这两种病毒的检测,提高检测效率。本试验所用引物的PCR扩增产物经过克隆、测序验证,均为特异性片段。综上所述,本研究为上述两种葡萄卷叶伴随病毒的田间调查和脱毒样品检测提供了更加简便、快速、灵敏、高效的检测手段。

图2 简并引物特异性测试结果
[1] Maliogka V I,Dovas C I,Katis N I.Evolutionary relationships of virus species belonging to a distinct lineage within the Ampelovirus genus[J].Virus Research,2008,135:125-135.
[2] 裴光前,董雅凤,张尊平,等.四种葡萄卷叶病毒多重RT-PCR检测[J].植物病理学报,2010,40(1):21-26.
[3] Forsline D L,Hoch J,Lamboy W F,et al.Comparative effectiveness of symptomatology and ELISA for detecting two isolates of grapevine leafroll on graft-inoculated cabernet franc[J].American Society for Enology and Viticulture,1996,47:239-243.
[4] Rowhani A,Uyemoto J K,Golino D A.A comparison between serological and biological assays in detecting grapevine leafroll associated viruses[J].Plant Disease,1997,81:799-801.
[5] 徐章逸,王国平,刘亚萍,等.葡萄卷叶伴随病毒-3外壳蛋白的原核表达及其特异性抗血清的制备[J].植物病理学报,2010,40(2):129-134.
[6] Rowhani A,Biardi L,Johnson R,et al.Simplified sample preparation method and one-tube RT-PCR for grapevine viruses[C]∥Proceedings of XIII International Council for the Study of Viruses and Virus-like Diseases of the Grapevine,Adelaide,2000:82.
[7] 裴光前,董雅凤,张尊平,等.我国葡萄主栽区卷叶病相关病毒种类的检测分析[J].果树学报,2011,28(3):463-468.
[8] Osman F,Leutenegger C,Golino D,et al.Real-time RT-PCR(TaqMan)assays for the detection of grapevine leafroll associated viruses 1-5and 9[J].Journal of Virological Methods,2007,141:22-29.
[9] Routh G,Zhang Y P,Saldarelli P,et al.Use of degenerate primers for partial sequencing and RT-PCR–based assays of Grapevine leafroll-associated viruses 4and 5 [J].Phytopathology,1998,88(11):1238-1243.
[10] Good X,Monis J.Partial genome organization,identification of the coat protein gene,and detection of Grapevine leafrollassociated virus-5[J].Phytopathology,2001,91:274-281.
[11] Gambino G,Gribaudo I.Simultaneous detection of nine grapevine viruses by multiplex reverse transcription-polymerase chain reaction with coamplification of a plant RNA as internal control[J].Phytopathology,2006,96:1223-1229.
[12] Foissac X,Svanella-dumasl,Dulucq M J,et al.Polyvalent detection of fruit tree tricho,capillo and foveraviruses by nested RT-PCR using degenerated and inosine containing primers(PDORT-PCR)[J].Acta Horticulturae,2000,550:37-44.
[13] 董雅凤,张尊平,刘凤之,等.沙地葡萄茎痘相关病毒RT-PCR检测[J].果树学报,2007,24(5):705-708.

