大肠癌Cyclin D1多态性及相关细胞周期蛋白表达的研究
任 鸿
(山西中医学院附属医院外科,山西太原030024)
大肠癌Cyclin D1多态性及相关细胞周期蛋白表达的研究
Polymorphism of Cyclin D1 and Expression of Cell Cycle Related Genes in Colorectal Carcinoma
任 鸿
(山西中医学院附属医院外科,山西太原030024)
目的:研究大肠癌中Cyclin D1基因DNA序列的多态性及其相关的细胞周期调控蛋白的表达水平。方法:取55例大肠癌患者手术切除标本,抽提病变组织中的基因组DNA,另取24例非癌症切除的正常组织作为正常对照。通过PCR扩增Cyclin D1的4号外显子的基因组DNA片段,并进行限制性片段长度多态性分析,统计Cyclin D1第242号密码子多态性的分布比例。以Western Blot方法,在蛋白质水平检测相应组织中Cyclin D1,Cdk6和pRb的表达水平及磷酸化水平。将检测结果以光密度值进行半定量,对比各组不同的Cyclin D1基因型对相关蛋白表达的影响。结果:在55例大肠癌中,有12例(21.8%)的基因型显示为GG;有24例(43.6%)的基因型显示为AG;有19例(34.5%)的基因型显示为AA。当其基因型为AA和AG时,Cyclin D1表达水平和pRb磷酸化水平要显著高于基因型为GG的标本(P<0.01)。一般GG型的肿瘤组织中Cyclin D1的表达水平和pRb磷酸化水平与正常组织无显著性差异;而AA和AG型的肿瘤组织中,Cyclin D1的表达水平则分别可以达到正常组织的(4.87±2.38)倍和(3.43±1.74)倍。病理学检测显示多数AA和AG型大肠癌的肿瘤分级也显著高于GG型的标本(P<0.05);但肿瘤分期的差异无统计学意义(P>0.05)。结论:大肠癌中Cyclin D1基因第242号密码子具有多态性。Cyclin D1的等位基因多态性在很大程度上影响了pRb的磷酸化水平,与大肠癌病理分级以及预后有密切联系。
大肠癌;细胞周期素D1;等位基因;多态性
Cyclin D1属于细胞周期调节蛋白,在调控正常细胞周期过程中起重要作用[1]。当其基因突变引起过度表达时,往往有助于肿瘤的形成[2],特别是发生了G→A转换的Cyclin D1基因所表达的蛋白质具有更长的半衰期,使其在细胞内的作用时间延长,破坏了细胞周期的平衡[3]。本研究对大肠癌组织中Cyclin D1基因多态性进行分析,并检测Cyclin D1基因的表达及其相关的细胞周期调控蛋白的水平,阐明Cyclin D1基因对大肠癌的影响。
1 资料与方法
1.1 DAN抽提及PCR扩增
取55例大肠癌手术标本,另取24例非癌组织作为对照。各取50 mg组织抽提基因组DNA。各取100 ng DNA样品通过PCR反应扩增目的片段。引物 :5′-GTGAAGTTCATTTCCAATCCGC-3′和 5′-GGGACATCACCCTCACTTAC-3′,退火温度57℃,产物片段的长度为167 bp。
1.2 Cyclin D1基因多态性的检测
扩增产物交由上海生工进行测序,以确定扩增产物为本研究所需的片段,并对癌变组织和正常组织的测序结果进行比对和统计。然后,进行限制性片段长度多态性分析,以5个单位的限制性内切酶ScrFI(New England),于37℃酶切上述PCR产物过夜,随后在3%Agarose凝胶(含0.5 mg/L Ethidium Bromide,EB)中进行电泳,根据酶切产物的不同条带,统计各组基因型的比例。
1.3 Western Blot检测Cyclin D1、Cdk6和pRb的表达水平及磷酸化水平
取各组标本100 mg充分剪碎,研磨成糜状,置于1 mL蛋白裂解液充分裂解。Bradford法测定样品中的蛋白含量,将所有样品的蛋白含量稀释至等浓度。取15 μL蛋白样品与15 μL上样液混匀,沸水浴15 min,上样至8%的SDS-PAGE,10 mA电泳约4 h。电泳完毕,取下凝胶,蛋白条带电转膜至硝酸纤维素膜,80 V约2 h,硝酸纤维素膜置于封闭液(Pierce)中,4℃过夜。次日,分别加入鼠抗Cyclin D1、鼠抗Cdk6 和鼠抗 pRb(NeoMarker Inc);然后再加生物素化二抗,碱性磷酸酯酶联三抗,摇床震荡1.5 h,充分反应,使之互相结合,最后加入显色底物NBT-BCIP(Pierce),在酶催化作用下,显色于硝酸纤维素膜。通过Quantity One software(BIO-RAD)软件对各组条带,扫描拍照;并对其光密度值进行半定量分析。
1.4 病理学分析
有病理科2名高级医师对各例大肠癌组织进行切片病理学分析,将病理分级和分期的结果与各自测得的基因型对照,观察Cyclin D1多态性对肿瘤组织的病理学分级和分期的影响。
1.5 统计学方法
2 结 果
2.1 Cyclin D1基因多态性的分布
Cyclin D1基因第242号密码子等位基因是A的片段未能被ScrFI所酶切,长度仍然是167 bp;等位基因是G的片段被ScrFI所酶切,成为2个小片段,长度分别是146 bp和21 bp。在55例大肠癌患者中,Cyclin D1基因第242号密码子有34.5%的基因型显示为AA,显著高于正常对照组的20.8%(P<0.01)。在大肠癌患者中,等位基因是A的占56.4%,等位基因是G的占43.6%;而正常对照组中,等位基因是A的占43.8%,等位基因是G的占56.2%。由此可见,Cyclin D1基因第242号密码子的A/G多态性,显著影响基因携带者对大肠癌的易感性(见图1)。

图1 Cyclin D1基因的PCR限制性片段长度多态性检测
2.2 Cyclin D1在不同基因型的大肠癌中的表达水平
在Cyclin D1第242号密码子,基因型为AA和AG的大肠癌中,Cyclin D1蛋白的表达水平,分别达到正常组的(4.87±2.38)倍和(3.43±1.74)倍;均显著高于基因型为GG的组织(P<0.01)。而GG型组织中Cyclin D1蛋白的水平,仅比正常组略高一些,差异无统计学意义(见图2)。
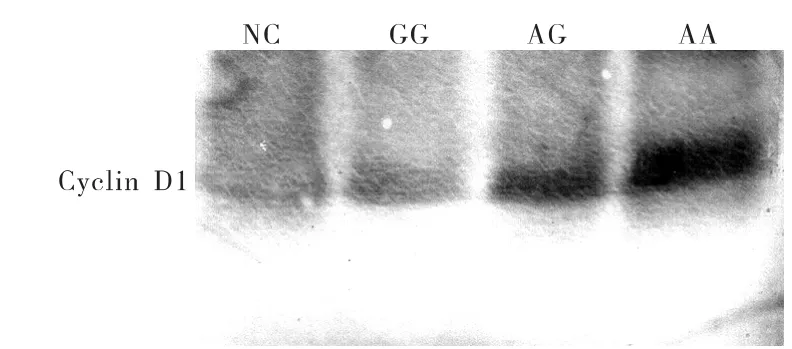
图2 Cyclin D1蛋白的表达水平
2.3 Cdk6和pRb的表达水平及磷酸化水平
所有大肠癌表现Cdk6高水平表达,平均达到正常组的(2.54±1.09)倍。但是Western Blot半定量结果没有发现Cyclin D1基因多态性对Cdk6的表达水平没有影响(见图3)。
Western Blot检测pRb的结果可见两条带,一条分子量较大的代表磷酸化pRb,另一条分子量较小的条带为去磷酸化pRb。结果显示pRb的磷酸化状态与Cyclin D1基因多态性有密切的关系(P<0.01),基因型为AA和AG的大肠癌中,Western Blot显示有明显的磷酸化pRb条带,而GG型组织中磷酸化pRb条带基本不可见,与正常组类似,比较差异无统计学意义。
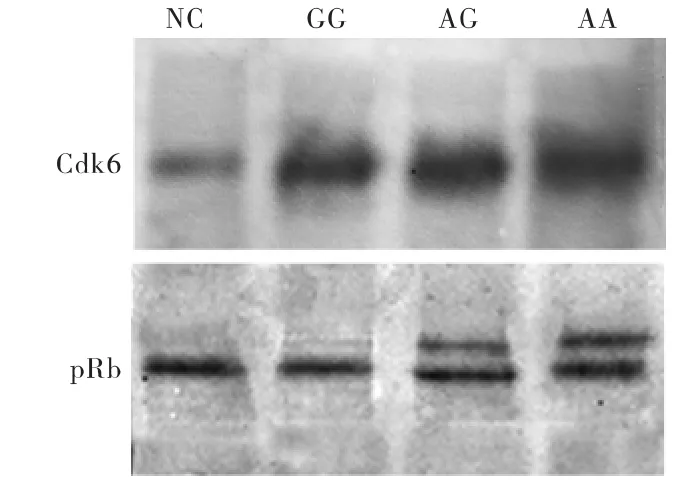
图3 Cdk6和pRb的蛋白表达水平
2.4 Cyclin D1基因多态性对肿瘤组织病理学的影响
对所有55例大肠癌患者的癌变组织进行病理学分析,Cyclin D1基因多态性与肿瘤病理分级具有明显的相关性(P<0.05),在GG和AG型组织中以Ⅰ、Ⅱ级为主,在AA型组织中则Ⅲ级较多,其间的差别有显著性(P<0.05)。但是,在低分期组(Ⅰ、Ⅱ)与高分期组(Ⅲ、Ⅳ)之间,Cyclin D1基因多态性的影响并不具有统计学意义(P>0.05)。
3 讨论
Cyclin D 是一种原癌基因[4]。Cyclin D1 基因 4号外显子的第242号密码子有A/G多态性,使其转录产物mRNA发生不同位点的剪接。这2种不同剪接方式形成的mRNA所合成的蛋白质都带有正常生物学功能的Cyclin区(第55~161号氨基酸),但是在G→A转换时,羧基端原有的55个由5号外显子编码的氨基酸缺失,转而由4号内含子编码的44个氨基酸的肽段所取代[3]。由于缺失的片段中,包含了富含PEST的降解相关区域,就造成了Cyclin D1蛋白质代谢过程紊乱,具有了更长久的半衰期[5-6]。对不同肿瘤检测发现,Cyclin D1基因的G→A转换会导致基因携带者有罹患癌症的倾向[7]。本研究55例大肠癌患者中,Cyclin D1基因第242号密码子有34.5%的基因型为AA,显著高于正常对照组20.8%(P<0.01),可见Cyclin D1的A/G多态性显著影响患者对大肠癌的易感性。
对Cyclin D1基因的这一多态性进行深入研究,在蛋白水平的检测显示,基因型为AA和AG的大肠癌中,Cyclin D1蛋白的表达水平,均显著高于基因型为GG的癌症组织(P<0.01)。据此推测,Cyclin D1在G→A转换时,缺失了降解相关的PEST区域,增加了Cyclin D1蛋白在细胞内的稳定性,因此AA和AG基因型的癌症组织里,其表达水平会显著高于GG基因型。
Cyclin D1可以与Cdk4和Cdk6形成复合体,从而使级联的信号分子,如Rb基因的蛋白产物pRb等发生磷酸化。未磷酸化的pRb与E2F家族的转录因子结合,阻遏细胞周期的进行;当它磷酸化之后,就会解除这种抑制作用,引导细胞进入S期[8]。我们也对其中,与Cyclin D1关系密切的几种细胞周期调控蛋白进行了检测。Cdk6的表达在所有基因型的大肠癌组织中,均有高水平表达。而pRb的磷酸化状态则与Cyclin D1基因多态性有密切的关系(P<0.01),在基因型为AA和AG的大肠癌中,有明显的磷酸化pRb条带;GG型组织中磷酸化pRb条带基本不可见,类似正常对照组。pRb为重要的细胞周期负调控因子,是G1→S调控点的中心,pRb的磷酸化是Rb基因调节细胞生长分化的主要形式。当由于上游Cyclin D1的表达异常,致使过量的Rb发生磷酸化时,就会有过多的细胞进入自主分裂,逃避凋亡程序,最终形成组织异常增生或者局部的过度血管化[9]。本研究中对癌变组织进行的病理学分析,也证实了上述观点。Cyclin D1基因多态性与肿瘤病理分级具有明显的相关性(P<0.05),在GG和AG型组织中以Ⅰ、Ⅱ级为主,在AA型组织中则是Ⅲ级的比例较高,其间的差别有显著性(P<0.05)。有研究报道,在其他肿瘤类型中,Cyclin D1过表达的癌症患者容易发生某些耐药倾向或者有较差的预后[10];通过基因治疗的手段,下调Cyclin D1的表达,不仅可以改变细胞的周期,还发现可以明显抑制耐药细胞中多种耐药基因的表达,提高细胞对化疗药物的敏感性,改善化疗的效果[11]。但是,在低分期组(Ⅰ、Ⅱ)与高分期组(Ⅲ、Ⅳ)之间,Cyclin D1基因多态性的影响并不具有显著性(P>0.05)。癌症是经过多基因、多步骤,逐步形成的[12],可见在肿瘤分期这一方面,Cyclin D1基因并非是主要因素,而由其他的癌基因所控制。
[1]Nheu T,He H,Hirokawa Y,et al.PAK is essential for RAS-induced upregulation of cyclin D1 during the G1 to stransition[J].Cell Cycle,2004,3(1):71-74.
[2]Chung D C,Brown S B,Graeme-Cook F,et al.Overexpression of cyclin D1 occurs frequently in human pancreatic endocrine tumors[J].J Clin Endocrinol Metab,2000,85(11):4 373-4 378.
[3]Betticher D C,Thatcher N,Altermatt H J,et al.Alternate splicing produces a novel cyclin D1 transcript[J].Oncogene,1995,11(2):1 005-1 011.
[4]Kita Y,Masaki T,Funakoshi F,et al.Expression of G1 phaserelated cell cycle molecules in naturally developing hepatocellular carcinoma of Long-Evans Cinnamon rats[J].Int J Oncol,2004,24(5):1 205-1 211.
[5]Seshadri R,Lee C S,Hui R,et al.Cyclin D1 amplification is not associated with reduced overall survival in primary breast cancer but may predict early relapse in patients with features of good prognosis[J].Clin Cancer Res,1996,2(7):1 177-1 184.
[6]Lukas J,Muller H,Bartkova J,et al.DNA tumor virus oncoproteins and retinoblastoma gene mutations share the ability to relieve the cell′srequirementforcyclinD1functioninG1[J].JCellBiol,1994,125(3):625-638.
[7]Holley S L,Parkes G,Matthias C,et al.Cyclin D1 polymorphism and expression in patients with squamous cell carcinoma of the head and neck[J].Am J Pathol,2001,159(5):1 917-1 924.
[8]Weinberg R A.The retinoblastoma protein and cell cycle control[J].Cell,1995,81(2):323-330.
[9]Dobashi Y,Goto A,Fukayama M,et al.Overexpression of cdk4/cyclin D1,a possible mediator of apoptosis and an indicator of prognosis in human primary lung carcinoma[J].Int J Cancer,2004,110(4):532-541.
[10]Sutherland R L,Musgrove E A.Cyclins and breast cancer[J].J Mammary Gland Biol Neoplasia,2004,9(1):95-104.
[11]Marko K,Kathleen D.Danenberg,et al.Inhibition of cyclin D1 expression in human pancreatic cancer cells is associated with increased chemosensitivity and decreased expression of multiple chemoresistance genes[J].Cancer Res,1999,59(110):3 505-3 511.
[12]Almadori G,Bussu F,Cadoni G,et al.ultistep laryngeal carcinogenesis helps our understanding of the field cancerization phenomenon[J].Eur J Cancer,2004,40(16):2 383-2 388.
R657.1
A
1671-0258(2012)04-0057-03
任鸿,女,副主任医师,从事外科临床工作
2012-05-01

