山东种公猪精液携带主要病原的检测
王军一,金扩世,徐敬龙
(1.临沂市畜牧站,山东临沂276004;2.军事医学科学院军事兽医研究所,吉林长春130041;3.济南澳利生物工程有限公司,山东济南250306)
猪瘟病毒(Classical swine fever virus,CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、伪狂犬病病毒(Pseudorabies virus,PRV)、猪圆环病毒2型(Porcine circovirus type2,PCV-2)和猪细小病毒(Porcine parvovirus,PPV)可以引起以妊娠母猪流产、早产、产死胎及木乃伊胎等为特征的繁殖障碍性疫病,是当前严重危害我国养猪业的主要病原。这些病原除了可以通过接触传播外,更能通过交配或精液输入而扩散。
目前,规模猪场普遍采用人工授精技术,2007年,国家大力实施生猪良种繁育补贴项目,进一步推广人工授精技术。因此,如果公猪精液携带这些病原,则很容易通过精液传播,从而加大了病原传播的速度和广度,增加了防控工作的难度和复杂性。为了解山东地区种公猪精液的带毒情况,为制定科学有效的防控措施提供依据,应用PCR技术对山东部分种猪场或人工授精站公猪精液进行了上述5种病毒的检测,现报告如下。
1 材料与方法
1.1 材料
1.1.1 公猪精液样品 从2007年-2009年共采集来自山东各地38个猪场和人工授精站的生产公猪精液样品727份,其中包括种猪场11个423份,普通规模猪场13个258份,人工授精站14个46份。
1.1.2 主要试剂 M-MLV反转录酶、RNA 酶抑制剂、Ex-Taq DNA 聚合酶、d NTPs、DNA 标准,以及病毒核酸提取试剂盒TaKaRa MiniBEST Viral RNA/DNA Extraction Kit均购自宝生物工程(大连)有限公司。
1.1.3 PCR引物 CSFV采用罗廷荣等[1]报道的引物,CSFV1:5′-GCT CCT GGT TGG TAA CCT CGG-3′;CSFV2:5′-TGA TGC TGT CAC ACA GGT GAA-3′,预计扩增目的片段长度分别为508 bp。
PRRSV 采用娄高明等[2]报道的引物,PRRSV1:5′-ATG GCC AGC CAG TCA ATC A-3′;PRRSV2:5′-TCG CCC TAA TTG AAT AGG TG-3′,预计扩增目的片段长度为433 bp。
PRV引物采用猪伪狂犬病病诊断技术标准(GB/T18641-2002),预计扩增目的片段长度为217 bp。
PCV-2采用芦银华等[3]报道的引物,PCV-2 1:5′-CCG CGG GCT GGC TGA ACT T-3′;PCV-2 2:5′-ACC CCCGCC ACC GCT ACC-3′,预计扩增目的片段长度为1 154 bp。
PPV 采用赵俊龙等[4]报 道 的引物,PPV1:5′-TGG TCT CCT TCT GTG GTA GG-3′;PPV2:5′-CAG AAT CAG CAA CCT CAC-3′,预计扩增目的片段长度为445 bp。
引物均由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 精液样品的前处理与病毒核酸提取 用PBS(p H 7.4,0.01 mol/L)将精液样品做10倍稀释,反复冻融3次,4℃、12 000 r/min离心10 min。取250μL上清按照 TaKaRa MiniBEST Viral RNA/DNA Extraction Kit试剂盒说明书提取病毒核酸。
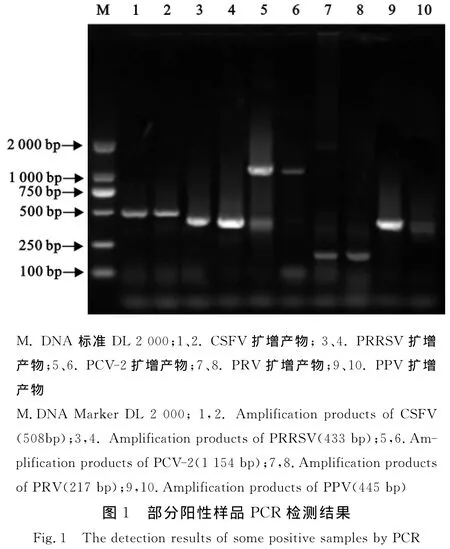
1.2.2 病原检测 CSFV和PRRSV检测采用同一RT-PCR反应条件,反转录体系:5×buffer 5μL,d NTP(2.5 mmol/L)4μL,RNasin 0.5μL,M-MLV反转录酶0.5μL,反转录引物1μL,模板 RNA 16μL。反转录反应条件为42℃反应1 h。PCR反应体 系 如 下:上 下游引物 各 0.5μL,d NTP(2.5 mmol/L)2μL,10×buffer 2.5μL,DNA 模板2μL,Taq酶0.3μL(5 U/μL),用灭菌双蒸水加至总体积25μL。PCR反应条件:95℃5 min;95℃40 s,57℃40 s,72℃1 min,35个循环;然后72℃延伸10 min。PRV检测参考猪伪狂犬病病诊断技术标准(GB/T18641-2002)[3]进行;PCV-2参照芦银华[4]介绍的PCR 方法进行;PPV 参照赵俊龙[5]介绍的PCR方法进行。取5μL PCR产物在12 g/L的琼脂糖凝胶上进行电泳(100 V,30 min),应用凝胶成像系统观察目的片段。
2 结果
2.1 公猪精液中5种主要病原的检测结果
727份公猪精液样品中检出18份CSFV阳性样品,阳性率2.48%,来自4个种猪场、4个普通规模猪场和1个人工授精站;检出27份PRRSV阳性样品,阳性率3.71%,来自4个种猪场、7个普通规模猪场和2个人工授精站;检出7份PRV阳性样品,阳性率0.96%,来自2个种猪场和3个普通规模场;检出33份PCV-2阳性样品,阳性率4.54%,来自4个种猪场、7个普通规模猪场和2个人工授精站;检出9份PPV阳性样品,阳性率1.24%,分别来自2个种猪场和3个普通规模猪场。结果表明有44.74%的猪场精液带毒(17/38),只有6个种猪场,5个普通规模猪场和10个人工授精站的公猪精液中未检出病原。具体见表1,表2,表3和图1。
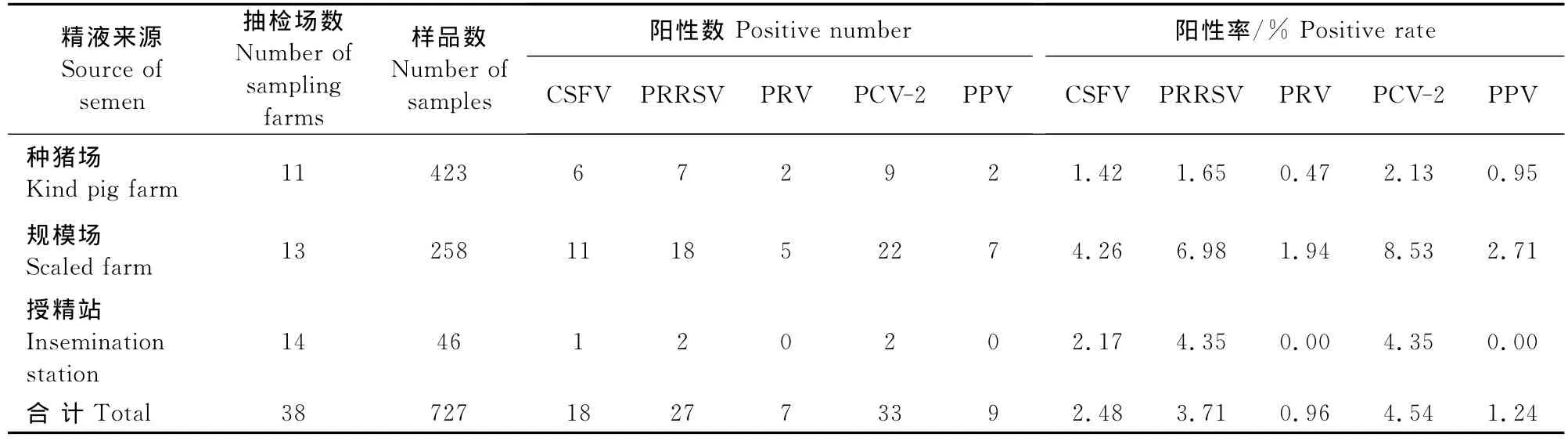
表1 公猪精液中5种病原检测总体情况Table1 The results of 5 pathogen detection in boar semen
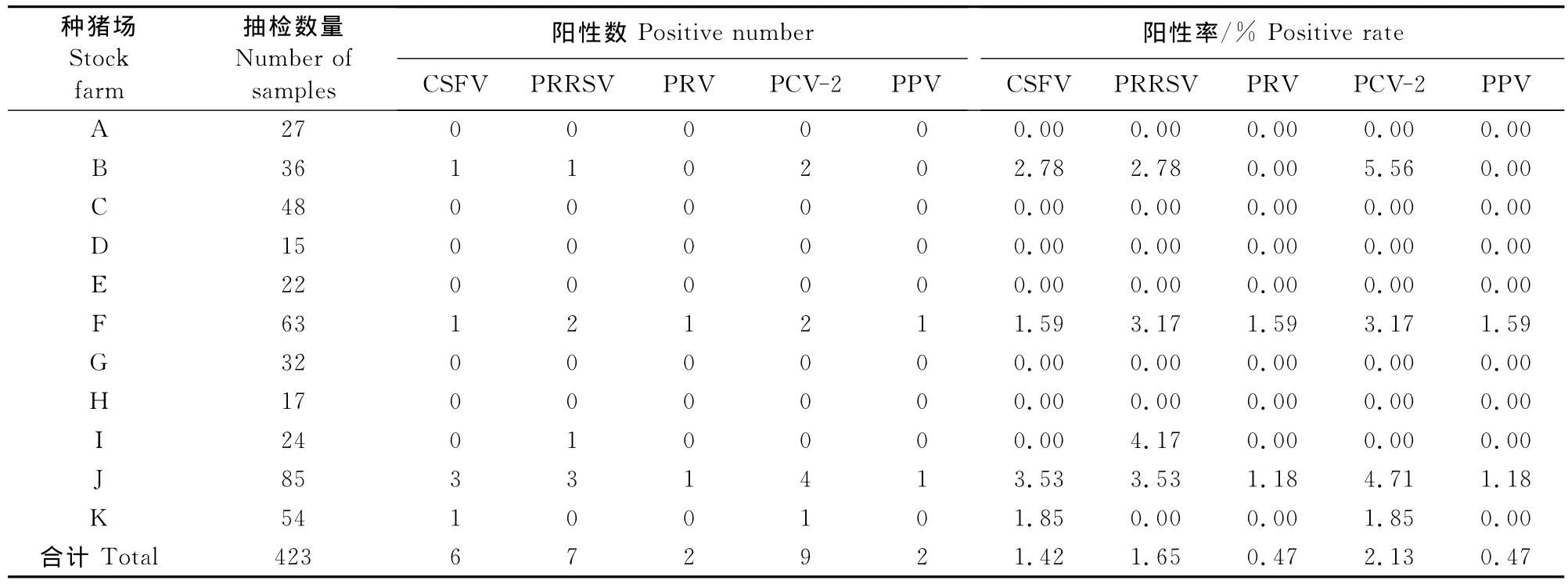
表2 种猪场公猪精液中5种病原检测结果Table2 The results of 5 pathogen detection in boar semen of stock farms
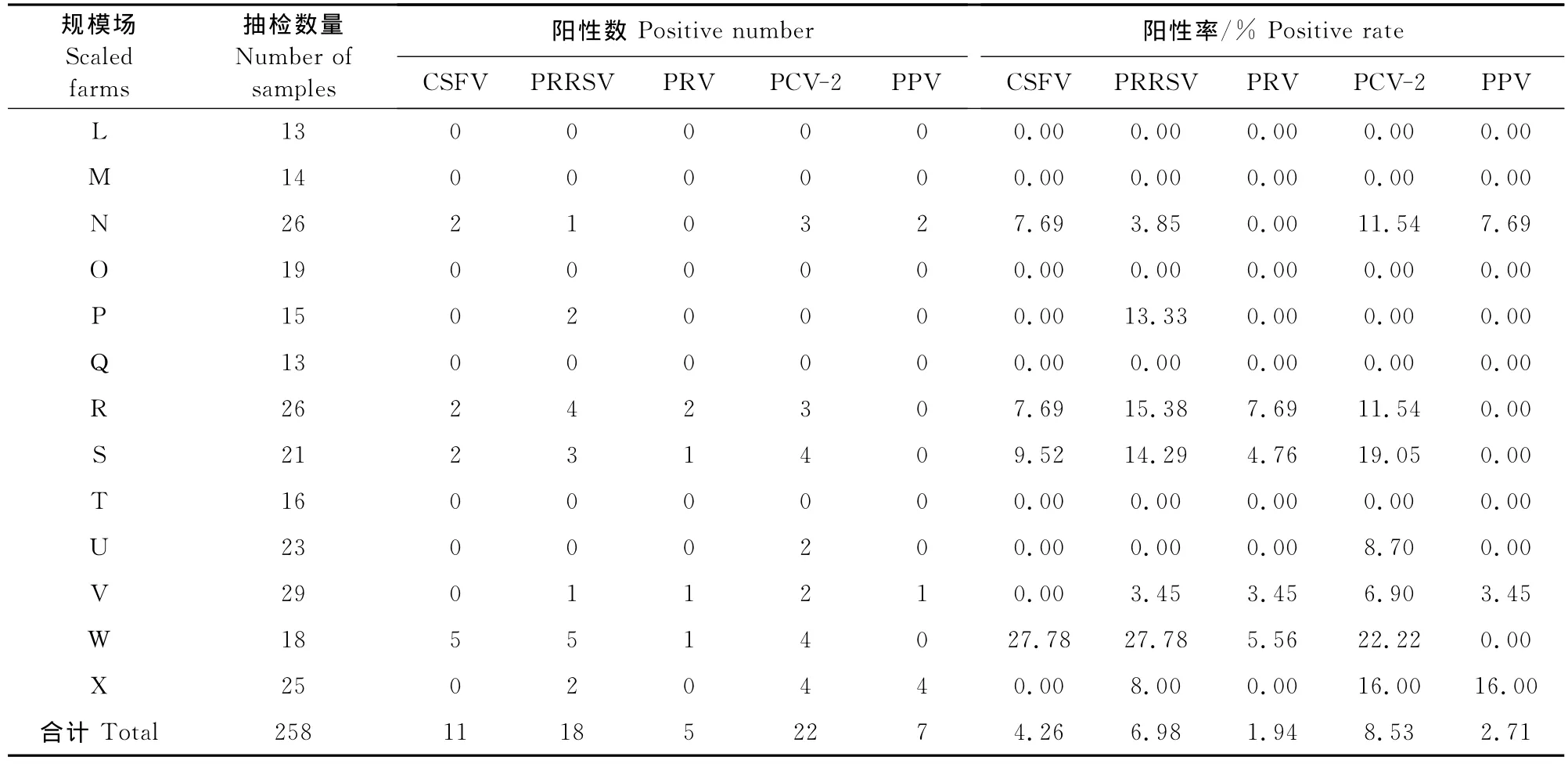
表3 普通规模猪场公猪精液中5种病原检测结果Table3 The results of 5 pathogen detection in boar semen of the ordinary scaled farms
2.2 公猪精液中5种病原混合感染的检测结果
公猪精液中5种病原混合感染的检测结果见表4,有7份样品为2种以上病原混合感染,阳性场次数达6个,其中以PRRSV+PCV-2混合感染最多,有4份(包括三重感染),阳性场次数达3个。另外,CSFV与其他病原混合感染情况也比较突出,有18份CSFV阳性样品中有3份为混合感染,比率高达16.67%。

表4 精液中5种病原混合感染的检测结果Table4 The results of 5 pathogen mixed infection detected in the boar semen
3 讨论
在生猪生产实践过程中,优良种公猪可以给大量的母猪配种,人工授精技术的推广和广泛应用进一步凸显出公猪精液的疫病防控中的源头地位。很多疫病如猪瘟、猪繁殖与呼吸综合症、猪细小病毒病、伪狂犬病、圆环病毒等都很能够通过公猪精液传播与扩散,造成疫病的流行。国内一些单位也先后对公猪精液携带病毒情况进行了检测。如南京农业大学的周斌等[5]对2003年-2004年期间华东5省市17个大中型猪场送检的186份中公猪精液进行了检测,结果18份呈PRRSV阳性,24份为CSFV阳性,其中11份为PRRSV和CSFV混合感染。孙泉云等[6]在2006年4月~10月对上海及周边30个猪场和授精站355份公猪精液进行了6种与繁殖障碍相关病毒的检测,结果除日本脑炎病毒为阴性外,PRRSV、PRV 、CSFV、PPV 和 PCV 均有一定程度流行,并存在混合PRV和PPV感染现象。黄夏等[7]对采自广西6市12个种猪场的441份公猪精液进行检测,结果有75%的猪场公猪精液存在带毒现象,CSFV、PRRSV、PCV-2、PRV 和PPV 阳性率分别为10.20%、2.04%、7.48%、0.45%和0.45%,总阳性率为20.63%。
本试验采用PCR技术,对2007年-2009年采集的山东11个种猪场、13个普通规模猪场和14个人工授精站的共计727份生产公猪精液样品进行了检测,结果发现无论是种猪场、普通规模场,还是授精站的公猪精液均存在带毒现象,共检出阳性样品94份,阳性率为12.93%;其中PCV-2和PRRSV阳性率最高,分别为4.54%和3.71%;其次是CSFV,阳性率达2.48%;而PRV和PPV也有一定水平带毒,阳性率分别为0.96%和1.24%;另外发现存在PRRSV、PCV-2和CSFV、PPV等混合感染现象,阳性率为0.96%。
与其他单位研究结果不同的是,本研究发现山东地区公猪精液中PRRSV和PCV-2阳性率最高,而黄夏等[7]报道CSFV检出率最高,孙泉云等[6]则发现PPV阳性率最高。造成这种原因,我们考虑是首先2006年下半年-2008年全国流行高致病性蓝耳病,在此期间不少猪场的公猪被感染,因此精液阳性率较高,而其他研究者的工作在疫情暴发前已基本完成,因此,PPRSV的阳性率存在较大差异。由于目前缺乏有效的商品化疫苗,防控PCV-2主要通过严格的生物安全管理和检疫净化等措施,因此管理水平的差距是造成不同地区、猪场PCV-2阳性率差异的关键。本试验结果发现,PRRSV和PCV-2,以及与其他病原混合感染现象较为普遍。由于PRRSV和PCV-2是免疫抑制性疫病,主要破坏机体免疫系统,因此对这两种疫病的防控应高度重视。
种公猪和公猪精液的质量直接关系到养猪业的健康发展,在当前猪病日趋复杂化的形势下,必须加强对种公猪和精液的管理。种猪场和规模猪场应建立完善的生物安全体系,减少疫病传播几率,提高猪群的整体健康水平;应加强对公猪群的疫病监测,尽早发现和剔除感染病毒的阳性种公猪,彻底切断传染源。另外,猪场和授精站在引进种公猪和精液前必须严格检疫(测),选用无特定病原的公猪或精液用于授精,充分保证养殖场(户)的经济效益,从而从种源上净化繁殖障碍性疾病奠定基础。
[1]罗廷荣,莫 扬,吴文德,等.RT-PCR技术诊断猪瘟的应用研究[J].中国预防兽医学报,2004,26(4):307-310.
[2]娄高明,杜伟贤,谢明权,等.猪繁殖与呼吸道综合征RT-PCR诊断方法的建立[J].中国兽医学报,2000,20(2):141-144.
[3]芦银华,许立华,华修国,等.猪圆环病毒2及猪繁殖与呼吸综合征病毒的快速检测[J].中国病毒学,2003,18(2):184-186.
[4]赵俊龙,陈焕春,吕建强,等.猪细小病毒PCR检测方法的建立与应用[J].中国兽医学报,2003,23(2):142-144.
[5]贾 斌,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,19(5):467-470.
[6]孙泉云,周锦萍,张维谊,等.种公猪精液中与繁殖障碍有关的6种病毒的检测[J].动物医学进展,2007,28(11):30-33.
[7]黄 夏,陈义祥,磨龙春,等.应用PCR方法对广西公猪精液的伪狂犬病、圆环病毒2型和细小病毒混合感染情况的检测[J].广东畜牧兽医科技,2008,33(1):41-43.

