山羊传染性胸膜肺炎继发流产病例的诊断
王 慧,王开功,张双翔,周碧君,文 明,程振涛,龙冲冲,尹 鑫,罗 意
(1.贵州大学动物科学学院,贵州贵阳550025;2.贵州省动物疫病研究室,贵州贵阳550025)
山羊传染性胸膜肺炎(Contagious caprine plneuropneumonia,CCPP)是由绵羊肺炎支原体(Mycoplasma ovipneumoniae,Mo)及丝状支原体山羊亚种(Mycoplasma mycoides subsp.capri,Mmc)等丝状支原体簇致病支原体所引起的山羊的高度接触性传染病,为国家二类传染病,临床症状为高热、咳嗽、肺和胸膜发生浆液性和纤维蛋白性炎症,病死率较高[1-5]。自1947年我国首次在甘肃发现山羊患此病后,在我国内蒙古、宁夏、新疆、辽宁、河北、四川、重庆、广西、贵州、湖南等多个地区均有山羊传染性胸膜肺炎的报道[6-9],对我国养羊业造成了巨大的冲击。
立秋以后,贵州省某规模化山羊养殖场所饲山羊不断暴发临床表现为咳嗽、消瘦、高热、卧地不起等类似山羊传染性胸膜肺炎的疾病,造成了大量山羊死亡,妊娠母羊并发流产,流产率高达20%~25%,影响了当地的畜牧经济发展。为确诊病因,对临床病死母羊以分子生物学方法进行病原检测,最终确诊为CCPP,并对流产情况进行分析,现将病例诊断情况介绍如下,以期为预防控制疫病流行暴发提供技术支持。
1 材料与方法
1.1 材料
1.1.1 病料 采自贵州省某规模化山羊养殖场临床表现疑似CCPP症状并发流产死亡3只母山羊病变肺组织与子宫。
1.1.2 试剂 DNA提取试剂及PCR扩增试剂购自北京天根生化科技有限公司;分子克隆试剂购自大连TaKaRa公司;Mmc PG3株与Mo Y98株16S rRNA基因部分序列克隆质粒,由贵州省动物疫病研究室制备保存;山羊流产衣原体疫苗购自中国农业科学院兰州兽医研究所。
1.2 方法
1.2.1 引物设计合成 参考文献[10]设计扩增CCPP主要病原Mmc 16SrRNA部分序列的特异性 引 物 Ps/Pa(Ps:5′-GGGAGGCAGCAGTAGGGAAT-3′, Pa: 5′-CAGCGTCAATAACAAGCCAGTAAG-3′,预计产物长度412bp)与 Mo 16S rRNA 部 分 序 列 的 特 异 性 引 物 Ms/Ma(Ms:5′-AAACTATGTGCCAGCAGCGTAAG-3′,Ma:5′-CACCATCTGTCATCTCGTTAGCC-3′,预计产物长度534bp);并参考GenBank中公布的山羊流产衣原体OmpA基因序列设计特异性引物P1/P2(P1:5′-ATGAAAAAA CTCTTGAAATCG-3′,P2:5′-TTAGAATCTGAATTGAGCA-3′,预 期 产物大小1 170bp)。引物由上海捷瑞生物工程有限公司合成。
1.2.2 CCPP病原核酸检测 取3只病死母羊肺组织无菌研磨成组织匀浆液,以10 000r/min离心10min后取上清液,采用SDS-Protein K法提取病料组织基因组DNA。用引物Ps/Pa与Ms/Ma以所提DNA为模板进行双重PCR扩增:于50μL反应体系中加入10×buffer 5μL,Mg2+(25mmol/L)3μL,dNTP(10mmol/L)1μL,Taq酶(2.5U/μL)1μL,引 物 Ps/Pa(10 μmol/ L)及 Ms/Ma(10μmol/L)各1μL,DNA模板1μL,ddH2O补足。94℃预变性4min;94℃变性40s,54℃退火40s,72℃延伸1.5min,共34个循环;72℃延伸10min。以10g/L琼脂糖凝胶电泳检测扩增结果。
1.2.3 山羊流产衣原体核酸检测 取3只病死母羊子宫组织无菌研磨成组织匀浆液,以10 000r/min离心10min后取上清液,采用SDS-Protein K法提取病料组织基因组DNA。用引物P1/P2以所提DNA为模板进行PCR扩增:于50μL反应体系中加入10×buffer(含 Mg2+)5μL,dNTP(10mmol/L)1μL,Taq酶(2.5U/μL)1μL,引物P1/P2(10μmol/L)各1μL,DNA模板2μL,ddH2O补足。94℃预变性5min;94℃变性40s,53℃退火40s,72℃延伸1min,共34个循环;72℃延伸10min。以10g/L琼脂糖凝胶电泳检测扩增结果。
1.2.4 目的基因克隆测序 取扩增产物按文献[11]进行目的基因纯化回收并T载体克隆,重组质粒经PCR与双酶切鉴定初步判为阳性者送测序公司进行序列测定。
1.2.5 序列比对分析 以生物软件将测定序列结果与CCPP病原山羊支原体山羊肺炎亚种(M.capricocumsubsp.capripreumoniae,Mccp)、丝状支原体丝状亚种LC型(M.mycoides subsp.mycoides LC,Mmm LC)、丝状支原体山羊亚种(M.mycoides subsp.capri,Mmc)及绵羊肺炎支原体(M.ovipneumoniae,Mo)16SrRNA 基因进行同源性分析;为进一步分析病例所伴流产率高的原因,将测定序列结果与感染生殖道、易引起流产的解脲支原体(U.urealyticum,Uu)、狗生殖道尿原体(U.canigenitalium,Uca)、人型支原体 (M.hominis,Mho)、腐败支原体(M.putrefaciens,Mpu)、眼无胆支原体(A.oculi,Aoc)、相异尿原体(U.diversum,Ud)、狸猫尿原体(U.felinum,Uf)和鸡口尿原体(U.gallorale,Ug)的16SrRNA 序列比对并构建系统发生树,进行进化关系分析,参比序列见表1。

表1 参比序列Table 1 The GenBank accession No of reference sequences
2 结果
2.1 CCPP病原核酸检测结果
用引物Ps/Pa与Ms/Ma以从3只病死母羊肺组织提取的基因组DNA为模板进行Mmc和16S rRNA双重PCR扩增,结果见图1。由图1可知,从3只病死母羊肺组织所提基因组DNA中未扩增到Mmc 16SrRNA基因412bp片段,均扩增到Mo 16SrRNA基因534bp片段,表明病死母羊已患CCPP,初步判定为Mo感染所致。
2.2 山羊流产衣原体核酸检测结果
用引物P1/P2以从3只病死母羊子宫组织提取的基因组DNA为模板进行山羊流产衣原体OmpA基因PCR扩增,结果见图2。由图2可知,从3只病死母羊子宫组织所提基因组DNA中均未扩增到山羊流产衣原体OmpA基因1 170bp片段,表明病死流产母羊未感染山羊流产衣原体。
2.3 扩增片段序列与CCPP病原支原体16S rRNA同源性分析结果
对2.1扩增出的基因片段进行回收纯化,克隆到T载体后进行序列测定,测定结果为3个样品序列相同。将序列测定结果与所有致山羊患CCPP支原体Mccp、Mmm、Mmc及 Mo的16SrRNA进行同源性分析,结果见图3。由图3可知,所测序列(贵州,GZ)与 Mo同源性高达99.6%,而与其他3种丝状支原体簇成员同源性皆低于70%,表明本次造成母羊患CCPP病原确诊为Mo。
2.4 扩增片段序列与感染生殖道支原体及尿原体16SrRNA分子进化关系分析结果
将序列测定结果与感染生殖道、易引起流产的支原体及尿原体16SrRNA构建系统发生树,进行进化关系分析,结果见图4。由图4可知,本次致病的病原与感染人、犬、猫、鸡生殖道的尿原体进化关系较远,而与感染山羊的Aoc与Mpu有一定进化相似处,与Mho 16SrRNA基因分子进化关系较近,系统发生树显示二者处于同一分支。
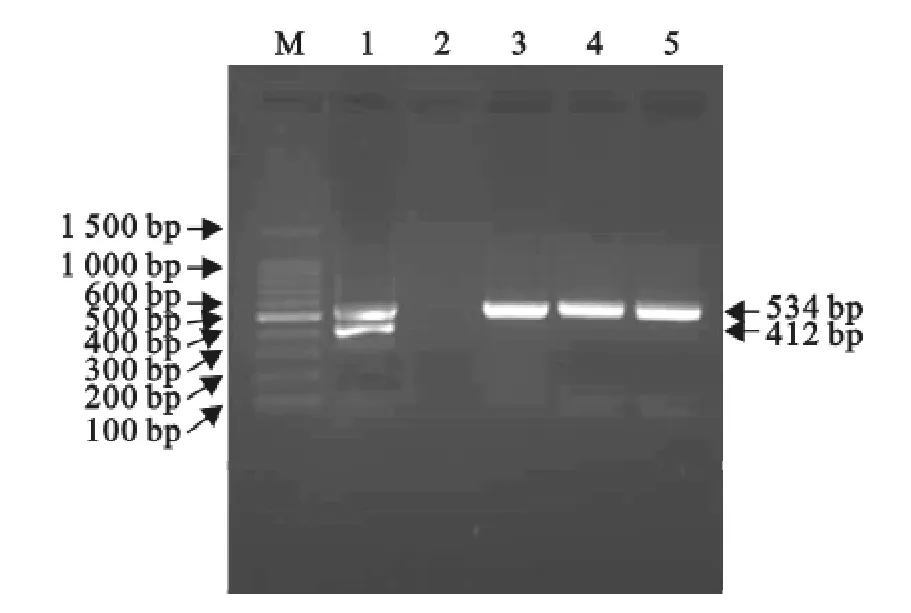
图1 双重PCR扩增结果Fig.1 The result of duplex-PCR

图2 山羊流产衣原体OmpA基因PCR扩增结果Fig.2 The amplification of OmpA gene of Chlamydia
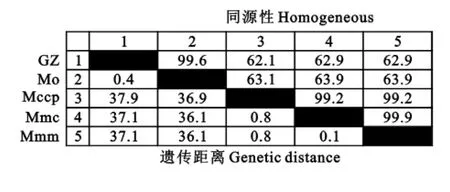
图3 与CCPP所有致病支原体同源性比较Fig.3 Comparison of homologies with other mycoplasma

图4 与生殖道支原体及尿原体进化关系分析Fig.4 Phylogenetic trees based on mycoplasma and ureaplasma
3 讨论
本试验采用分子生物学试验对临床表现咳嗽、消瘦、流产等症状病死母羊进行了病因确定性诊断,结果3只病死母羊病变肺组织中Mo核酸检测均为阳性,子宫组织中山羊流产衣原体核酸检测均为阴性。以分子克隆方法对目的基因进行克隆并将测定序列与引起CCPP以主要支原体16SrRNA序列进行同源性分析,表明致山羊表现上述临床症状的病原为Mo,而未发现病死母羊感染山羊流产衣原体。
16SrRNA是原核生物核糖体30S亚基中一个古老而稳定的组分,不会发生不同生物间水平转移,其基因序列由保守区和可变区两部分组成,保守区与变异区共存的独特分子进化格局使16SrRNA基因序列成为微生物鉴定分类中的重要科学指标,已得到多数人认可[10-13]。本试验将序列测定结果与CCPP致病支原体16SrRNA序列进行同源性比较分析,结果所测序列与Mo标准Y98株的同源性为99.6%,而与丝状支原体的同源性均低于70.0%,进一步证实引起母羊患CCPP的病原为Mo。继万一元等[14]在贵州省罗甸等地分离到 Mmc后,本试验于贵州省患CCPP山羊组织病料中检测到Mo,为贵州省养羊业对CCPP所造成的山羊疾病进行重新的认识与定位提供了资料,并且为合理制定预防措施及根据本地毒株流行情况进行疫苗免疫提供了科学依据。
目前,暂无研究报道致CCPP的病原支原体可致山羊患繁殖障碍疾病,而本次试验所检测的病死母羊临床表现除CCPP症状外,还伴随流产发生。为深入探究CCPP与山羊流产与临床表现上有何联系,本试验将获得的Mo 16SrRNA序列片段与感染生殖道、易引起流产的支原体及尿原体16S rRNA序列比对并构建系统发生树进行进化关系分析,结果Mo与Mho处于同一分支,分子进化有共同特征。研究表明[15-17],Mho可引起女性泌尿生殖道疾病,感染Mho后女性常表现不孕症及流产,系统发生树分析Mo与Mho进化关系最近,其是否也可感染生殖道从而引起山羊发生流产,有待于进一步研究。
[1] 蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001:233-261.
[2] Thiaucourt F,Bolske G.Contagious caprine pleuropneumonia and other pulmonary mycoplasmases of sheep and goats[J].Review Science Technique Office International des Epizooties,1996,15(4):1397-1414.
[3] Hutcheon D.Contagious pleuropneumonia in goats at cope colony[J].South Africa Vet J,1889,29:399-404.
[4] 农业部畜牧兽医司.中国动物疾病志[M].北京:科学出版社,1993.
[5] 马保华,赵晓娥.新建羊场突发传染性胸膜肺炎的控制[J].动物医学进展,2000,21(4):77-79.
[6] 李希友,吕桂霞.山羊传染性胸膜肺炎的诊断与治疗试验[J].畜牧兽医杂志,2005,24(5):129-131.
[7] 宋勤业,张英杰,刘月琴,等.18种抗菌药物对绵羊肺炎支原体和丝状支原体分离株的抗菌活性[J].动物医学进展,2011,32(6):14-18.
[8] 李 劼,杨增岐,剡根强,等.新疆石河子地区绵羊支原体肺炎流行病学调查[J].动物医学进展,2005,26(12):109-110.
[9] 宋竹青,邱昌庆,周继章,等.奶牛流产鹦鹉热衣原体ompA基因的克隆与原核表达[J].中国人兽共患病学报,2010,26(2):140-143.
[10] 张双翔,周碧君,程振涛,等.山羊传染性胸膜肺炎病原快速诊断方法的建立[J].生物技术通报,2012,(3):95-99.
[11] 萨姆布鲁克J,弗里奇E F,曼尼阿蒂斯T.分子克隆实验指南[M].金冬燕,黎孟枫,等,译.北京:科学出版社,2002:34-57.
[12] DeSantis T Z,Hugenholtz P,Keller K,et al.NAST:a multiple sequence alignment server for comparative analysis of 16SrRNA genes[J].Oxford Univ Press,2006,34(2):394-399.
[13] Ohnishi A,Abe S,Nashirozawa S,et al.Development of a 16SrRNA gene primer and PCR-restriction fragment length polymorphism method for rapid detection of members of the genus megasphaera and species-l level identification[J].Appl Environ Microbiol,2011,77(15):5533-5535.
[14] 万一元,龙 鳌,万晴姣,等.贵州山羊传染性胸膜肺炎病原的分离鉴定[J].中国草食动物,2001,3(4):44-46.
[15] 杜振元,张玉芝.不孕妇女中支原体属和脲支原体属的检出率及其耐药性分析[J].中华医院感染学杂志,2010,20(13):1990-1991.
[16] Kilic D,Basar M M,Kaygusuz S,et.al.Prevalence and treatment of Chlamydia trachomatis,Ureaplasma urealyticum,and Mycoplasma hominis in patients with non-gonococcal urethritis[J].Jpn J Infect Dis,2004,57:17-20.
[17] Keane F E,Thomas B J,Gliroy C B,et al.The association of Chlamydia trachomatis and Mycoplasma genitalium with non-gonococcal urethritis:observations on heterosexual men and their female partners[J].Int J Std AIDS,2000,11:435-439.

