芥菜型油菜A9染色体黄籽基因区域BAC重叠群的构建
王 卓,袁玉辉,胡学芳,刘显军,刘旭东,刘忠松
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.湖南农业大学农学院,湖南 长沙 410128)
油菜是重要的油料作物,包括白菜型、芥菜型和甘蓝型三种类型,这三种类型的油菜具有共同的白菜来源的A 基因组[1]。A9 染色体是A 基因组中最长的染色体,长约37 Mb。A9 染色体上有控制种子大小[2]、种皮颜色[3]、硫苷合成[4-5]、油脂合成[6]等重要性状的基因。研究者对A9 染色体进行了大量研究,定位了大量SSR 标记,发现了许多基因[7-15]。Wang 等[16]公布了应用新一代测序方法测定的白菜基因组序列,为将这些标记、基因定位到A9 染色体对应BAC 和Scaffold 提供了基础。Mun 等[17]构建了由67468 个BAC 克隆组成的第一张白菜全基因组物理图谱,图谱上有242 个分布在10 个连锁群上的重叠群,长约717 Mb,对加速基因组序列分析、BAC 克隆序列的整合,以及芸薹属物种间的比较基因组研究起着重要的作用。
研究利用已构建的ZBjH BAC 文库,用A9 染色体上的标记进行PCR 步移筛选,构建重叠群,并与已测序的白菜A9 染色体物理图谱进行比较,分析芸薹属植物A9 染色体的进化和变异。构建芥菜型油菜A9 染色体黄籽基因区域物理图谱有助于黄籽候选基因的获得,为芥菜型油菜与白菜(白菜型油菜)、甘蓝型油菜A9 染色体进行比较物理作图提供基础,并为A9 染色体遗传图谱的加密和分子育种提供新的分子标记。
1 材料与方法
1.1 材 料
以芥菜型油菜作图群体亲本紫叶芥作为构建BAC 文库材料,提取植物幼叶总DNA,用Hind III不完全酶切,然后将酶切片段插入改良过的pIndigoBAC536 克隆载体构建芥菜型油菜BAC 文库即ZBjH 文库。ZBjH 文库包含71 808(384×187)个BAC 克隆,经用I-sceI 酶切后用脉冲场分离检测,插入片段大小在50~190 kb 之间,平均插入片段大小为126.7 kb,空载率2.7%,相当于芥菜型油菜1 068 Mb 基因组的8.7 倍。ZBjH BAC 文库由华中农业大学罗美中教授实验室协助构建。
1.2 方 法
主要用PCR 筛选法,利用遗传图的SSR 引物筛库,筛到的BACs 进行末端测序,然后将BAC 末端设计引物,筛选具有共同的核苷酸序列的BACs,对应于同一遗传位点的不同克隆必然拥有相同的核苷酸序列,表明它们的插入片段存在重叠区域,根据这一原理组建重叠群。
1.2.1 BAC 混合池构建 建立了3 个水平的BAC DNA 池(一级池、二级池和三级池)。一个三级池由一个平板的一行48 个克隆的DNA 组成(如34 号平板的AB,CD……OP);一个二级池由一个平板(含有384 个克隆)的DNA 组成;一个一级池由连续10 个的二级池的DNA 混合而成(如1~10,11~20……181~187),共19 个一级池。
1.2.2 BAC 混合池筛选 用PCR 技术进行油菜BAC DNA 文库(含187 个平板,每个平板含384 个克隆)的筛选分4 步进行。BAC DNA 文库筛选的第一步是对19 个一级池的筛选;得到阳性一级池后(如18 号一级池),对其所含的10 个二级池(从171~180)进行第二步筛选;得到阳性二级池后,对其所含的8 个三级级池(如171 号的AB,CD,EF,GH,IJ,KL,MN,OP)进行第三步筛选;得到阳性三级池后,对48 个克隆进行菌落PCR(第四轮)筛选,得到单一阳性克隆。
1.2.3 测 序 将菌落PCR 筛选,得到的单一阳性克隆摇菌过夜,由华大基因公司测BAC 末端序列。
1.2.4 BAC 末端引物设计和文库再筛选 得到的BAC 末端序列用软件Primer Premier 5.0 设计BAC末端引物,BAC 末端引物命名方法是:BAC 的CMR/M13 端引物为BAC-L,而S1 端引物为BACR。用新设计的末端引物继续筛选ZBjH BAC 文库。
1.2.5 BAC 末端序列BLAST 分析 得到的BAC末端序列在http://brassicadb.org 上进行序列比对,构建BAC 重叠群。
2 结果与分析
2.1 BAC 重叠群的构建
从遗传定位研究中发现的共分离标记A9-88和A9-32 开始进行ZBjH BAC 文库筛选,A9-88 筛选到63-H-13、102-C-7、160-C-4、152-E-22、85-O-7 和110-H-12 等BACs,而A9-32 筛选到160-C-4 和31-O-21 2 个BACs。两个标记均筛选到BAC 160-C-4,测BAC 末端序列,通过设计BAC末端引物160C4L/R 继续筛选BAC 文库,向两端进行延伸。
试验共筛选出BAC752 个,末端测序395 个,得到BAC 末端序列674 条,设计BAC 末端引物533 对,构建了芥菜型油菜A9 染色体黄籽基因区域长约2.2 Mb 的BAC 重叠群,见图1。

图1 芥菜型油菜黄籽基因区域种子BAC 重叠群
此种子BAC 重叠群,左起BAC 末端标记124J24R,右至BAC 末端标记171J1L,图1 展示26个BAC 和64 个标记,其中SSR 标记10 个,BAC 末端标记49 个,根据白菜序列设计的STS 标记5 个。
有的标记本该筛选到BAC,却未能筛选到,如标记122I23L 未能筛选到BAC 68-D-18,但通过测序BAC 68-D-18,将其全长序列与标记122I23L 的序列进行比对,发现能比对上,说明BAC 68-D-18上有一段序列与标记122I23L 相同,应该可以被筛选到。出现这种情况的可能原因有:①建BAC DNA四级池时,由于提取高纯度的质粒DNA 难度较大,有的BAC 质粒DNA 浓度较低,PCR 筛选时未筛选到。②PCR 技术的原因,PCR 分4 步进行筛选时,可能漏筛。有的标记如184E24R 不能筛选到BAC 154-P-5,可能原因是:引物184E24R 是在重复区域设计的,能与多条序列比对上,因此,此标记不可靠,弃之。在图中挑选这26 个种子BACs 构建重叠群时,遵循的原则有两点:(1)尽可能多的标记能筛选到它;(2)标记序列不是重复序列。这样出现假阳性BAC 克隆的几率较小。
2.2 物理图谱比较
根据BAC 末端序列与白菜序列的比对结果和白菜、甘蓝型油菜转录组测序的结果,对白菜、甘蓝型油菜、芥菜型油菜A9 染色体黄籽基因区域支架(Scaffolds)序列排序进行比较,见图2。
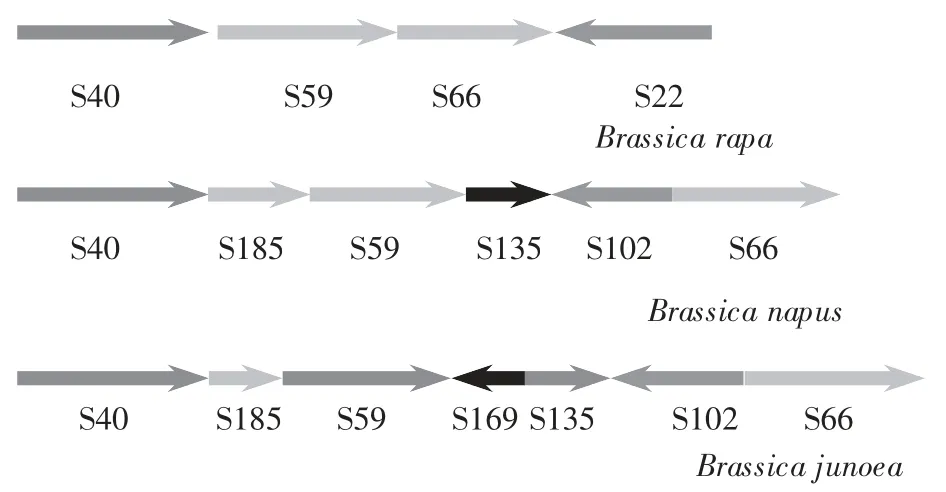
图2 芥菜型油菜与白菜型、甘蓝型油菜物理图谱比较
试验中构建的BAC 重叠群,定位在芥菜型油菜A9 染色体标记A9-121到A9-351之间,涵盖了Scaffold000040的一部分,Scaffold000185、Scaffold 000059、Scaffold0000169、Scaffold000135 和Scaff-old000102 的全部以及Scaffold000066的一部分,白菜A9染色体Scaffold000040、Scaffold000185、Scaffold000059、Scaffold0000169、Scaffold000135、Scaffold000102 及Scaffold000066 的长度分别为:1.87 Mb、207 kb、1.34 Mb、280 kb、460 kb、837 Kb及1.31 Mb,通过估算,研究构建的BAC重叠群约为2.2 Mb。
根据试验结果,发现芥菜型油菜A9 染色体支架(Scaffolds)序列排序与白菜、甘蓝型油菜都有不同,如图2 所示:Bancroft 等[18]认为白菜该区域附近的支架排序是:从左至右依次是000040 号支架、000059 号支架、000066 号支架、000022 号支架,而甘蓝型油菜在000040 号支架和000059 号支架之间正向插入了Scaffold000185 号支架,在000059 号支架和000066 号支架之间正向插入000135 号支架和反向插入000102 号支架,而笔者研究发现芥菜型油菜与白菜不同之处除了跟甘蓝型油菜一样正向插入000185 号支架和000135 号支架、反向插入000102 号支架外,还在000059 号支架和000135 号支架之间反向插入了约280 kb 的000169 号支架。这说明在芥菜型油菜进化过程中,A9 染色体序列也发生了插入、易位等结构重排,而且这种结构重排与甘蓝型油菜并不完全相同。
3 结 论
构建了芥菜型油菜A9 染色体黄籽基因区域长约2.2 Mb 的BAC 重叠群,为PCR 步移筛选法构建BAC 重叠群建立了方法,同时发现芥菜型油菜该区域DNA 序列与白菜、甘蓝型油菜都有较大差异。由于该区域可能处在着丝粒附近,序列高度重复,构建难度较大,要想将此重叠群向两端继续扩大,需综合特异性探针的杂交、PCR 筛选、酶切指纹分析、BAC 克隆STC 延伸、BAC 末端测序等多种方法。
[1]刘忠松,王 卓,刘显军,等.2012 油菜A9 染色体的标记、基因和结构变异[EB/OL].http://www.paper.edu.cn/index.php/default/releasepaper/content/201203-55.
[2]Yang P, Shu C, Chen L, et al.Indentification of a major QTL for silique length and seed weight in oilseed rape(Brassica napus L.)[J].Theor Appl Genet, doi:10.1007/s00122-012-1833-7.2012.
[3]刘显军,袁谋志,官春云,等.芥菜型油菜黄籽性状的遗传、基因定位和起源探讨[J].作物学报,2009,35(5):839-847.
[4]Feng J, Long Y, Shi L, et al.Characterization of metabolite quantitative trait loci and metabolic etworks that control glucosinolate concentration in the seeds and leaves of Brassica napus[J].New Phytologist, 2012, 193: 96-108.
[5]Wang H, Wu J, Sun S, et al.Glucosinolate biosynthetic genes in Brassica rapa[J].Gene, 2011, 487: 135-142.
[6]Zhao J Y, Huang J X, Chen F, et al.Molecular mapping of Arabidopsis thaliana lipid-related orthologous genes in Brassica napus[J].Theoretical and Applied Genetics, 2012, 124: 407-421.
[7]Panjabi P, Jagannath A, Bisht N C, et al.Comparative mapping of Brassica juncea and Arabidopsis thaliana using Intron Polymorphism (IP) markers: homoeologous relationships,diversification and evolution of the A, B and C Brassica genomes[J].BMC Genomics, 2008, 9: 113-131.
[8]Li F, Kitashiba H, Inaba K, et al.A Brassica rapa linkage map of EST-based SNP markers for identification of candidate genes controlling flowering time and leaf morphological traits[J].DNA Research, 2009, 16: 311-323.
[9]Li X, Ramchiary N, Choi S R, et al.Development of a high density integrated reference genetic linkage map for the multinational Brassica rapa Genome Sequencing Project[J].Genome, 2010, 53:939-947.
[10]Ramchiary N, Nguyen1 V D, Li X, et al.Genic microsatellite markers in Brassica rapa: Development, characterization,mapping, and their utility in other cultivated and wild brassica relatives[J].DNA Research, 2011, 18: 305-320.
[11]Xu J, Qian X, Wang X, et al.Construction of an integrated genetic linkage map for the A genome of Brassica napus using SSR mark ers derived from sequenced BACs in B.rapa[J].BMC Genomics 2010, 11: 594.
[12]Wang J, Lydiate D J, Parkin I A P, et al.Integration of linkage maps for the Amphidiploid Brassica napus and comparative mapping with Arabidopsis and Brassica rapa[J].BMC Genomics,2011, 12: 101.
[13]Ding G, Liao Y, Yang M, et al.Development of gene-based markers from functional Arabidopsis thaliana genes involved in phosphor us homeostasis and mapping in Brassica napus[J].Euphytica, 2011, 181: 305-322.
[14]Wang Y, Sun S, Liu B, et al.A sequence-based genetic linkage map as a reference for Brassica rapa pseudochromosome assembly[J].BMC Genomics, 2011, 12: 239.
[15]Jiang C, Ramchiary N, Ma Y, et al.Structural and functional comparative mapping between the Brassica A genomes in allotetraploid Brassica napus and diploid Brassica rapa[J].Theor Appl Genet, 2011, 123: 927-941.
[16]Wang X W, Wang H Z, Wang J, et al.The genome of the mesopolyploid crop species Brassica rapa[J].Nature Genetics,2011, 43: 1035-1039.
[17]Mun J H, Kwon S J, Yang T J, et al.The first generation of a BAC-based physical map of Brassica rapa[J].BMC Genomics,2008, 9: 280.
[18]Bancroft I, Morgan C, Fraser F, et al.Dissecting the genome of the polyploid crop oilseed rape by transcriptome sequencing[J].Nature Biotechnology, 2011, 29: 762-7.

