鲍林对于血红蛋白分子学领域的贡献
张宏志 李建
(1玉林师范学院 广西玉林 537000;2湖南省邵东县人民医院 湖南邵东 422802)
莱纳斯·鲍林(Linus Pauling,1901~1994)被认为是“第一位真正的分子生物学家”,他开拓了众多生物分子学新领域,包括抗体的分子机制、分子医学、分子精神病学、分子进化生物学等;他还提出了蛋白质的α螺旋结构,在DNA结构准确测定10多年以前,就准确地预言了其结构特征。加州理工学院的B. Kamb曾经评价:“鲍林的知识、创造力、开拓性没有哪里比分子生物学领域表现得更明显。他被看成是最伟大的化学家之一,也是第一位真正的分子生物学家。在这个领域,他的天才在于他具有认识复杂生物现象的分子基础的能力”[1]。笔者查阅相关资料,认为血红蛋白研究领域很能体现这位伟大化学家敏锐的“分子学”视角和卓越的科学创造力,所以在此对鲍林的血红蛋白分子学贡献进行介绍。
1 血红蛋白的分子结构
利用磁性实验研究血红蛋白(hemoglobin)的结构特征,是鲍林和科里尔(C.D.Coryell)在20世纪30年代主要开展的工作;从1935年在ProceedingsofNationalAcademyofSciencesoftheUnitedStatesofAmerica上发表题为《血红蛋白的氧结合平衡和结构解释》的论文起,鲍林在这一领域相继发表了20余篇论文。
1.1 血红素中铁的成键特征
血红蛋白分子由2条α链和2条β链组成,每条α链和β链都包含1个血红素。为了弄清血红素中铁的成键情况,鲍林提出了通过测量物质磁性推测其结构特征的方法。鲍林和科里尔一起先后成功地测定了亚铁血红素、铁血红素、珠蛋白血色素等物质的磁性,并且计算出化合物中金属中心的未成对电子数。
1936年,鲍林和科里尔报道了血色素及其衍生物的磁性特征和结构。鲍林认为,亚铁血红素及铁血红素的未成对电子数分别为4个和5个,与Fe(Ⅱ)、Fe(Ⅲ)的未成对电子数相同;磁性实验数据与形成4个dsp2共价键的说法不符,从而证实了在亚铁血红素及铁血红素中,Fe同相邻的卟啉N原子之间以离子键而不是以共价键的形式存在[2]。
鲍林在同一论文中还根据珠蛋白血色素、吡啶血色素、烟碱血色素、二腈血色素的未成对电子数为0的事实推测,在这些物质中,Fe(Ⅱ)可能是以d2sp3构型与其他原子形成共价键,Fe(Ⅱ)的2个3d轨道参与形成共价键;Fe(Ⅱ)同4个卟啉N原子及2个其他原子以八面体构型结合[2]。
1.2 氧分子与血红蛋白的结合
氧分子与血红蛋白如何结合的问题曾长期悬而未决。当时存在两种相反的观点,一种观点认为,氧非专一地吸附于血红蛋白的表面,以范德华力与血红蛋白结合;另一种观点认为,氧并不是非专一地吸附于血红蛋白表面,而是以特定的化学键与血红蛋白结合。为了解决这一争端,鲍林提出通过测量氧合血红蛋白的磁性作出判断,因为氧分子带有2个未成对电子而具有很大的磁矩。假设氧与血红蛋白以范德华力结合,那么未成对电子数将不会改变;而若氧与血红蛋白以化学键结合,则未成对电子数将发生变化[1]。鲍林通过测量发现,氧合血红蛋白的未成对电子数为0,而氧分子、脱氧血红蛋白的未成对电子数分别为2和16,说明当氧分子与血红蛋白结合时,电子结构发生了很大的变化[3];磁性实验的结果否定了氧分子是以范德华力吸附于血红蛋白表面的观点。
1.3 一氧化碳血红蛋白的分子结构
通过测量一氧化碳血红蛋白的磁性,鲍林发现它的未成对电子数为0,由此,他推测一氧化碳血红蛋白中的Fe(Ⅱ)也可能是以共价键与其他原子结合,即以d2sp3轨道形成八面体构型。在图1所示Fe(Ⅱ)的6个d2sp3轨道中,分别有4个与卟啉N原子、1个与珠蛋白原子(可能是N原子)、1个与C原子形成共价键。
根据1935年L.O.Brockway和P.C.Cross的报道,镍羰基化合物中的Ni-C键具有双键特征。据此,鲍林进一步提出了一氧化碳血红蛋白可能的两种共振结构(图2)[3]。

图1 一氧化碳血红蛋白的结构
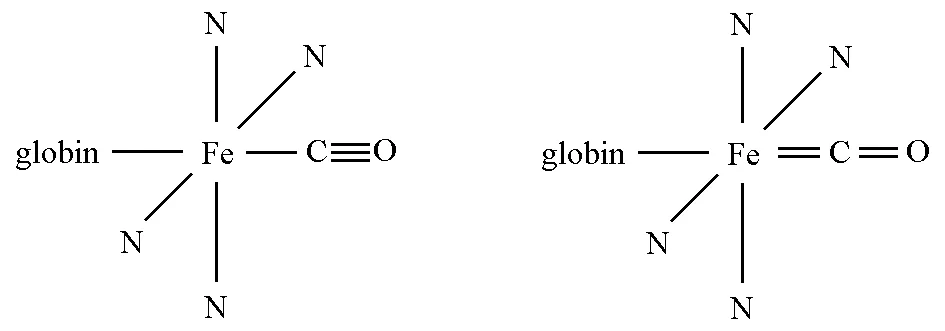
图2 一氧化碳血红蛋白的两种可能结构
同样,与磁性数据相符的氧合血红蛋白可能的共振结构如图3所示[3]。
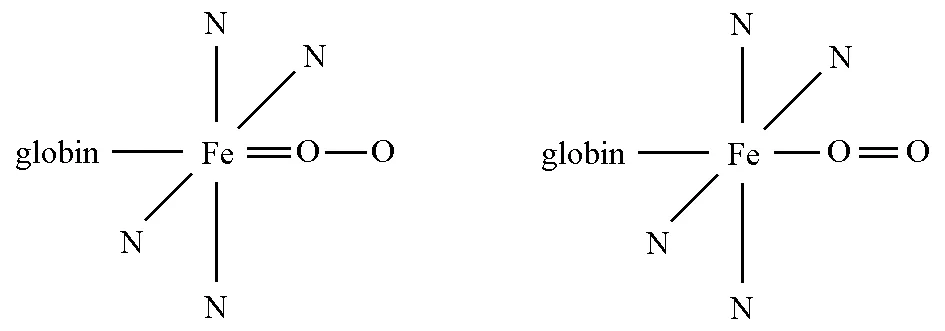
图3 氧合血红蛋白的两种可能结构
1936年,鲍林和科里尔报道了氧合血红蛋白和一氧化碳血红蛋白的磁性特征及其结构。鲍林指出,在结合氧分子或一氧化碳分子时,血红蛋白分子结构发生了巨大的变化;血红蛋白与铁形成的键是离子键;而氧合血红蛋白和一氧化碳血红蛋白分子没有未成对电子,血红蛋白与铁形成的键是共价键,这种键型的变化目前只在血红蛋白的衍生物中被观察到[3-4]。
在鲍林研究的基础上,英国化学家马克斯·佩鲁兹发现,脱氧血红蛋白的Fe(Ⅱ)处于高自旋态,其离子半径为78pm;而氧合血红蛋白的Fe(Ⅱ)处于低自旋态,其离子半径为61pm。在脱氧血红蛋白分子中,Fe(Ⅱ)处于卟啉环平面上方约80pm处,当Fe(Ⅱ)结合O2时,其离子半径缩小了17pm,使Fe(Ⅱ)从卟啉环的上方落入环的平面内,从而为氧与血红蛋白的进一步结合创造了有利的立体化学条件[5]。
2 镰刀型细胞血红蛋白与分子病
利用电泳实验研究镰刀型细胞血红蛋白是鲍林和哈维·伊泰诺(H.A.Itano)在20世纪40年代末到50年代主要从事的研究工作之一;从1949年鲍林和伊泰诺在JournalofHematology发表题为《镰刀型细胞贫血症的快速诊断》的论文起,鲍林等人相继发表了15篇有关的论文。
2.1 镰刀型细胞血红蛋白的电泳速度
镰刀型细胞贫血症(sickle cell anemia)是一种遗传性疾病,主要在非洲黑色人群中发生。1910年,美国医生J.B.Herrick发现,镰刀型细胞贫血症患者的红血球在静脉循环和动脉循环中发生周期性的变化。病人的红血球在动脉血中是正常的圆盘状,而在静脉血中却是异常的镰刀状。
人们一般认为,镰刀型细胞贫血症仅仅是一种红细胞变形而引起的典型细胞型疾病(a classic disease of cells);鲍林却认为,镰刀状化只发生在静脉循环中而不发生在动脉循环中,强烈地暗示了镰刀型细胞贫血症是一种血红蛋白分子的疾病;周期性的变化可能与血红蛋白在静脉循环中以脱氧血红蛋白形式而在动脉循环中却以氧合血红蛋白的形式存在有关[1]。另外,在O2不出现的情况下,镰刀型细胞贫血症患者的血液用CO饱和后也不会发生镰刀状化,说明了镰刀状化可能与血红蛋白分子有关;CO与O2分别能与血红蛋白结合成性质相似的一氧化碳血红蛋白或氧合血红蛋白[1],从而可防止血红蛋白细胞的镰刀状化。
根据上述推测,鲍林做了3种类型镰刀型细胞血红蛋白(HbS)和正常血红蛋白(HbA)的对比实验:① 一氧化碳血红蛋白溶液;② 亚铁血红蛋白溶液(加入连二亚硫酸钠);③ 一氧化碳血红蛋白溶液(加入连二亚硫酸钠)。其中在第②类实验中加入连二亚硫酸钠的目的是防止亚铁血红蛋白被氧化为铁血红蛋白;第①、③类实验的差异仅仅在于是否加入连二亚硫酸钠,目的在于检验连二亚硫酸钠本身是否对电泳有影响[6]。
哈维·伊泰诺是一位医学博士,1945年在圣路易斯大学获得博士学位;1946年9月,经导师E. A.Doisy教授推荐来到帕萨迪那跟随鲍林进行镰刀型细胞血红蛋白研究。鲍林和伊泰诺发现,镰刀型细胞血红蛋白在电场中的移动速度比正常血红蛋白快;在磷酸盐缓冲溶液中,镰刀型细胞一氧化碳血红蛋白的移动速度为2.63×10-5cm/s,而正常一氧化碳血红蛋白的移动速度为2.23×10-5cm/s[6],即移动速度存在0.40×10-5cm/s的差异。镰刀型细胞血红蛋白与正常血红蛋白所带的电荷也是不同的,前者在电场中向负极移动,后者在电场中向正极移动,说明镰刀型细胞血红蛋白和正常血红蛋白分别带正电荷和负电荷。
2.2 镰刀型细胞血红蛋白的等电点
鲍林和伊泰诺进一步比较了镰刀型细胞血红蛋白和正常血红蛋白的等电点(表1)。
他们发现,正常人一氧化碳血红蛋白的酸碱滴定曲线在等电点附近是线性的,等电点1个pH单位的变化相应于血红蛋白分子13个电荷变化,这个结果与1937年B.German对马氧合血红蛋白实验得到的结果一致。
正常脱氧血红蛋白与镰刀型细胞脱氧血红蛋白等电点的差值为0.23,正常一氧化碳血红蛋白与镰刀型细胞一氧化碳血红蛋白等电点的差值为0.22,可以计算出,镰刀型细胞血红蛋白与正常血红蛋白之间有3个电荷的差异;考虑到可能的实验误差,鲍林和伊泰诺得出结论,每个镰刀型细胞血红蛋白分子比正常血红蛋白分子具有额外的2~4个正电荷[6]。

表1 磷酸缓冲溶液中的等电点(μ=0.1)
2.3 镰刀型细胞血红蛋白的电泳图谱
鲍林和伊泰诺还比较了4种血红蛋白溶液的电泳图谱(图4)。

图4 4种不同类型血红蛋白的电泳图谱磷酸盐缓冲溶液中(pH=6.90):(a) 正常血红蛋白,单峰;(b) 镰刀型细胞贫血症血红蛋白,单峰;(c) 镰刀型细胞贫血症携带者血红蛋白,双峰;(d) 镰刀型细胞贫血症血红蛋白与正常血红蛋白各50%,双峰
镰刀型细胞贫血症携带者是正常与镰刀型细胞贫血症的中间阶段,症状比镰刀型细胞贫血症轻。实验显示,镰刀型细胞贫血症携带者的血红蛋白是正常血红蛋白和镰刀型细胞血红蛋白的混合体,大约各占50%。鲍林推测,镰刀型细胞贫血症患者的基因是一种纯合体(homozygous condition),有两条带病的等位基因;而携带者的基因是一种杂合体(heterozygous condition),只有一条带病的等位基因[7]。
1949年11月,鲍林和伊泰诺在Science上发表了题为《镰刀型细胞贫血症——一种分子病》的论文[6],详细报道了镰刀型细胞血红蛋白与正常血红蛋白的差异,并且讨论了镰刀型细胞血红蛋白结晶的原因、遗传机制等问题。
鲍林对镰刀型细胞血红蛋白的研究第一次展示了这种疾病的分子基础,第一次提出分子病的概念,吸引了医学科研人员从分子层次上进行疾病研究。1956年,英国科学家V.M.Ingram联合使用电泳和纸层析技术对镰刀型细胞血红蛋白进行研究,发现了镰刀型细胞血红蛋白的单氨基酸替换现象:正常血红蛋白β链的第6位置是谷氨酸,而镰刀型细胞血红蛋白β链的第6位置却变成了缬氨酸;谷氨酸带一个单位的负电荷,缬氨酸不带电荷,这就进一步解释了鲍林和伊泰诺发现的镰刀型细胞血红蛋白与正常血红蛋白的带电荷数及电泳速度的差异。
3 血红蛋白氨基酸序列与分子钟
对血红蛋白氨基酸序列与生物进化问题的探讨是鲍林和埃米尔·朱克坎德尔(E.Zuckerkandl)在20世纪60年代的主要研究领域。从1959年鲍林在ChemicalandEngineeringNews发表题为《分子和进化》的论文起,鲍林和朱克坎德尔一共发表了8篇论文。
3.1 指纹图谱与物种的亲缘关系
联合使用电泳和纸层析技术,鲍林比较了3种类型的指纹图谱:
① 一个物种在不同阶段的指纹图谱。例如,成年人与胎儿的指纹图谱比较。
② 不同物种在一定时期的指纹图谱。例如,人与黑猩猩、大猩猩、猩猩和罗猴的指纹图谱比较;人与牛、马、猪的指纹图谱比较;人与硬骨鱼、肺鱼和鲨鱼的指纹图谱比较。
③ 一个物种在不同时期的指纹图谱[8]。
从①的比较中发现,成年人的指纹图谱与人的胎儿的指纹图谱相差很大,而成年人的指纹图谱与成年马的指纹图谱却比较相似;鲍林推测,对环境的适应性因素可能是造成这种现象的重要原因[8]。从②的比较中发现,灵长类动物的指纹图谱与人的指纹图谱十分相似,牛和猪的指纹图谱与人的指纹图谱相差较大,而鱼的指纹图谱与人的指纹图谱相差更大;从猪、牛、人指纹图谱的两两相互比较中,鲍林发现猪、牛与人的变化往往出现在相同的部位;鲍林推测,可能在血红蛋白分子中存在着容易突变的区域,或者这些区域的突变更易于被自然选择保存下来[8]。
鲍林还根据人与灵长类动物指纹图谱的相似性,对正常基因和突变基因的稳定性进行了推测。鲍林认为:人的血红蛋白与灵长类动物的血红蛋白相比没有大的变化,反映了血红蛋白α、β链的正常基因与突变基因相比具有更大的稳定性,突变基因往往会回复突变(back-mutation)回到正常基因;除了自然选择因素之外,基因本身的热力学稳定性也可能是决定等位基因分布的重要因素[8]。
3.2 分子钟与物种分歧的时间
根据人与马血红蛋白氨基酸数目的差异以及古生物学证据,鲍林和朱克坎德尔还推断出每个有效突变的时间。人与马血红蛋白的α链大约有150个氨基酸,每条α链上具有9个有效的突变。由于人与马是在大约1.3×108年前分歧的,据此可以计算出每个有效突变的时间约为1.45×107年[1]。
1962年,在论文《分子病、进化与基因的异质性》中,鲍林和朱克坎德尔进一步推断出物种分歧的时间和相应的地质时期[1]。在表2中,δ链和γ链的氨基酸数目的差异为36个,物种分歧的时间为260百万年前的石炭纪前期;α链和β链的氨基酸数目差异更大,其祖先序列出现在565百万年前的石炭纪末期。
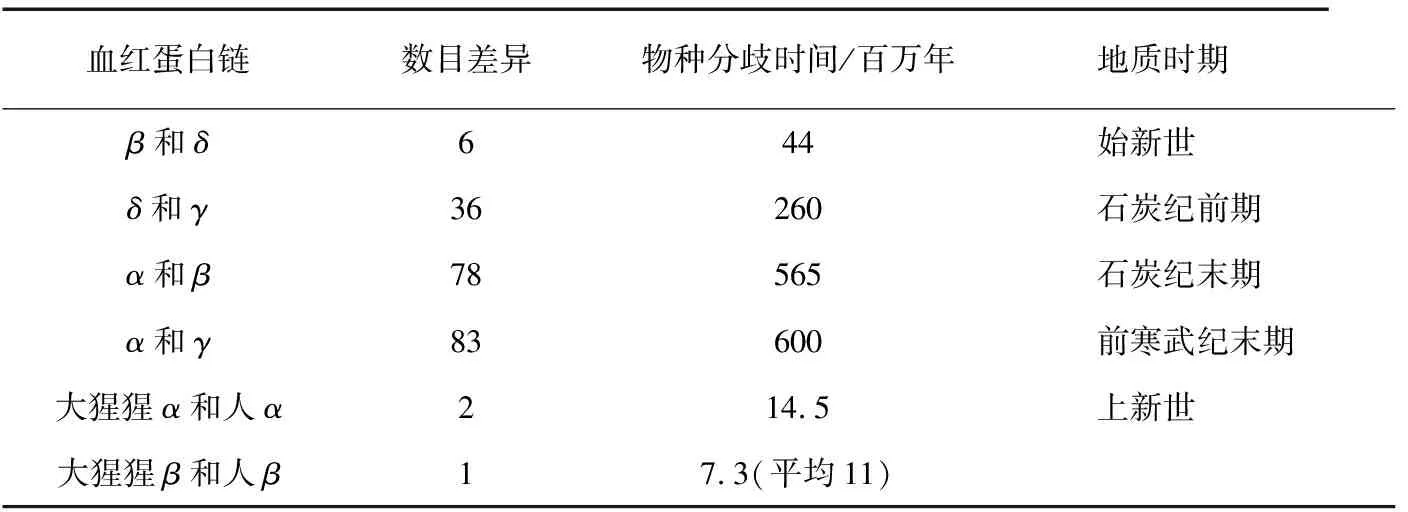
表2 血红蛋白链与物种分歧的时间
1964年9月17日,由V.Bryson和H.Vogel组织的“进化的基因和蛋白质”学术会议在美国罗格斯大学的微生物研究所举行,朱克坎德尔正式提出了分子钟的概念。罗格斯会议被认为是现代分子进化生物学的标志[7]。在罗格斯会议之后,人们就分子学与形态学方法的优劣、分子的异速进化进行了热烈的讨论,这些讨论促进了生物学家、分子生物学家、进化论者以及遗传学家之间的交流。
3.3 已灭绝生物的分子复原
1963年,鲍林和朱克坎德尔提出了重建灭绝生物氨基酸序列的方法[9]。鲍林指出,如果两条同源多肽链上指定分子部位的氨基酸残基是一样的,那么就有一定的把握认为这个氨基酸残基在它们祖先序列上也同样存在;如果在3条同源多肽链中的两条链上出现同一个氨基酸残基,而在另一条链上不出现,那么可以推断,是生物进化中的突变导致了这种差异[9]。
分子复原研究的重要意义在于,可以获得古代生物功能、生物环境的信息,获得高于分子水平的认识。鲍林认为,根据现存物种相关多肽链的古生物化学研究,可以推测灭绝生物基因的组成;如果合成这些灭绝生物的组成部分,不仅可以研究它们的物理化学特性,还可以推测它们的生物功能。例如,血红蛋白对氧的亲和性、对pH的依赖性以及祖先酶对底物的亲和性等。当灭绝生物的古基因信息积累得足够多时,做出有机体整体的推断将变得可能[9]。
鲍林和朱克坎德尔的分子进化生物学研究,开创了探讨物种亲缘关系、物种分歧时间、灭绝生物的新途径,将“古生物学、进化生物学和分子生物学等领域统一起来了”[10]。G.T.Morgan指出,20世纪60年代见证了分子进化生物学的诞生,鲍林与朱克坎德尔奠定了这个新学科的基础[7]。
4 结语
鲍林对于血红蛋白分子学领域的贡献,开创了分子医学和分子进化生物学的新领域,对后续研究产生了重要的影响。以分子钟为例,几十年来,科学家相继在分子钟理论、分子钟应用、宽松分子钟方法等方面取得了重要的进展。
1963年,E.Margoliash在研究细胞色素C时发现,马和猪、金枪鱼、酵母的氨基酸数目差异分别为3、19、44,显示了亲缘关系和遗传距离之间的联系[11];1968年,M.Kimura在Nature上发表了题为《分子水平上的进化速率》的论文,提出遗传漂移和中性理论,为分子钟奠定了理论基础。
20世纪80年代,测序技术的发展促进了DNA分子钟的研究。1980年,T.Miyata对人、鼠、兔的研究发现,各种哺乳动物DNA的进化速率几乎一样;1986年,R.J.Britten的研究却发现,人与啮齿动物DNA的进化速率存在着明显差异[12];1993年,DNA进化速率与机体大小的关系引起了人们的注意,虽然一般认为有机体的大小并不直接影响分子进化的速率,但大的有机体往往具有长生命周期和慢代谢速率;1994年,D.M.Rand发现,这些差异可能通过某种方式影响mtDNA的突变率[12]。
在应用方面,分子钟已经应用于前寒武纪生物大爆发、被子植物的起源、人类的起源等许多领域。前寒武纪是地球生命演化的重要时期,但前寒武纪生物大多是软体类生物,化石记录贫乏,而分子钟为前寒武纪生物研究开辟了新的途径。1996年,R.F.Doolittle对57种酶蛋白的531个氨基酸序列进行分析,所得到的系统树与16rRNA系统树在分枝的长度和顺序上非常吻合。通过这项研究,R.F.Doolittle认为原核生物和真核生物的分支时间约为20亿年,为植物和动物分支时间的两倍。1996年,G.A.Wray对后生动物门类的分子钟研究表明,原口动物和后口动物在12亿年前分支,并得出了在前寒武纪已经出现后生动物的结论[13]。
在人类的起源方面,1986年,牛津大学的科学家从对现代8个种群的700个个体的β胡萝卜素基因的研究得出结论,人类祖先来源于非洲并不断向外迁移;1987年,R.L.Cann等对5个地理区域的147个人的胎盘提取mtDNA的研究表明,所有这些mtDNA主干都来自20万年前的非洲祖先[14]。
在分子的异速进化方面,科学家也进行了多方面探讨,发展出了目前的宽松分子钟方法,包括相对速率检验法、局域分子钟法、贝叶斯计算法等。这些探讨大大深化了分子钟研究,取得了许多重要的成果。
[1] Kamb B,Kamb L P,Pauling P J,etal.Linus Pauling.New Jersey:World Scientific Publishing Co Pte Ltd,2001
[2] Pauling L,Coryell C D.ProcNatlAcadSciUSA,1936,22(3):159
[3] Pauling L,Coryell C D.ProcNatlAcadSciUSA,1936,22(4):211
[4] 贾德森.创世纪的第八天.李晓丹译.上海:上海科学技术出版社,2005
[5] 北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学.第4版.北京:高等教育出版社,2003
[6] Pauling L,Itano H A,Singer S J,etal.Science,1949,110(2865):543
[7] Mead C,Hager T.Linus Pauling.Corvallis:Oregon State University Press,2001
[8] Zuckerkandl E,Jones R T,Pauling L.ProcNatlAcadSciUSA,1960,46(10):1350
[9] Pauling L,Zuckerkandl E.ActaChemScand,1963,17:10
[10] 托马斯·哈格.鲍林——20世纪的科学怪杰.周仲良,郭宇峰,郭镜明,译.上海:复旦大学出版社,1999
[11] 杨群,丛培允,孙晓燕,等.古生物学报,2009,48(3):365
[12] Kumar S.NatRevGenet,2005,6(8):654
[13] 柯叶艳,齐文同.地质论评,2002,48(5):457
[14] 唐先华,赖旭龙,钟扬,等.地学前缘,2002,9(2):467

