仿刺参体表微生物的菌相分析
成 功, 裴 赢 莹, 张 公 亮, 侯 红 漫
( 大连工业大学 食品学院, 辽宁 大连 116034 )
0 引 言
仿刺参(Apostichopusjaponicus)作为餐桌上的佳肴早已闻名遐迩。2003年,我国海参的总产量只有3.9万t左右,2008年已经达到了9万t,经济总产值超过200亿元。但是,随着海参养殖量的增加,海区的养殖压力加大,海水污染严重,加上海参本身的水分、蛋白质含量高,是一种很好的培养基,使得海参体内外含有丰富的微生物类群,甚至存在着多种致病菌[1]。因此,近年来频繁出现“腐皮综合症”,导致海参大批量死亡[2]。
目前,国内外对海参微生物菌群的研究还不够系统,特别是海参体表微生物的组成更是少有报道。孙奕等[3]从刺参前后消化管、体腔液和表皮上分离到359株细菌分别属于弧菌属、假单胞菌属、奈瑟氏球菌属(Neisseria)、不动杆菌属、柄杆菌属(Caulobacter)、黄杆菌属(Flavobacterium)、节杆菌属(Arthrobacter)、微球菌属(Micrococcus)、黄单胞菌属(Xanthomonas)、产碱菌属(Alcaligenes)这11个主要菌属。向怡卉等[4]对大连产海参(仿刺参)不同部位的细菌进行了分离鉴定,得到3种菌株,分别为Kocuriaroseastackebrandt、棒状杆菌(Corynebacteriumsp.)和有毒威克斯菌(WeeksellaviroseHolmes),其中有毒威克斯菌是一种致病菌,其余两种为优势菌。
本实验对大连冬、春两季海参体表微生物进行分离培养,同时结合表型鉴定和分子遗传学鉴定的方法对未知菌进行准确定位,较为系统地分析了海参体表的微生物菌群,为海参病害原因分析、防治以及海参生产加工提供一定的参考依据。
1 实 验
1.1 材 料
2009年11月23日和2010年3月5日从大连长兴鲜活海产品市场购买质量约为200 g的大连仿刺参,在运输过程中加养殖所用海水,并且充氧以保持样品的鲜活状态,30 min内运至实验室。用灭菌生理盐水冲洗数遍,无菌条件下剪取各部分体表样品。
1.2 样品处理
称取10 g体表样品加入90 mL无菌生理盐水,用灭菌匀浆器充分研磨均匀后,以10倍递增稀释法进行稀释,取3个合适的稀释度涂布于2216培养基[5]、葡萄糖琼脂培养基和TCBS培养基[6]。每个稀释度做3个平行,25 ℃培养48 h。
1.3 细菌的分离纯化
挑选菌落数在30~300个的平板,综合菌落形态和细胞形态分离纯化所有菌株。
1.4 细菌的鉴定
1.4.1 细菌的形态和理化特性检测
参照《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》。对分离纯化的菌株作革兰氏染色,在光学显微镜下观察细菌形态,然后进行生理生化特性测定,并作初步鉴定和常规分类。
1.4.2 模板制备及16S rDNA的PCR扩增
将初步鉴定分类好的细菌接种于相应的液体培养基,25 ℃,150 r/min过夜培养后,按照细菌基因组DNA提取试剂盒说明提取细菌DNA,作为PCR反应的DNA模板。PCR扩增引物为通用引物27f和1492r,PCR扩增条件:94 ℃ 5 min,30个循环(94 ℃ 60 s;60 ℃ 40 s;72 ℃ 90 s),72 ℃续延伸10 min。PCR扩增产物用0.8%的琼脂糖凝胶电泳检测。
1.4.3 16S rDNA序列分析
PCR扩增产物送至测序公司测序。将测序结果在NCBI网站中利用Blast软件在GenBank数据库中进行相似性比较,选取同源性较高的相关菌株的16S rDNA序列作为参比对象,用Clustal X软件按照最大同源性的原则进行多序列比对。
1.4.4 构建系统进化树
采用MEGA4.0软件依据邻位相连法对所有分离鉴定菌株的16S rDNA序列与GenBank数据库中序列进行分析比较,绘出系统进化树。
2 结果与讨论
2.1 细菌的分离与培养
挑取稀释度为10-3的样品分别涂布于3种培养基,不同培养基获得的菌落数量有明显的差异,对3种培养基进行菌落计数,结果如表1所示。
表1 仿刺参体表菌群的数量
Tab.1 The quantity of the surface microflora ofApostichopusjaponicus
组别c/(μmol·L-1)t/h244872A值抑制率/%A值抑制率/%A值抑制率/%对照组01.414±0.0041.376±0.0221.192±0.008实验组1001.128±0.003a20.251.015±0.001a26.220.791±0.003a33.651500.874±0.003a38.190.815±0.003a40.750.604±0.003a49.262000.642±0.000 6a54.620.534±0.002a61.170.420±0.003a64.782500.513±0.006a63.720.405±0.008a70.600.283±0.002a76.253000.317±0.003a77.600.273±0.003a80.160.072±0.007a93.98注:a表示差异P<0.05。
2.2 生理生化反应
从仿刺参体表分离得到的菌株经革兰氏染色后,镜检观察菌体形态和菌落形态,根据镜检结果将其划分为10组,然后对这10组菌做常规生理生化实验,结果如表2所示。
表2 细菌生理生化结果
Tab.2 The results of bacterial physiological and biochemical analysis

组别12345678910形状rrrrrc/rrrrc革兰氏染色-------+++运动性+++++--++-接触酶-++++-++++氧化酶++++-+----葡萄糖产酸+--+++++++葡萄糖产气----------吲哚------+--+明胶液化+-++++-++-柠檬酸盐-+----++--注:r为杆菌,c/r为球杆菌,c为球菌;“+”代表阳性反应;“-”代表阴性反应。
2.3 菌株16S rDNA的PCR扩增
将菌株的PCR扩增产物通过0.8%的琼脂糖凝胶电泳,得到PCR扩增产物的大小1 500 bp左右,凝胶电泳图如图1所示。图1中的目的条带大小为1 500 bp,为各菌株的16S rDNA,之后将各菌株的PCR扩增产物送至测序公司测序。

图1 菌株PCR产物凝胶电泳图
2.4 菌株16S rDNA的同源性比对
将测定菌株的16S rDNA的序列在GenBank数据库中,与GenBank数据库中已知16S rDNA序列相似性最高为100%,最低为97%。结果表明,从大连地区仿刺参体表分离得到的细菌分属于10个菌,分别为交替假单胞菌属、希瓦氏菌属、假单胞菌属、弧菌属、枯草芽孢杆菌、变形菌属、Alteromonadaceas、不动杆菌属、解淀粉芽孢杆菌、腐生葡萄球菌。仿刺参体表细菌的菌相组成如表3所示。
2.5 仿刺参体表可培养细菌的系统发育学分析
仿刺参体表细菌的系统进化树分析表明,所得到的19条有效序列中交替假单胞菌属(Pseudoalteromonas)和弧菌属(vibrio)同属于γ-变形菌纲;变形杆菌属(Proteobacterium)、腐生葡萄球菌(Staphylococcussaprophyticus)、解淀粉芽孢杆菌(Bacillusamyloiquefaciens)、枯草芽孢杆菌(Bacillussubtilis)同源关系较近;Bacillussubtilis(AY881647.1)与Vibrio-cyclitrophicus(AM422804.1)同源关系较近。仿刺参体表细菌的系统进化树如图2所示。
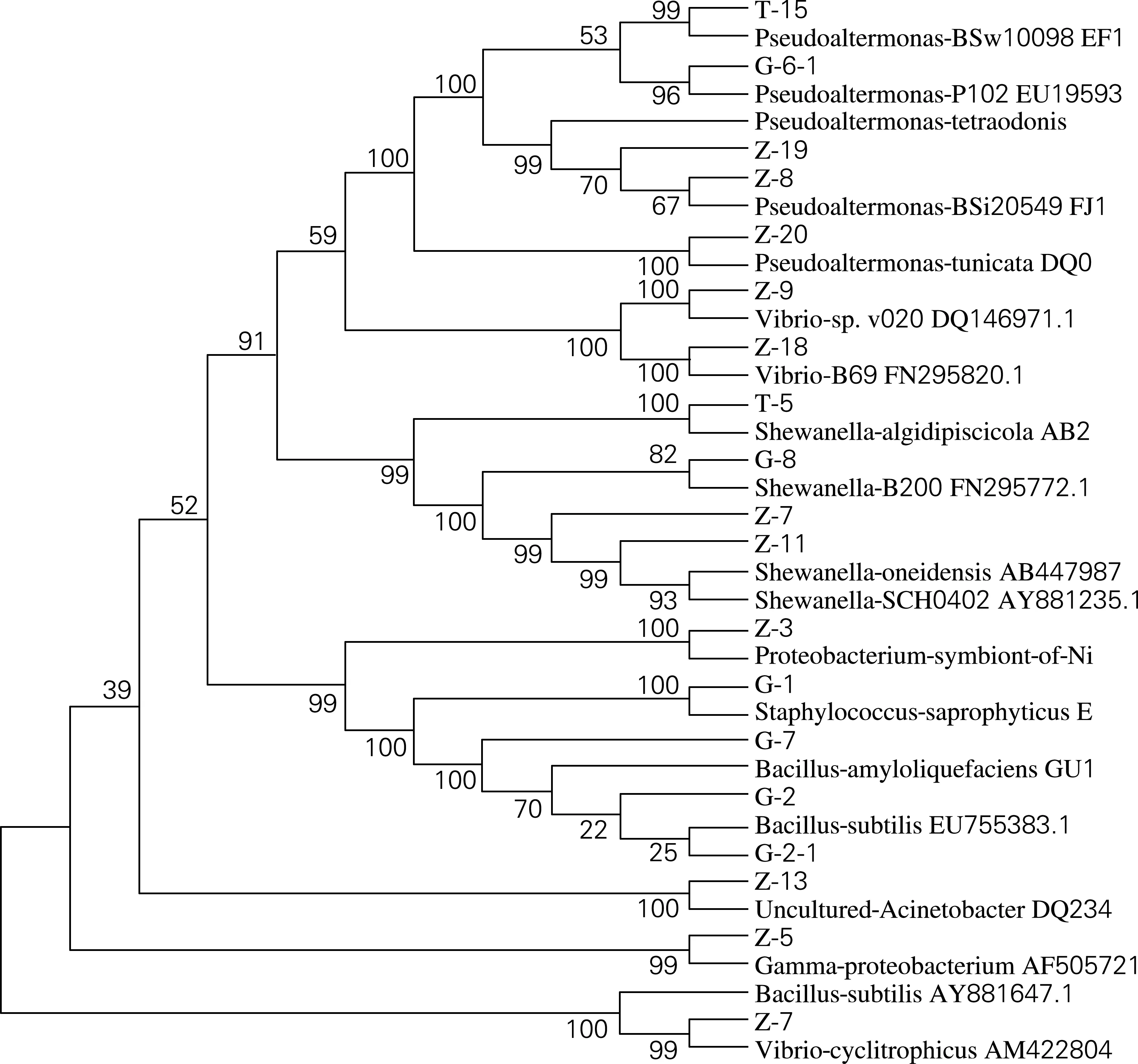
图2 仿刺参体表细菌系统进化树
Tab.3 The composition of bacterial flora on the surface ofApostichopusjaponicus
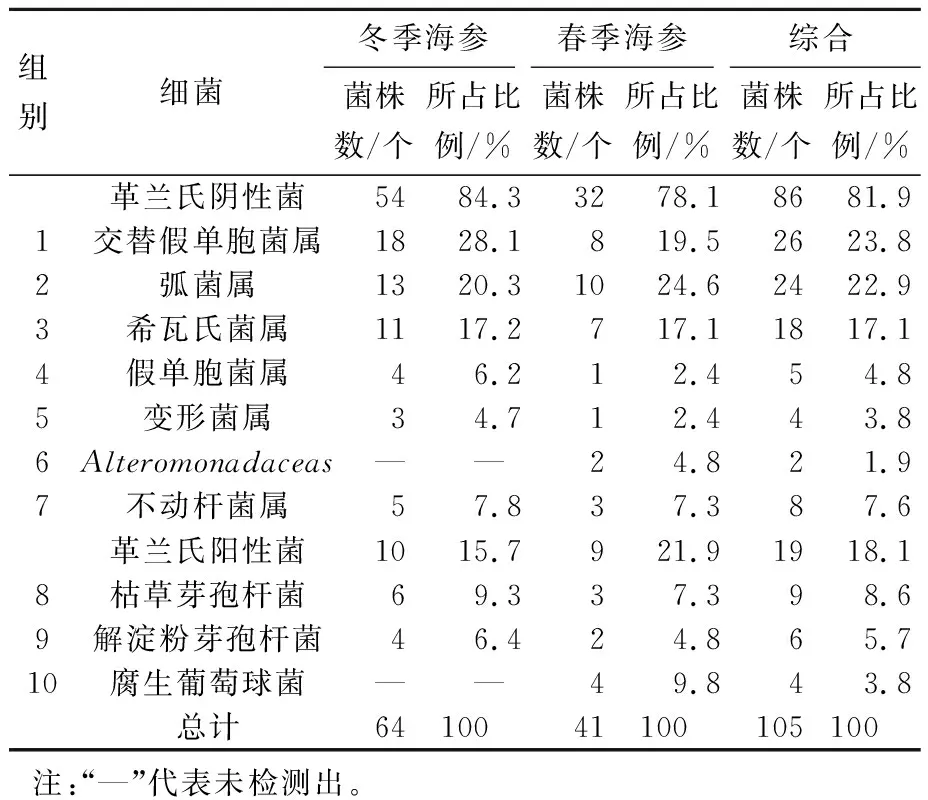
组别细菌冬季海参春季海参综合菌株数/个所占比例/%菌株数/个所占比例/%菌株数/个所占比例/%革兰氏阴性菌5484.33278.18681.91交替假单胞菌属1828.1819.52623.82弧菌属1320.31024.62422.93希瓦氏菌属1117.2717.11817.14假单胞菌属46.212.454.85变形菌属34.712.443.86Alteromonadaceas——24.821.97不动杆菌属57.837.387.6革兰氏阳性菌1015.7921.91918.18枯草芽孢杆菌69.337.398.69解淀粉芽孢杆菌46.424.865.710腐生葡萄球菌——49.843.8总计6410041100105100注:“—”代表未检测出。
3 讨 论
本研究表明,从大连仿刺参体表分离得到的细菌中的假单胞菌属、弧菌属、不动杆菌属、芽孢杆菌属为海水中主要的细菌[7-8],说明这些细菌很可能是附生在仿刺参体表的。从仿刺参中分离得到大量的交替假单胞菌,交替假单胞菌是海洋底部泥土中一种非常常见和重要的细菌,是一种条件致病菌,在海带、海藻、鱼类、贝类等海洋生物体内都有分布,它的营养要求低,能生活在各种环境中。交替假单胞菌能产生内毒素、脂酶、卵磷脂酶、蛋白酶及外毒素等,这些物质很多与致病性有关。仿刺参体表中分离出大量该菌种,很可能与仿刺参的生活习性有关。目前关于交替假单胞菌的致病性研究和关于其性质的报道比较少,孟庆国等[9]在国内外首次报道交替假单胞菌是养殖刺参溃疡性的病原菌。
腐败和致病菌是危害水产品细菌学研究的两个主要方面,其中对腐败菌的研究更为普遍。假单胞菌和希瓦氏菌为常见优势腐败菌,特别是在水产品的冷却链过程中假单胞菌和希瓦氏菌为鲜活水产品的特定腐败菌[10]。本实验在冬春两季的海参体表均分离出一定数量的希瓦氏菌和假单胞菌,因而建议尽可能缩短海参加工前的冷藏过程。
许多报告指出,在自然环境中有相当多的菌种(约90%~99%)用传统的纯培养方法无法培养出来[11];并且利用传统技术对微生物菌群进行培养时,会不可避免地造成菌株的富集或衰减,对结果造成偏差。如果将传统的纯培养技术和非培养技术结合使用,则可以相辅相成,更全面地反映复杂环境中微生物群落的种类。
[1] 石晓辉,李太武,陈燕,等. 发病仿刺参细菌的分离鉴定和生长特性的研究[J]. 水产科学, 2009, 28(8):435-438.
[2] 王印庚,荣小军,张春云,等. 养殖刺参爆发性疾病——“腐皮综合症”的初步研究与防治[J]. 齐鲁渔业, 2004, 21(5):44-47.
[4] 向怡卉,苏秀榕,董明敏,等. 海参细菌的分离鉴定和生长特性研究[J]. 中国食品学报, 2006, 6(1):25-29.
[5] NAOMI W R, FRED A R, ERKO S. A study of the bacterial flora associated with Holothuria atra[J]. Journal of Experimental Marine Biology and Ecology, 1996, 203(1):11-26.
[6] 覃映雪,王晓林,鄢庆枇,等. 青石斑鱼肠道菌群研究[J]. 海洋水产研究, 2007, 28(5):18-23.
[7] 潘蔚明. 海洋渔业环境监测中的细菌监测[J]. 海洋水产科技, 1994(1):38-41.
[8] LA ROSA T, MIRTO S, MARINO A, et al. Heterotrophic bacteria community and pollution indicators of mussel-farm impact in the Gulf of Gaeta(Tyrrhenian Sea)[J]. Marine Environmental Research, 2001, 52(4):301-321.
[9] 孟庆国,吴刘记,吴信忠,等. 养殖刺参溃疡病病原学研究[J]. 水产科学, 2006, 25(12):636-639.
[10] GRAM L, HUSS H H. Microbioloical spoilage of fish and fish products[J]. International Journal of Food Microbiology, 1996, 33(1):121-137.
[11] RONDON M R, AUGUST P R, BETTERMANN A D. Cloning the soil metagenome:a strategy for accessing the genetic and functional diversity of uncultured microorganisms[J]. Applied and Environmental Microbiology, 2000, 66(6):2541-2547.

