大亚湾生态监控区的浮游植物年际变化
王 雨, 林 茂, 林更铭, 王春光, 项 鹏
(国家海洋局 第三海洋研究所, 福建 厦门 361005)
大亚湾生态监控区的浮游植物年际变化
王 雨, 林 茂, 林更铭, 王春光, 项 鹏
(国家海洋局 第三海洋研究所, 福建 厦门 361005)
依据国家海洋局、国家海洋局第三海洋研究所等权威机构 2004~2007年所获的数据和资料, 对大亚湾生态监控区近4a长时间尺度的浮游植物群落年际变化进行分析, 通过物种组成、丰度变化、优势类群演替、群落结构及赤潮灾害事件来反映生境的退化, 探讨其变化的主要原因及趋势。结果表明,浮游植物群落由暖水种占绝对优势转变为广温广布种占主导地位。种类与丰度呈逐年下降的态势, 浮游植物丰度的分布保持西高东低, 近岸高于远岸的特征, 浮游植物的高丰度与营养盐丰富及温排水有关。终年以硅藻为优势种群, 优势种演替具有明显的季节与年际变化, 细长翼根管藻(Rhizosolenia alata f. gracillima)是春季稳定的优势种, 柔弱拟菱形藻(Pseudo-nitzschia delicatissma)是夏季稳定的优势种,春末甲藻的优势度增加明显。浮游植物群落多样性指数呈逐年下降趋势, 均匀度呈逐年上升态势。浮游植物的异常增殖及过度集中导致多样性较低, 种间比例不均匀, 群落结构单一。赤潮季节性发生频繁, 发生频率及引发种类呈上升趋势, 海洋环境脆弱。
生态监控区; 大亚湾; 浮游植物; 年际变化; 空间变动
为掌握近海海洋生态系统的变化动态, 国家海洋局自2004年起正式启动生态监控区监测计划, 在全国沿海选取典型区域作为重点监控对象, 开展连续海洋环境监测与评价工作, 加强近海海洋环境管理和生态恢复[1]。生态监控区监测计划实施以来的监测结果表明, 至 2007年, 中国近海海洋生态系统受损恶化的趋势尚未得到有效缓解, 大部分海湾、河口、滨海湿地等生态系统仍处于亚健康或不健康状态, 主要表现在水体富营养化及营养盐失衡、河口产卵场退化、生境丧失或改变、生物群落结构异常等[1-2]。大亚湾生态监控区是南海区一个重要监控区域, 受人类活动干扰强度日益增强, 海洋环境恶化日益严重, 处于亚健康状态, 正经历着快速的退化过程[3-5]。因此, 大亚湾生态监控区的连续长期监测工作对经济快速发展下亚热带海湾生态环境的保护以及揭示人类活动干扰下海湾生态系统的演化规律具有重要现实意义和示范作用。
海洋浮游植物是海洋物质转化和能量循环中的重要环节, 为海洋生物提供其赖以生存的物质基础的同时, 又去除过量 N、P、Si营养盐, 有效防止水体富营养化, 在水体自净过程中起着极为重要的作用, 受近海生态环境变化的显著影响[6-9]。同时海洋浮游植物的种类组成、群落结构和丰度变动直接或间接地制约着海洋生产力的发展, 并能改变海洋碳通量[10]、云反照率[11]、海水光通量与热通量[12], 从而改变全球气候, 影响人类的生存。因此海洋浮游植物群落变化特征深受关注。
大亚湾浮游植物研究始于20世纪80年代初期,徐恭昭等对其分布做过调查[13-15]。90年代之后, 陆续有一系列对大亚湾浮游植物的研究报道, 仅限于局部海域或某个季节, 重点关注的是大鹏澳核电站海域和澳头养殖水域[16], 涉及整个海域的浮游植物群落结构研究可追溯到 2002年孙翠慈等[17]的报道,而长时间尺度的浮游植物群落变化特征偶见于 2004年之前的报道, 之后并无专门论述[5,15-16]。近年来大亚湾生态环境发生了较大变化, 浮游植物群落结构深受其影响[4-5,17]。本文主要根据国家海洋局、国家海洋局第三海洋研究所、南海环境监测中心2004~2007年开展大亚湾生态监控区监测工作所获的监测数据和资料, 对大亚湾生态监控区近4a长时间尺度的浮游植物群落年际变化进行分析, 主要通过物种组成、丰度变化、优势类群演替、群落结构及赤潮灾害事件反映生境的退化, 探讨其变化的主要原因及趋势, 这将有助于揭示近年来大亚湾海洋生态演变过程, 为海洋生物资源的持续利用提供参考。
1 研究区域概况和研究方法
大亚湾生态监控区位于南海北部, 地理位置介于 22º30′~22º50′N, 114º29′~114º49′ E 之间, 西南邻香港, 西邻大鹏湾, 东接红海湾。面积 600 km2, 最大水深21 m, 平均为11 m, 是一个较大的半封闭性深水海湾。湾中部南北向分布的中央列岛(自北向南有纯州、喜洲、马鞭洲、小辣甲、大辣甲等)断断续续将海湾分成东西两半, 东部海岸相对较平直, 而西部岸线曲折, 汊湾深入陆地, 如大鹏澳和哑铃湾等。湾内水交换率低, 更新周期长, 受粤东沿岸上升流等影响, 环境因子季节性变化明显[14]。
根据大亚湾核电站放射性本底调查中监测站位的布置原则, 并结合海域使用现状, 确定浮游植物监测站12个(图1), 分别是西部近海的S1、S1、S3、S4测站, 东部海区的S5、S6、S7、S8、S9测站, 东南海域的S10、S11、S12测站。自2004~2007年, 每年暖水季节(春、夏两季)监测, 即3~4月、7~9月。浮游植物样品按照《海洋监测规范》[18], 用浅水Ⅲ型浮游生物网自海底至水面垂直拖网采样。样品现场用缓冲甲醛溶液固定。浮游植物种类鉴定参考金德祥、郭玉洁等的分类学专著[19-22]。
物种多样性指数(H′)、均匀度(J)采用以下计算公式:式中S为样品中的种类数,Pi为第i种的个体数与样品总个体数的比值[23-24]。
优势度的计算公式为Y=(ni/N)×fi,Y表示优势度,ni为第i种的总个体数,fi为第i种在各站位出现的频率,Y值大于0.02的种类为优势种[25]。
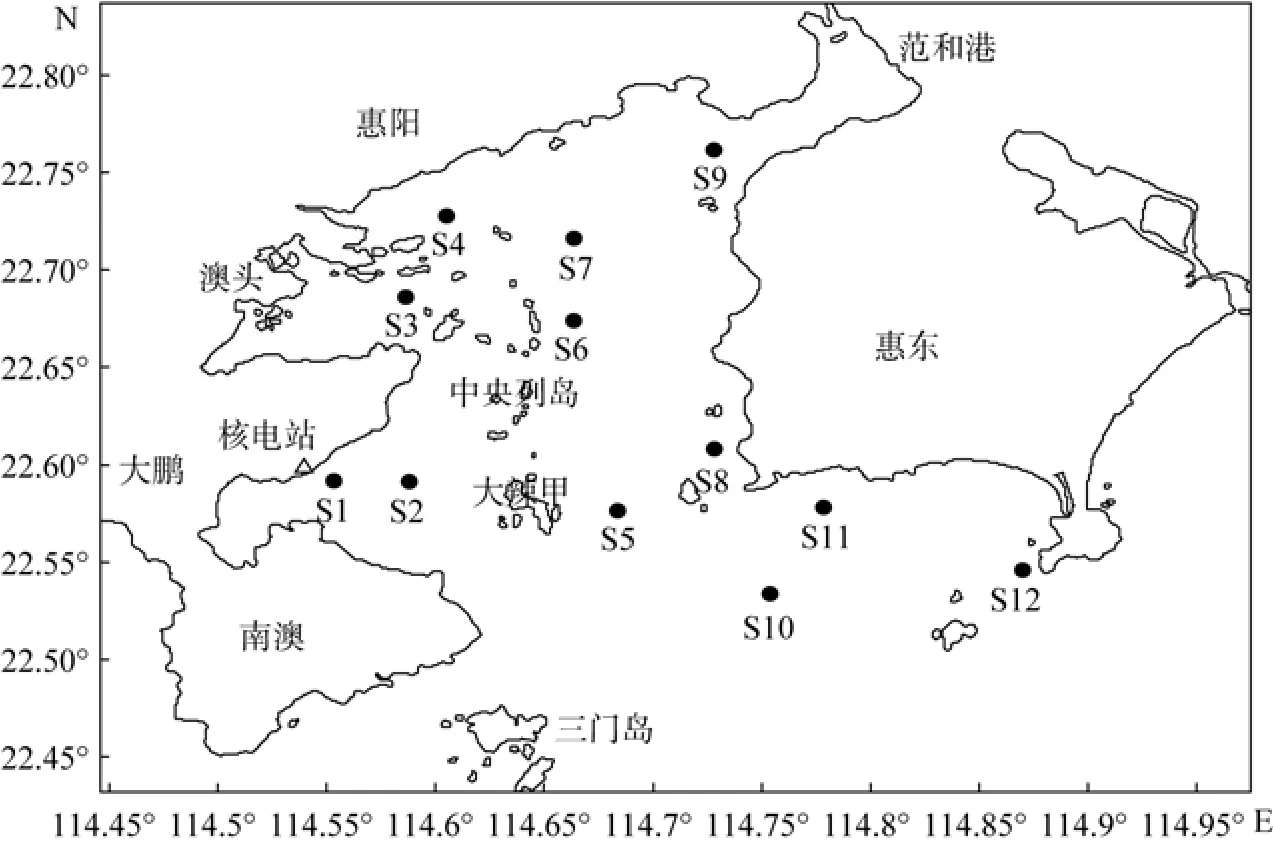
图1 大亚湾生态监控区的浮游植物监测站位Fig. 1 Stations for phytoplankton investigation in the Ecological Monitoring Zone of Daya Bay
2 结果与讨论
2.1 浮游植物种类组成及其年际变化
大亚湾生态监控区的浮游植物呈现亚热带生物的共同特性, 种类丰富, 种类组成以暖水性种类和广温性种类为主, 后者检出种类多于前者。近 4a共检出6门53属197种, 包括硅藻、甲藻、蓝藻、金藻和绿藻。硅藻不论从细胞密度还是种类上都占绝对优势, 共36属136种, 占总种类的69.0%, 其次为甲藻类, 共12属53种, 占26.9%; 蓝藻2属4种, 占2.0%(表1)。金藻1属2种, 占1.0%, 绿藻1属1种,黄藻 1属 1种。硅藻类检出种类最多的是角毛藻(Chaetoceros)、根管藻(Rhizosolenia)、圆筛藻(Coscinodiscus), 种类依次为 33种、20种、14种, 甲藻类的角藻(Ceratium)检出25种。这4属占总种数的46.7%, 其他49属共105种占53.3%。蓝藻零星检出束毛藻(Trichodesmium)和螺旋藻(Spirulina), 金藻仅检出等刺硅鞭藻(Dictyocha)的两个种, 黄藻和绿藻仅分别检出一种。赤潮浮游植物检出较多种类, 主要有扁面角毛藻(Chaetoceros compressus)、浮动弯角藻(Eucampia zoodiacus)、细长翼根管藻(Rhizosolenia alataf.gracillima)、脆根管藻(Rhizosolenia fragilissima)、小等刺硅鞭藻(Dictyocha fibula)、多纹膝沟藻(Gonyaulax polygramma)、红色裸甲藻(Gymnodinium sanguineum)、夜光藻(Noctiluca scintillans)、海洋原甲藻(Prorocentrum micans)、具尾鳍藻(Dinophysis caudata)、倒卵形鳍藻(Dinophysis fortii), 都是已记录的有毒赤潮生物, 在各次监测中均有检出, 在2004年至2006年春季浮游植物中所占比例较大, 而2007年则主要在夏季检出。此外幅杆藻(Bacteriastrum)、海链藻(Thalassiosira)、半管藻(Hemiaulus)和原甲藻(Prorocentrum)等的检出率也较高。

表1 大亚湾生态监控区主要浮游植物种属的年际比较Tab. 1 Yearly changes of phytoplankton genera and species in the Ecological Monitoring Zone of Daya Bay
监控区内浮游植物种类总体上呈逐年下降趋势(图 2)。硅藻类的种属呈减少的态势, 其占总种类的比率年际逐渐增加(表 1)。甲藻类的种属均减少, 其比率也降低(表 1)。蓝藻类的种属及其比率在 2007年减少得较为剧烈(表1)。种类的站位间差异分布在西部、东部海域体现较明显, 东南海域的种类分布较为均匀(图 3)。自 2004~2006年, 东部海域检出种类最多(S6测站), 东南海域次之, 西部近岸最少(S3测站)。而2007年西部近海种类检出跃升最多(S2测站),东部近海检出最少(S5测站)。春、夏两季差异较大(图2)。2004年和 2005年夏季种类多于春季, 而 2006年和2007年则春季种类多于夏季。2004年夏季检出最多种类为115种, 2007年夏季检出101种, 在2005年春季检出最少种类47种。监测发现, 西部近海的大鹏澳核电站排水口附近测站(S1、S2测站), 表现为浮游植物的种类季节变化与其他海域相反, 夏季检出种类少于春季, 而其他测站基本都是夏季检出种类多于春季(图2)。S1、S2测站的种类异常变化可能源于核电站温排水排放改变了附近海域水温的季节差异, 从而影响了浮游植物种类的季节变化规律[2,4,15-16]。不同的浮游植物种类对水温等因素影响的灵敏度不同, 其生长与繁殖也不同, 正是种类的不同和频繁季节交替, 才引导出浮游植物群落的多样性[2,17]。但如果温排水长期影响, 在此生活的浮游植物并没有更替或对季节变化不灵敏, 种群替换率低, 群落结构趋向单一[2-4]。

图2 大亚湾生态监控区浮游植物种类与丰度的年际变化Fig. 2 Yearly changes of species and abundance of phytoplankton in the Ecological Monitoring Zone of Daya Bay
2.2 主要生态类群及其年际变化
根据浮游植物种类对温度的适应性, 大亚湾生态监控区的浮游植物主要由广布性、暖水性及温带性群落组成。(1) 广布性类群主要为硅藻门的角毛藻、菱形海线藻(Thalassionema nitzschioides)、佛氏海毛藻(Thalassiothrix frauenfeldii), 还有近岸广温种中肋骨条藻(Skeletonema costatum)、丹麦细柱藻(Leptocylindrus danicus)、尖刺拟菱形藻(Pseudonitzschia pungens)、日本星杆藻(Asterionella japonica)等。这些类群种类多, 密度大, 是该海域的最重要生态类群。(2) 暖水性群落主要有硅藻门的距端根管藻(Rhizosolenia calar-avis)、平滑角毛藻(Chaetoceros laevis)、长角弯角藻(Eucampia cornuta)、柏氏角管藻(Cerataulina bergoni)、霍氏半管藻(Hemiaulus hauckii)、柔软几内亚藻(Guinardia flaccida)、太阳双尾藻(Ditylum sol)和甲藻门的原多甲藻属(Protoperidinium)等, 这些种类也是该海域的重要生态类群, 检出种类少于广布性种类。(3) 温带性类群种类较少, 主要为硅藻门的笔尖形根管藻(Rhizosolenia styliformis)、细弱海链藻(Thalassiosira subtilis)和甲藻门的具尾鳍藻(Dinophysis candata)和五角多甲藻(Peridinium pentagonum)等。该类群种类不多, 但在春季密度很高。
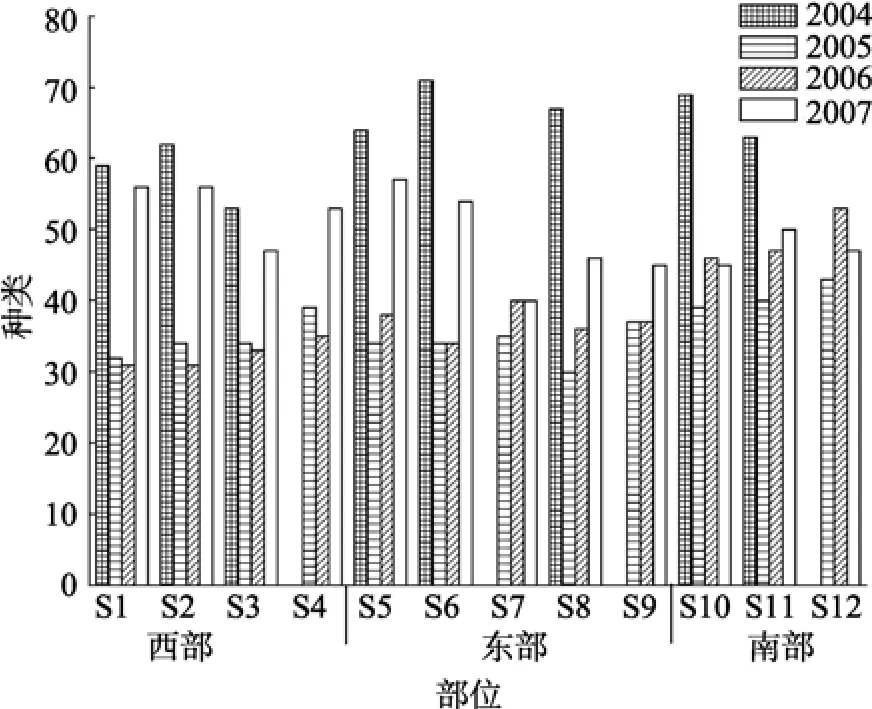
图3 大亚湾生态监控区浮游植物种类的空间变动Fig. 3 Spatial variation of phytoplankton species in the Ecological Monitoring Zone of Daya Bay from 2004 to 2007
浮游植物主要生态类群中, 广温种占总种类的49.6%, 暖水暖温种占总种类的 30.4%, 还检出少量的外海高盐性种类和淡水种。近 4a来, 浮游植物群落由暖水种占绝对优势转变为广温广布种占主导地位, 反映出广生态幅的生物个体有较强竞争力, 能耐受较恶劣的生境, 在环境变化时适应力更强, 这也说明监控海域遭受的污染压力增加, 耐污染种类相应增多[4-5,17]。此外, 监控区已经有两座核电站投入商业运营, 还有一座核电站在建设中, 温排水的热效应不容忽视[2-3,5]。温排水最直接的影响就是增强了局部海区的温度层结, 使海水的垂直对流减弱。温排水对海区浮游植物群落结构的负面影响显著, 通过海水升温的人工筛选, 暖水种被淘汰, 广温种得以存活, 群落结构趋于单一化, 不稳定性增加[3-4,14,17,31]。显著变化体现在核电站近海的S1、S2测站, 较之其他测站, 其广温种和暖水暖温种的比例变动较显著,暖水暖温种类在 2004年 S2测站占有最大比例为41.7%, 广温种类占50.8%, 之后至2007年暖水暖温种类检出率均不高于 22%, 而逐年的广温广布种类及检出率均超越暖水类群。S1测站2004年暖水暖温种类占35.8%, 广温种类占 52.4%, 之后暖水暖温种类比例逐年降低, 至2007年又上升为较高的28.1%。近4a的监测结果表明监控区广温广布种类及检出率均超越暖水类群。
2.3 浮游植物丰度的年际变化
监控区内浮游植物丰度年际变化较大, 介于4.46×104~1.53×108个/m3之间, 平均为 9.21×106个/m3(图 2)。硅藻丰度范围为 3.54×104~1.72×107个/m3,平均 8.61×106个/m3, 占总丰度的 95%, 最高值检出在2005年夏季的S9测站, 最低值检出在2006年夏季的 S7测站。甲藻丰度范围为 4.70×103~7.13×105个/m3之间, 平均 3.68×105个/m3。甲藻在 2007年春季的S10测站最高, 在2005年夏季的S5测站丰度最低。硅藻在丰度上占绝对优势, 但2007年硅藻丰度降低, 仅占总丰度的 79%, 而其他年份达 90%以上;2006年甲藻丰度为4.11×106个/m3, 占总丰度比例有所增加。
年际变化上, 浮游植物细胞丰度总体上是逐年减少的态势(图2)。西部近海和东部海区的浮游植物丰度逐年下降趋势明显, 东南海区浮游植物丰度则有较大波动, 呈缓慢上升态势(图 4)。丰度的密集中心位置不定, 年际变化大, 同一时间有1个密集区或者2个密集区, 如2004年夏季在西部近海的S1测站,2005年夏季在S3、S9测站, 2006年夏季在东南海域的 S11测站, 2007年春季在东部海区的 S8测站(图4)。近 4a来, 浮游植物丰度的总体分布态势保持西高东低, 近岸高于远岸的特征, 并且由小湾内向小湾外递减(图 4)。这与孙翠慈 2002年调查的大亚湾浮游植物细胞丰度平面分布大致相同[17]。降雨及陆源输入导致监控区营养盐通量增加, 并影响浮游植物丰度的分布[26-27]。西部近海的S1、S2测站, 因核电站温排水排入, 再加上养殖业都比较发达, 由径流输入的营养盐较高, 因而浮游植物丰度较高[2,4-5,16-17]。大亚湾监控区以东南季风为主, 藻细胞易随风、流等向西北方向的沿岸海区(S3、S4)聚集, 造成较高细胞丰度[15,17]。东部范和港S9测站的水体较浅, 水产养殖活跃, 海水养殖和废水排放会引起水体富营养化,致使浮游植物的丰度及生物量增加[28-29], 这是东部海区的高值区。位于外海水入湾处的S10、S11、S12测站与湾内其他测站相差较远, 因受环流影响大,此处海域多为广温广布种, 细胞丰度较高, 波动较大, 并且S11和S12测站因位于近岸海域而常具有较高的细胞密度。此外, 浮游植物丰度的春夏两季差异并无明显规律(图2), 尤其在2005年, 夏季浮游植物丰度高于春季近40倍之多。春季, 径流输入对浮游植物丰度影响减弱, 因此浮游植物密度仅在西部近岸养殖区的S3、S4较高。同时, 水动力条件使得中央列岛东北部的S6、S7站位风浪微弱, 利于浮游植物在此密集[15,17]。硅藻类的丰度变化与浮游植物丰度变化基本一致, 从西部近海向东部减少, 东南近岸又有所增加, 高值区出现在西部近岸的S1站和东南近岸的 S12站, 硅藻丰度分布决定了浮游植物的分布。甲藻丰度有增多的趋势, 以往的甲藻高峰值多在冬末春初[2,4-5,30], 如今高峰值检出在春、夏季, 说明春、夏产生甲藻赤潮的可能性增大[30-31]。甲藻除2005年夏季和2006年夏季在浮游植物丰度中所占比例较小外, 其余各次监测均占较大比例。有毒甲藻所产生的毒素可通过鱼、虾、贝等在食物链传递, 直接危害人类的健康甚至生命安全。

图4 大亚湾生态监控区浮游植物细胞丰度的空间变动Fig. 4 Spatial variation of phytoplankton abundance in the Ecological Monitoring Zone of Daya Bay from 2004 to 2007
2.4 优势类群的年际变化
监控区的浮游植物终年以硅藻为首要优势种群(优势度>0.02[25]), 优势种演替具有明显的年际变化(表2)。表2列出近4a监控区各次监测的主要优势种及其优势度。可见, 监控区最主要的优势种为细长翼根管藻和柔弱拟菱形藻(Pseudo-nitzschia delicatissma)。细长翼根管藻在2004~2006年春季及2007年夏季检出, 并且每次检出的优势度都较高。柔弱拟菱形藻在监控区内检出率也较高, 特别是2005年和2006年, 在监控区内占有绝对优势。总体上大亚湾监控区内浮游植物优势种年际变化明显(表2)。有时优势种类多, 但数量优势不明显, 有时则单一种类数量占绝对优势。细长翼根管藻是春季稳定的优势种, 柔弱拟菱形藻是夏季稳定的优势种, 在春末期间甲藻的优势度增加明显。在浮游植物优势种频繁交替过程中, 较大型的根管藻属种类繁盛的持续时间较长, 而较小型的角毛藻等属种类繁胜的持续时间较短。如, 细长翼根管藻是大亚湾生态监控区极为稳定的一个种类, 它在春季形成数量高峰, 占浮游植物的绝对优势, 持续到夏季消退, 而 2007年则反常的在夏季成为第一优势种类, 显示大亚湾内水文环境有所改变, 影响了细长翼根管藻的生长规律。常见的优势角毛藻种类有洛氏角毛藻(Chaetoceros lorenzianus)、旋链角毛藻(Chaetoceros curvisetus)、窄隙角毛藻(Chaetoceros affinis)、扁面角毛藻, 每年均有相当数量的分布, 高峰期检出在每年 7~9月的夏季。除了角毛藻为优势属外, 常见的硅藻优势种属还有距端根管藻(Rhizosolenia calcar-avis)、念珠直链藻(Melosira moniliformis)、菱形海线藻、海链藻、辐杆藻, 交替在浮游植物群落中占据优势。甲藻在春季和夏末秋初形成两个数量高峰, 优势种主要为叉状甲藻(Ceratium furca)、梭甲藻(Ceratium fusus)和夜光藻。角藻丰度的大幅增长, 预示着发生甲藻赤潮的可能性增大。
监控区的不同海域其优势种不尽相同, 西部近海和东部海区优势种多为近岸广布性种。春季(3~4月)由于适宜的水温和雨季里入湾营养盐含量的增加使得某些近岸广布性种类, 如佛氏海毛藻、洛氏角毛藻、窄细角毛藻、标志星杆藻(Asterionella notata)和尖刺拟菱形藻等大量繁殖, 成为西部近海的优势种。而在春末4月份时, 甲藻数量出现高峰, 成为主要优势种类, 其数量在西部近海高于东部海区。夏季(7~9月)水温最高, 盐度低于春季, 因而浮游植物以耐高温和盐度适应能力较强的种类占优势, 如柔弱拟菱形藻、中肋骨条藻、菱形海线藻以及角藻等, 集中检出在西部近海和东部海区。柔弱拟菱形藻是夏季最主要种类, 是区域优势种的稳定组成之一, 尤其在东南湾口海域较为突出。

表2 大亚湾生态监控区的浮游植物主要优势种及优势度的年际变化Tab. 2 Yearly changes of dominant species and relative dominance of phytoplankton in the Ecological Monitoring Zone of Daya Bay
2.5 浮游植物群落结构指数的年际变化
大亚湾生态监控区的浮游植物物种多样性、均匀度都不高。浮游植物多样性指数(H′)呈逐年下降趋势(图5), 均匀度略(J)呈逐年上升趋势(图5)。多样性指数变化范围在 0.51~3.53, 平均为 2.03。均匀度在0.43~0.72间变动, 平均为 0.49。浮游植物的异常增殖及过度集中导致多样性较低, 如, 2004年春季中肋骨条藻和细长翼根管藻异常增长, 2005年和2006年夏季东南海区的柔弱拟菱形藻异常增长, 均对其他种类的生长造成抑制。2005年夏季出现多样性指数和均匀度的明显低值, 这和柔弱拟菱形藻成为绝对优势种有关, 其数量占浮游植物总数量的95.8%。监控区浮游植物多样性较低的海域主要集中在东南湾口的S10、S12测站, 由于柔弱拟菱形藻丰长聚集所致, 多样性指数也表明该海区遭受重度污染。同时,东部范和港海域S9和北部的澳头湾(S3、S4测站)也遭受重度污染, 其余测站均为中度污染状态。夏季的多样性指数和均匀度低于春季。多样性指数在夏季偏低, 尤其在监控区西部近岸的核电站和大鹏澳养殖区(S1、S2测站)表现明显。夏季水温高, 雨量多致使盐度变化大, 阳光照射强, 不适宜浮游植物生长,种间比例并不均匀, 种类多样性较为单一, 优势种集中为少数个别耐高温高盐变化的种类[2,4,17]。北部海区的水交换能力较弱, 污染较重, 其多样性指数及均匀度均低于东部和东南海区, 东部海区多样性指数较高, 种间比例较为均匀。而东南海区的优势种数量过度集中, 多样性指数和均匀度值超过赤潮发生的阈值。
2.6 赤潮事件的变化分析
近4a大亚湾生态监控区发生的赤潮种类以甲藻为主, 如, 锥状斯氏藻(Scippsiella trochoidea)、五角多甲藻(Peridinium pentagonum)、海洋卡盾藻(Chattonella marina)多次引发赤潮, 主要发生在北部近海及东部的范和港海域(表3)。2004年发生赤潮2起, 累计面积101 km2。其中, 2004年春末(6月)份发生的红海束毛藻(Trichodesmium erytheracum)赤潮是广东省近年最大的一次赤潮, 漂浮于大辣甲至桑州连线以南海面, 一度宽达5.5 km, 长15 km, 面积近100 km2, 由于红海束毛藻的密度过高, 在夜间造成水体缺氧, 引发鱼类和底栖动物死亡。2004年夏(8月)发生在东升及坝光网箱养殖海域生物有毒赤潮造成个别网箱鱼类出现缺氧死亡现象, 为锥状斯氏藻、五角多甲藻所致。2005年夏(9月), 在大亚湾衙前海域发生有毒赤潮, 引发种类为海洋卡盾藻和锥状斯氏藻, 面积约 10 km2, 未造成直接经济损失。2006年春季至夏季, 东升村养殖区由海洋细菌引发“白水”现象。2007年夏季(7月)哑铃湾、澳头湾海域再次暴发海洋卡盾藻和锥状斯氏藻赤潮, 损失较严重。近4a的赤潮主要发生在哑铃湾、澳头湾海域, 原因是哑铃湾附近为较密集的居民城镇, 而生活污水未经处理就直接排海, 并且是较大型的海水养殖基地,带来一定的养殖污染[26,30]。澳头湾属半封闭海湾,海水交换能力较差, 极宜造成富营养化, 加上风微弱、气温高、光照充足, 形成了赤潮生物爆发性繁殖生长的生态条件[27,30-31]。监控区的甲藻赤潮主要发生在春季和夏季, 近年来其发生频率以及引发赤潮的种类都有上升的趋势。因而, 有必要密切注意有毒赤潮生物的生消演变, 以便有效预防赤潮的季节性发生。

表3 近4a大亚湾生态监控区的赤潮事件Tab. 3 Harmful alge bloom events in the Ecological Monitoring Zone of Daya Bay from 2004 to 2007
3 结语
大亚湾生态监控区处于亚健康状况, 面临水体污染、湿地减少、典型生态系统结构和功能退化等严峻问题, 正经历着快速的退化过程。2004~2007年的浮游植物监测结果表明, 浮游植物种类繁多, 以暖水种和广布性种类为主, 由暖水种占绝对优势转变为广温广布种占主导地位。种类与细胞丰度总体上呈逐年下降趋势, 浮游植物丰度的分布态势保持西高东低, 近岸高于远岸的特征, 浮游植物的高丰度与营养盐丰富及温排水有关。终年以硅藻为优势种群, 优势种演替具有明显的季节与年际变化, 细长翼根管藻是春季稳定的优势种, 柔弱拟菱形藻是夏季稳定的优势种, 在春末期间甲藻的优势度增加明显。浮游植物群落多样性指数呈下降趋势, 而均匀度呈上升态势。浮游植物的异常增殖及过度集中导致多样性较低, 种间比例并不均匀, 群落结构单一。赤潮季节性发生频繁, 海洋环境脆弱。
[1] 国家海洋局. 2007年中国海洋环境质量公报[R]. 北京: 国家海洋局, 2008: 12.
[2] 中国科学院南海海洋研究所. 大亚湾生态监控区海洋环境综合调查与评价2004年报[R]. 广州: 中国科学院南海海洋研究所, 2004: 83.
[3] 中国科学院南海海洋研究所. 大亚湾海域海洋生态环境变化及趋势分析[R]. 广州: 中国科学院南海海洋研究所, 2000: 246.
[4] 柯东胜, 高阳, 李秀覃, 等. 大亚湾生态问题成因分析及应对措施[J]. 海洋开发与管理, 2007, 32-36.
[5] 王肇鼎, 练健生, 胡建兴, 等. 大亚湾生态环境的退化现状与特征[J]. 生态科学, 2003, 22(4): 313-320.
[6] 王勇, 焦念志. 营养盐对浮游植物生长的上行效应的研究方法[J]. 海洋科学, 2000, 24 (11): 16-18.
[7] 杨清良, 陈其焕, 林金美, 等. 厦门马銮湾富营养化水域浮游植物群落的生态特征[J]. 海洋学报, 1998,20(1): 101-112.
[8] 何本茂, 韦蔓新. 北海湾水体自净能力的探讨[J]. 海洋环境科学, 2004, 23 (1): 16-18.
[9] 何本茂, 韦蔓新. 钦州湾的生态环境特征及其与水体自净条件的关系分析[J]. 海洋通报, 2004, 23 (4):50-54.
[10] Sarmiento J L, Toggweiler J R, Najjar R. Ocean carbon cycle dynamics and atmospheric pCO2[J]. Phil Trans R Soc Lond A, 1998, 325: 3-21.
[11] Charlson R J, Lovelock J E, Andreae M O, et al. Oceanic phytoplankton, atmospheric sulphur, cloud zbedo and climate[J]. Nature, 1987, 326: 655-661.
[12] Sathyendtanath S, Gouveia A D, Shetya S R, et al.Biological control of surface temperature in the Arabin Sea[J]. Nature, 1991, 349: 54-56.
[13] 徐恭昭. 大亚湾环境与资源[M]. 合肥: 安徽科学技术出版社, 1987: 162-175.
[14] 国家海洋局第三海洋研究所. 大亚湾海洋生态文集(Ⅱ)[M]. 北京: 海洋出版社, 1990: 27-34.
[15] 周贤沛, 林永水, 王肇鼎. 大亚湾水域浮游植物群落特征的统计分析[J]. 热带海洋, 1998, 17(3): 57-64.
[16] 王友绍, 王肇鼎, 黄良民. 近 20年来大亚湾生态环境的变化及其发展趋势[J]. 热带海洋学报, 2004,23(5): 85-95.
[17] 孙翠慈, 王友绍, 孙松, 等. 大亚湾浮游植物群落特征[J]. 生态学报, 2006, 26(12): 3948-3958.
[18] 国家海洋局. GB 17378.7-1998 海洋监测规范第6部分: 生物体分析[S]. 北京: 中华人民共和国国家质量监督检验检疫总局, 1999.
[19] 金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类[M].上海: 上海科学技术出版社, 1965: 1-230.
[20] 金德祥, 陈兆弟. 中国海洋底栖硅藻类(上、下) [M].北京: 海洋出版社, 1960: 1-321, 1-437.
[21] 郭玉洁, 钱树本. 中国海藻志 第五卷 硅藻门 第一册中心纲[M]. 北京: 科学出版社, 2003:1-493
[22] 林永水, 周近明. 南海甲藻(一)[M]. 北京: 科学出版社, 1994: 1-51.
[23] Shannon C E, Weaver W. The Mathematical Theory of Communication[M]. Urbana L: University of Illions Press, 1949.
[24] Pielou E C. An introduction to mathematical ecology[M]. New York: Wiley-Interscience, 1969.
[25] 孙军, 刘冬艳, 徐俊, 等. 1999年春季渤海中部及其邻近海域的网采浮游植物群落[J]. 生态学报, 2004,24(9): 2003-2016.
[26] 徐宁, 吕颂辉, 段舜山, 等. 营养物质输入对赤潮发生的影响[J]. 海洋环境科学, 2004, 23(2):20-24.
[27] 蔡树群, 韦桂峰, 王肇鼎. 外援输入对大亚湾大鹏澳浮游生物影响的模拟研究[J]. 生态科学, 2004, 23(2):101-105.
[28] Bonsdroff E, Blomqvist E M, Mattila J, Norkko A.Coastal eutrophication: causes, consequences and perspectives in the archipelago areas of the northern Baltic Sea[J]. Estuarine, Coastal and Shelf Science, 1997, 44:63-72.
[29] Cancemi G, Falco G D, Pergent G. Effects of organic matter input from a fish farming facility on a Posidonia oceanica meadow[J]. Estuarine, Coastal and Shelf Science, 2003, 56(5/6):1036-1044.
[30] 徐宁, 陈菊芳, 王朝晖, 等. 广东大亚湾藻类水华的动力学分析Ⅱ 藻类水华与营养元素的关系研究[J].环境科学学报, 2001, 21(4):400-404.
[31] 张玉宇, 吕颂辉, 齐雨藻. 2003~2004年大亚湾澳头养殖区水域浮游植物群落结构及数量变动特征[J].海洋环境科学, 2008, 27(2): 131-134.
Received: Dec.,10,2010
Key words:Ecological Monitoring Zone; Daya Bay;phytoplankton; yearly changes; spatial variation
Abstract:Based on a great deal of monitoring data and information obtained from National Oceanic Administration,the Third Institute of Oceanography and other authorities, the yearly changes and spatial variation of phytoplankton community in the Ecological Monitoring Zone of Daya Bay were studied. To assess the current status and further trend, the phytoplankton composition, abundance, dominant species, diversity and harmful algae bloom events from 2004 to 2007 were analyzed. Results showed that the main principal phytoplankton ecotypes were changed from warm-water species to eurythermy species. The species and abundance were yearly degressive. The distribution of phytoplankton abundance kept a trend of higher in the west coast and lower in the east and southeast coast, and higher alongshore and lower offshore. It is presented that the rich nutrients and warm water discharge affected the phytoplankton abundance. In the Ecological Monitoring Zone of Daya Bay the dominant species were mostly diatom with seasonal and yearly diversity and variability. Rhizosolenia alata f. gracillima was the predominant species in spring and Pseudo-nitzschia delicatissma was the predominant species in summer. Pyrrophyta started to be the ascendancy at the end of spring. The diversity of phytoplankton community was yearly decreased and the evenness of phytoplankton community was yearly increased. The unconventionality of phytoplankton multiplication led to lower diversity, species imbalance, monotony of community. Harmful algae bloom occurred frequently in spring and summer, and its frequency and classes were increased year by year. All of these indicated that the ecosystem of the Ecological Monitoring Zone of Daya Bay was vulnerable and undergoing a rapid deterioration.
(本文编辑:张培新)
Yearly changes of phytoplankton in the ecological monitoring zone of Daya Bay
WANG Yu, LIN Mao, LIN Geng-ming, WANG Chun-guang, XIANG-Peng
(The Third Institute of Oceanography, State Oceanic Administration, Xiamen 361005, China)
Q949.27
A
1000-3096(2012)04-0086-09
2010-12-10;
2011-02-11
国家海洋局青年海洋科学基金(2009130); 国家海洋局第三海洋研究所基本科研业务费专项资金(海三科 2009031, 海三科2009033, 海三科2009008)
王雨(1981-), 男, 硕士, 助理研究员, 从事海洋浮游生物生态的研究, E-mail: wy2007607@126.com; 林茂, 通信作者, 研究员,E-mail: lm3011@126.com
图5 大亚湾生态监控区浮游植物物种多样性指数与均匀度的年际变化
Fig. 5 Yearly changes ofH′andJof phytoplankton in the Ecological Monitoring Zone of Daya Bay

