大珠母贝游离珍珠培育研究
刘 永, 张春芳, 焦宗垚, 邓陈茂
(1. 广东海洋大学 珍珠研究所, 广东 湛江 524025; 2. 广东省海洋工程职业技术学校, 广东 广州 510320)
大珠母贝游离珍珠培育研究
刘 永1, 张春芳1, 焦宗垚2, 邓陈茂1
(1. 广东海洋大学 珍珠研究所, 广东 湛江 524025; 2. 广东省海洋工程职业技术学校, 广东 广州 510320)
2008~2010年, 在广西涠洲岛进行了大珠母贝(Pinctada maximaJameson)游离珍珠培育实验。实验过程中采用解剖法优选植核核位、几种术前处理方法和低温处理小片贝制备外套膜小片等技术, 旨在提高育珠贝留核率、成珠率和优珠率。结果表明, 在大珠母贝内脏囊缩足肌左右两侧各有一个适合培育游离珍珠的核位, 分别称为左袋和右袋, 实际操作中只有左袋可以植入珠核培育游离珍珠; 不同术前处理实验组的植核贝休养期成活率差异不显著(P>0.05), 但留核率、成珠率显著差异(P<0.05), 其中采用传统术前处理和低温处理相结合的综合术前处理方法可有效提高留核率、成珠率平均达 78.2%和80.1%; 低温处理小片贝与传统方法制备的大珠母贝外套膜小片的育珠效果(成珠率、优珠率、正圆珠比例)存在显著差异(P<0.05), 且在实验温度范围内, 成珠率、优珠率、正圆珠比例随处理温度的降低而增高, 在4~8℃达到最好育珠效果, 成珠率、优珠率和正圆珠比例分别达到98%、53%和30%左右; 在术后休养期, 植核贝吐核高峰出现植核后5~15 d, 手术伤口愈合时间为15~20 d, 育珠贝的死亡高峰出现在术后的第20~30天。在水温25~30℃条件下, 珠核表面形成珍珠层的时间为45 d左右。
大珠母贝(Pinctada maximaJameson); 核位; 术前处理; 小片制备
大珠母贝(Pinctada maximaJameson), 又称白蝶贝, 主要自然分布在印度洋和南太平洋沿海, 如澳大利亚、印度尼西亚、菲律宾、越南等国以及中国海南岛西海岸、广东省雷州半岛、广西涠洲岛海域。因为大珠母贝具有个体大、外套膜分泌珍珠质机能旺盛的特点, 是培育名贵“南洋珠”的最理想珍珠贝。澳大利亚是利用大珠母贝培育“南洋珠”最多的国家, 自 20世纪 50年代已经达到产业化生产的水平,其育珠技术先进, 留核率可达80%左右[1]。中国自20世纪80年代初也开始进行利用大珠母贝培育“南洋珠”技术的相关研究[2-7], 并且成功培育出了游离珍珠, 但留核率很低, 远远不能达到产业化生产的要求。育珠贝留核率低下是一个制约中国“南洋珠”养殖产业化的技术瓶颈。
目前, 中国养殖的海水珍珠品种单一, 绝大部分为利用马氏珠母贝培育的“南珠”, 其颗粒较小、珠层薄、价格低, 在国际市场上缺乏竞争力, 再加上养殖海区老化、品种退化等因素, 目前中国的“南珠”产业已经日趋萎缩。因此, 积极进行大珠母贝育珠技术研究对振兴中国海水珍珠产业有着非常重要的意义。作者采用新技术于 2008~2010年在广西涠洲岛进行了大珠母贝游离珍珠培育实验, 并从留核率、成珠率、优珠率比例几个指标比较以确定本技术的优越性。
1 材料和方法
1.1 材料
实验用贝: 为从广西涠洲岛购买的天然贝。植核母贝: 壳高 15~22 cm, 体质量 165.0~750 g, 健康无病害; 小片贝: 壳高 10.5~14.5 cm, 体质量125.0~450 g, 贝壳边缘外侧鳞片生长旺盛、边缘内侧珍珠层颜色为银白色或金黄色。
珠核: 为淡水丽蚌贝壳珠核, 直径8.0~10 mm。
笼具: 为传统锥形笼 (单圈笼), 底径 35.0 cm,高 15.0 cm, 网目 3.0 cm × 2.0 cm。
网袋: 由聚氯乙烯网片加工而成, 长×宽为25 cm×40 cm, 网目有20目和40目两种。
1.2 方法
1.2.1 大珠母贝核位的优选
阴干实验贝, 使其张开贝壳, 用锋利刀具快速沿左壳内侧切断闭壳肌, 除去左壳, 掀开鳃和唇瓣,通过外观初步观察软体部适合植核的核位, 再进一步从不同方位对初步确定的核位进行解剖, 观察核位附近的各种组织结构; 根据解剖和实际植核情况最终确定适宜的植核核位。
1.2.2 大珠母贝植核育珠实验
1.2.2.1 植核贝术前处理育珠实验
实验设传统术前处理(A组)、术前直接低温处理(B组)和传统术前处理+低温处理(C组)3个实验组和1个对照组(D组)。
传统术前处理方法: 在植核实验前1个月, 将拟植核贝进行活力调整, 方法是: 清除植核贝贝壳表面的附着物, 洗刷干净后装进 40目网袋中, 每袋装1只, 再将贝和网袋一起装于锥形笼中, 每笼装1袋,吊养于浮排上, 浮排吊绳间距 70 cm; 吊养水深1.8~2.0 m, 笼间距50 cm。每5~7 d检查一次贝体的生理状态, 同时洗刷笼具。如果观察到母贝离水竖直放置10 min左右张开贝壳, 用开口钳进一步开口时感到黏合力适度(不需太大力度便可撑开), 就可进行插核手术。本术前处理过程一般需要需15~30 d。
术前直接低温处理方法: 将母贝清洗干净, 栓口后直接置于 12~14℃的海水中低温处理 0.5~1 h,待软体部温度降至与处理水温一致时再进行植核手术。
传统术前处理+低温处理: 经过活力调整的植核贝在栓口后再置于 12~14℃的海水中低温处理 0.5~1 h, 待软体部温度降至与处理水温一致时再进行植核手术。
对照组的植核贝除进行必要的清洗外未经其他方法处理。
小片制备参照常规马氏珠母贝小片制备方法[8]。
1.2.2.2 采用低温冷冻处理小片贝制备外套膜小片育珠实验
实验分7个实验组: A、B、C、D、E、F为低温处理小片贝实验组, 分别对应 4、6、8、10、12、14℃共 6个实验温度梯度, 常温小片制备组为对照组。低温冷冻处理小片贝制片方法: 将小片贝清洗干净置于实验温度梯度的过滤海水中低温冷冻处理1~2 h; 用刀具切断闭壳肌和软体部, 将贝体分成两半, 使每片贝壳上有完整的外套膜; 使用经消毒的海水冲洗外套膜及软体部等处的污物; 用手术刀沿与外套膜边缘垂直的方向切割外套膜, 使外套膜成宽度为3~5 mm条状, 再以色线为中心切成3.0 mm ×3.0 mm~6.0 mm × 6.0mm的正方形小片(图1A); 再将其从贝壳上取下置于点滴板的凹穴中, 滴上数滴3%的红汞水溶液, 进行染色和消毒(图1B), 5 min后即可使用。
植核贝采用传统术前处理+低温处理的综合术前处理方法。1.2.2.3 插核手术及术后休养与育珠

图1 小片的制备Fig. 1 Saibo-preparation
植核手术: 参照马氏珠母贝的插核方法[8]。使用大珠母贝专用插核工具, 采取先片后核法, 植核部位为左袋; 根据核位的大小选择植入珠核的规格;珠核使用1%氨苄西林水溶液浸泡。
术后休养: 植核后的育珠贝置于海区进行术后休养。将植核贝装进20目网袋中, 用绳将网袋固定在锥形笼中并使植核贝呈水平状态, 将其吊养于风浪小、水流缓慢的海区进行休养。吊养水深1.5~2.0 m,休养期为30 d, 每2~3 d检查一次; 观察各实验组植核贝术后休养期伤口愈合及生长情况。休养一个月后, 将套在植核贝外面的网袋摘除, 统计各组植核贝休养期成活率及留核率。
育珠贝经过 1年半的育珠期开珠, 统计育珠贝成活数量、育珠贝留核率、成珠率及优珠率等指标。
1.2.2.4 数据统计方法及数据处理
各技术指标数据的统计方法如下:
休养期成活率= (休养期结束后成活植核贝数/植核贝总数)×100%
留核率= (成活植核贝中收获珍珠及珠核数量/成活贝中植入珠核的数量)×100%
成珠率= (成活植核贝中收获珍珠数量/成活植核贝中收获珍珠及珠核数量)×100%
优珠率= (优质珍珠数量/收获珍珠数量)×100%
正圆珠比例= (成活植核贝中收获正圆形珍珠数量/成活植核贝中收获珍珠数量)×100%
统计结果用单因素方差(ANOVA)进行差异性分析, 显著性水平设为P<0.05。
2 结果
2.1 大珠母贝的核位
大珠母贝核位外观及核位解剖图分别见图2和图3。
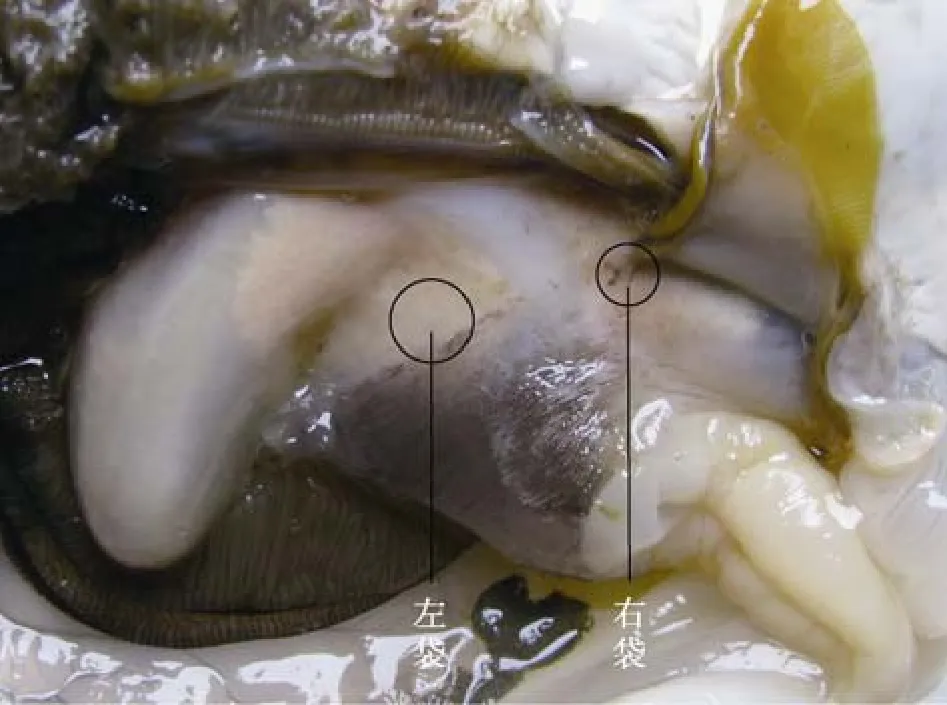
图2 核位外观Fig. 2 The appearance of the sites of nucleus-insertion

图3 核位解剖图Fig. 3 The anatomical picture of the sites of nucleus-insertion
由图2和图3可以看出: 和马氏珠母贝相似, 大珠母贝也有 2个核位, 分别位于收足肌两侧的生殖腺中, 分别称为“左袋”和“右袋”。“左袋”位于收足肌左侧腹嵴内, 核位的后方仅有消化道, 没有其他重要的组织器官;“右袋”位于收足肌与消化盲囊之间。
在植核过程中发现: 在右袋植入珠核的手术难度很大, 实际可利用的只有“左袋”一个核位。
2.2 不同术前处理方法的育珠效果
不同术前处理方法的育珠效果见表1。从表1可见, 各实验组的休养期成活率差异不显著(P>0.05);各实验组的留核率差异显著(P<0.05), 其中D组最低,C组最高; 在4个实验组中A组与C组、B组与D组成珠率差异不显著(P>0.05), 但A组、C组与B组、D组之间成珠率差异显著(P<0.05)。通过比较可知:采用传统术前处理和低温处理相结合的术前处理组C组的植核贝育珠效果最好, 休养期成活率、留核率和成珠率分别达到79.9%、78.2%和80.1%。
2.3 低温冷冻处理小片贝制备外套膜小片的育珠效果
低温冷冻处理小片贝制备外套膜小片的育珠效果见表2。从表2可以看出, 各实验组与对照组的成珠率、优珠率、正圆珠比例差异显著(P<0.05) ; 在实验温度范围内, 成珠率、优珠率、正圆珠比例随温度的降低而增高, 与 8°C、6°C、4°C 低温对应的 A、B、C组育珠效果最好, 成珠率、优珠率和正圆珠比例分别达到98%、53%和30%左右。
2.4 术后休养期的观察
通过观察: 大珠母贝植核后脱核高峰出现在第5~15天, 休养15~20 d 时伤口已经愈合(愈合的伤口处色素加深, 图4), 不再发生吐核现象。
育珠贝的死亡高峰出现在术后的第 20~30 天。植核后10 d左右内脏囊大小恢复正常的植核贝则可成活, 如植核后10 d左右发现植核贝内脏囊严重收缩, 消化盲囊内无食物, 肠道内无粪便, 一般 20~30 d会死亡。
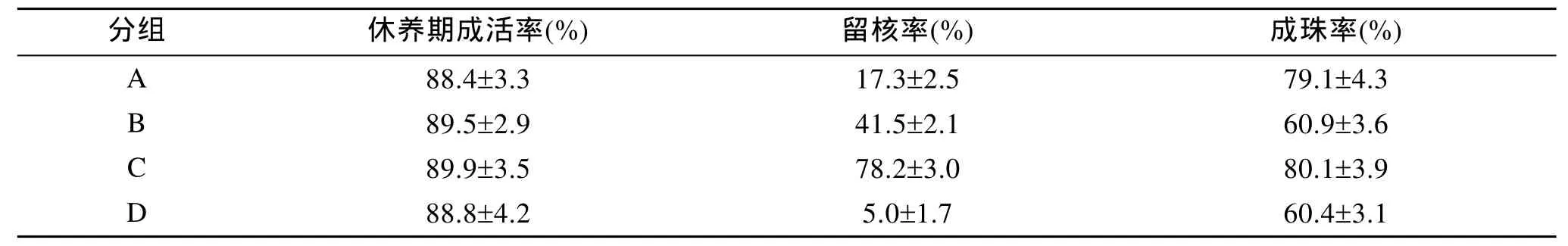
表1 不同术前处理方法大珠母贝育珠效果比较Tab. 1 The pearl-culturing comparison between different pre-operation treatment methods

表2 不同温度处理小片贝制备外套膜小片的育珠效果Tab. 2 The pearl-culturing results of the saibo tissues treated at different temperatures
珍珠层形成时间: 伤口愈合时, 小片还没有在珠核表面形成珍珠囊和分泌珍珠质(图 5); 通过解剖观察, 在水温25~30°C条件下, 珠核表面形成珍珠层的时间为45 d左右。
3 讨论
3.1 大珠母贝与马氏珠母贝植核技术比较
大珠母贝与马氏珠母贝植核技术有以下几点不同之处: (1)虽然大珠母贝的核位与马氏珠母贝相似,均有左袋和右袋两个核位, 两者核位及周围组织结构也非常相似。但大珠母贝左袋的腹嵴与整个软体部的比例较马氏珠母贝小, 而且较窄, 没有马氏珠母贝鼓胀; 最重要的不同是大珠母贝在手术的强烈刺激下整个软体部严重收缩, 核位也相应变小, 甚至小于马氏珠母贝的核位。(2)在实际植核操作中,马氏珠母贝的左袋和右袋两个核位都可利用, 可植入两个珠核; 而大珠母贝个体大、软体部在贝壳内所处的位置较深, 右袋的位置较难观察, 珠核也很难植入该位置, 因此, 大珠母贝实际可利用的只有“左袋”一个核位。(3)在植核手术方面, 马氏珠母贝个体小、软体部与贝壳边缘距离很近, 所用植核工具较短, 手术的开口、送核、送片等植核关键动作准确;而大珠母贝个体大、软体部在贝壳内所处的位置较深, 视野不好, 而且植核工具较马氏珠母贝植核工具长得多, 工具的可操控性和动作的准确性均大大降低, 极大地增大了植核手术的难度。(4)马氏珠母贝表皮较薄, 用开口针可以快速的在足基部划开一个开口, 而大珠母贝表皮较厚, 需要用专用的锋利刀具才能在足基部划开一个开口。(5)马氏珠母贝植核常采用先核后片法, 而大珠母贝外套膜小片较厚, 采用先片后核法更有利于小片与珠核表面紧密贴合。
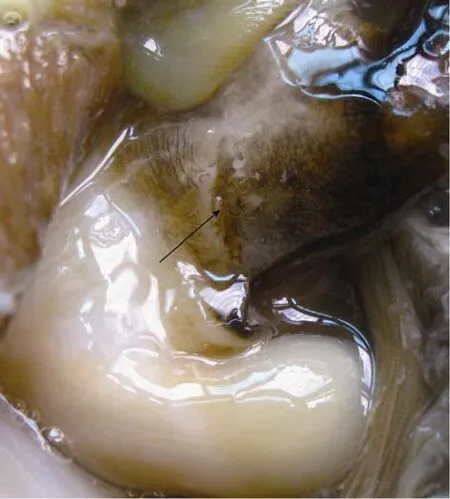
图4 愈合的伤口Fig. 4 The cicatrization of the healed wound
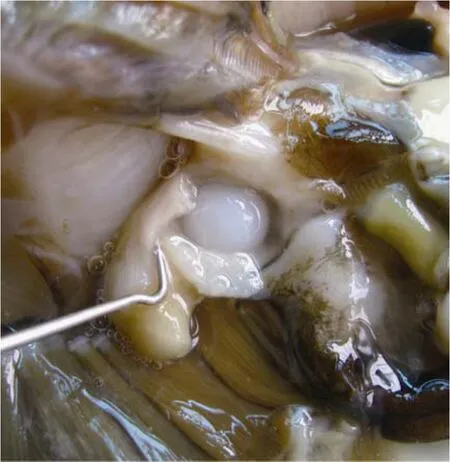
图5 伤口愈合时珠核(表面无珍珠质分泌)Fig. 5 The nucleus during the wound healing
3.2 植核贝术前处理方法的选择与植核效果
众所周知, 术前处理是提高植核贝留核率的有效手段, 其原理是通过抑制植核贝的生理活力、降低植核贝的生理机能, 使贝体的性腺发育程度及生理状态均处于适合于植核手术的状态, 防止手术时因强烈刺激而产生剧烈收缩, 造成核位变形、对植入珠核的挤压、排异作用增强, 导致施术贝大量吐核。现在常规使用的术前处理方法为控制溶氧和饵料法,通过提高养殖密度、贝笼外包裹筛绢网布等技术措施控制笼内水流来限制处理贝获得的溶氧和饵料量,降低贝体的生理活力、抑制其性腺发育程度、减少贝体对手术刺激的应激反应能力; 使用这种处理方法对提高马氏珠母贝、珠母贝和企鹅珍珠贝休养期成活率、留核率有显著效果[9-15]。
影响贝体生理活力的因素很多, 除溶氧、饵料外,水温和化学药物同样可以调节贝体的生理活力, 国外一些学者进行了使用麻醉剂快速抑制贝类生理活力的研究[16-25], 其中 Norton[18]采用麻醉剂(propylene phenoxetol)处理植核贝进行珠母贝育珠实验, 结果表明使用麻醉剂可有效提高珠母贝留核率(留核率从84%提高到94%), 但存在植核贝死亡率增大的问题(死亡率从2%上升到24%)。
大珠母贝个体大, 生理活力非常强, 只用传统术前处理方法效果并不理想[3], 本实验中采用传统术前处理方法进行大珠母贝植核育珠, 植核贝留核率也很低。大珠母贝是变温水生动物, 其生理活力受温度的影响很大, 温度越低其生理活力越弱, 对手术刺激的反应越弱, 当水温低至一定温度时, 贝体处于低温“麻痹”状态, 对手术外界刺激反应能力大大降低。因此, 降低贝体温度可以快速、有效地直接降低植核大珠母贝的生理活力, 减小贝体对植核手术应激反应, 从而降低植核贝对珠核的挤压、排异作用, 提高植核贝留核率。实验结果表明采用低温处理手术贝的方法进行植核育珠可以有效提高留核率(留核率从不足10%提高到80%左右)。
实验中发现, 直接低温处理的 B组和对照组 D组的植核贝成珠率较低, 而经过传统术前处理的 A组和传统术前处理+低温处理的 C组的育珠贝成珠率较高。通过分析, 产生这种现象的原因是未经过传统术前处理的育珠贝性腺发育较饱满, 小片植入的小片与珠核贴合不紧密的机会增加, 而且小片很容易随生殖细胞从开口处流出。因此, 将传统术前处理与低温处理相结合取得了最佳的植核效果。
3.3 小片制备方法与植核效果
小片与珠核是否紧密贴合直接关系到形成珍珠的质量, 如果小片与珠核之间有间隙、贴合不紧密时,常形成有污点或有尾巴的珍珠或素珠[8]。与马氏珠母贝不同, 大珠母贝外套膜较厚、肌肉组织和黏液细胞发达, 在制备小片时外套膜受擦拭、切割等刺激发生严重的收缩, 使外套膜变厚、变硬, 并产生大量黏液;按照常规的马氏珠母贝切片方法切出的小片厚、硬,并严重皱褶, 植入植核贝体内时很难与珠核紧密贴合。虽然谢玉坎等[6]参照马氏珠母贝外套膜小片的制备方法, 采用 1~2龄小片贝成功培育出中国第一批大珠母贝游离珍珠, 但作者在实际工作中发现, 使用马氏珠母贝的制备小片方法, 即使使用低龄小片贝, 也很难切出薄、软、无皱褶的高质量的小片。本实验中, 低温处理组制备的小片质量均比对照组好(体现在小片的厚度、硬度、和皱褶方面), 且随处理温度的降低小片质量也逐渐提高, 这与处理小片贝温度越低培育的珍珠质量越好的趋势一致。分析其原因可能是: (1)在4~8℃低温条件下, 外套膜已经处于充分“麻痹”状态, 切出的小片薄、软、无皱褶, 可以与珠核紧密贴合, 故形成的珍珠质量最好; 而10℃以上的低温不能使外套膜充分“麻痹”, 受手术刺激还会收缩, 切出的小片还较厚、皱褶较多, 与珠核贴合不够紧密, 故形成的珍珠质量较好; 常温下制备的小片厚、硬, 并严重皱褶, 质量最差, 与珠核贴合不紧密, 形成的珍珠质量最差。(2)虽小片贝在低温海水中处于低温“麻痹”状态, 外套膜失去对手术刺激的反应和收缩能力及分泌黏液的能力, 但此时具有分泌珍珠质功能的外套膜外表皮细胞还保持着生理活性。这样切取小片具有如下优点: (1)低温处理后外套膜组织失去收缩能力, 在切片时不会收缩变短, 所以, 同样一个小片贝可以切出更多的小片,供给更多的植核贝使用, 减少了插核时小片贝的使用量, 节约了资源。(2)低温处理后外套膜组织的黏液细胞不排出黏液, 制备小片过程中不需要擦拭去除黏液, 减少因擦拭黏液操作对具有珍珠质分泌功能的外套膜表皮细胞的损伤。(3)在低温条件下可以更有效地延长外套膜小片组织细胞保持生理活性的时间。但应该注意在制备小片的过程中应尽量维持外套膜一直处于低温状态; 否则, 随温度的升高, 外套膜的收缩能力逐渐恢复, 影响制备的小片质量。
4 小结
通过本研究, 从技术层面已经突破大珠母贝游离珍珠培育技术。采用采用传统术前处理和低温处理相结合的综合术前处理方法可有效提高留核率达80%左右, 采用低温冷冻处理法制备大珠母贝外套膜小片可有效提高成珠率和优珠率分别达到 98%和53%左右, 再通过中试后技术指标可达到可满足大珠母贝游离珍珠产业化要求的水平。
[1] Graham Brown. 澳大利亚的珍珠产业[J]. 宝石和宝石学杂志, 2000, 12(4): 1-6.
[2] 谢玉坎, 许志坚, 林碧萍. 大珠母贝游离有核养殖珍珠实验研究初步报告[J]. 南海海洋科学集刊, 1981, 2:153-156.
[3] 谢玉坎, 林碧萍. 大珠母贝的插核期的实验观察[J].水产学报, 1983, 9(3): 229-234.
[4] 蒙钊美, 黎学章. 大珠母贝外套膜细胞小片的移植和珍珠囊形成的研究[J]. 贝类学论文集(第一辑), 1983,97-101.
[5] 谢玉坎, 林碧萍, 冯永勤. 大珠母贝育珠期的成活率[J].热带海洋研究(二), 1986, 4: 121-126.
[6] 谢玉坎, 林碧萍, 张偲, 等. 大珠母贝及其养殖珍珠[M].北京, 海洋出版社, 1990: 121-124.
[7] 罗振鸿, 曹家录, 齐常元, 等. 大珠母贝术后处理研究[J]. 湛江海洋大学学报, 1997, 8(1): 1-4.
[8] 大连水产学院. 贝类养殖学[M]. 北京: 农业出版社,1980: 224-244.
[9] 邓陈茂, 林养, 杜涛, 等. 马氏珠母贝的术前处理实验[J]. 湛江水产学院学报, 1995, 15(1): 6-9.
[10] 林英. 再谈人工植核与珍珠质量-植核母贝的手术前处理[J]. 现代渔业信息, 1995, 10(1): 22-24.
[11] 劳赞, 邓陈茂, 梁盛, 等. 马氏珠母贝术前处理的研究[J].水产科学, 2003, 22(4): 27-29.
[12] 邓陈茂, 梁飞龙, 符韶, 等. 马氏珠母贝术前处理与育珠研究[J]. 海洋湖沼通报, 2010, 32(4): 124-128.
[13] 毛勇, 梁飞龙, 余祥勇, 叶富良. 企鹅珍珠贝游离珠插核效果的初步观察[J]. 海洋科学, 2003, 27(11): 1-4.
[14] 梁飞龙, 邓陈茂, 符韶, 刘永. 企鹅珍珠贝游离珠培育技术的初步研究[J]. 海洋通报, 2008, 27(2): 91-96.
[15] 符韶, 邓陈茂, 黄海立, 等. 珠母贝人工培育黑珍珠的影响因素分析[J]. 中国水产科学, 2010(17): 1340-1345.
[16] Norton J H, Dashorst M, Lansky T M, et al. An evaluation of some relaxants for use with pearl oysters[J].Aquaculture, 1996, 144: 39-52.
[17] Mills D, Thili A, Norton J. Large scale anaesthesia of the silver-lip pearl oyster, Pinctada maxima [J]. Shellfish Research, 1997(16): 573-574.
[18] Norton J H, Lucas J S, Turner I. Approaches to improve cultured pearl formation in Pinctada margaritifera through use of relaxation, antiseptic application and incision closure during bead insertion [J]. Aquaculture,2000, 184: 1-17.
[19] O’Connor W A, Lawler N F. Propylene phenoxetol as a relaxant for the pearl oysters Pinctada imbricata and Pinctada albina[J]. Asian Fisheries Science, 2002,15: 51-57.
[20] Acosta-Salmón H, Martıínez-Fernández E, Southgate P C. A new approach to pearl oyster broodstock selection:Can saibo donors be used as future broodstock? Aquaculture, 2004, 231: 205-214.
[21] Acosta-Salmón H, Martínez-Fernández E, Southgate P C. Use of relaxants to obtain saibo tissue from the blacklip pearl oyster (Pinctada margaritifera) and the Akoya pearl oyster (Pinctada fucata) [J]. Aquaculture,2005, 246: 167-172.
[22] Acosta-Salmón H, Southgate P C. Mantle regeneration in the pearl oysters Pinctada fucata and Pinctada margaritifera[J]. Aquaculture, 2005, 246: 447- 453.
[23] Acosta-Salmón H, Davis M. Inducing relaxation in the queen conch Strombus gigas (L.) for cultured pearl production [J]. Aquaculture, 2007,262: 73-77.
[24] Gustaf N, Mamangkey F, Acosta-Salmón H, et al. Use of anaesthetics with the silver-lip pearl oyster, Pinctada maxima (Jameson) [J]. Aquaculture, 2009, 288: 280-284.
[25] Gustaf N, Mamangkey F, Southgate P C. Regeneration of excised mantle tissue by the silver-lip pearl oyster,Pinctada maxima (Jameson)[J]. Fish & Shellfish Immunology, 2009, 27: 164-174.
Received: Oct.,22,2011
Key words:Pinctada maxima (Jameson); Nucleus-inserting site; Preoperative treatment; Saibo preparation
Abstract:The experiment of culturing round pearls with Pinctada maxima (Jameson) was carried out in Weizhou Island of Guangxi province during 2008~2010. Such new techniques as determination of nucleus-inserting site by anatomy, preoperative treatment and saibo low-temperature handling were adopted in the experiment in order to increase the rates of nuclear retention, pearl formation and quality pearls. Results showed that there are two nucleus-inserting sites on the left and right of the pedal contractor muscle of the visceral sac in P. maxima which are suitable for culturing round pearls and called left and right pocket. In actual performance, only the left pocket can be used for culturing of round pearls. The difference of survival rate between varying preoperative treatment groups over the recovery period was not significant (P>0.05), while the difference of nucleus retention rate and pearl formation rate were significant (P<0.05). The average nucleus retention rate and pearl formation rate were increased to 78.2% and 80.1% respectively using a combination method of both traditional preoperative and low-temperature saibo treatment. There’s significant difference between traditional and low-temperature saibo treatment methods in pearl culturing including pearl formation rate, quality pearl rate and round pearl rate (P<0.05). The pearl formation rate, quality pearl rate and round pearl rate were increased with decreased experimental temperature. The best pearl culturing temperature ranged from 4 to 8℃ with pearl formation rate, quality pearl rate and round pearl rate of 98%,53% and 30%, respectively. The nucleus rejection peak occurred at 5~15 d after nucleus insertion, and the wound healing period was 15~20 d. The peak mortality of inserted individuals occurred at 20~30 d after operation. At temperatures 25~30℃, the nacreous layer began to form at the surface of the nucleus around 45 d after operation.
(本文编辑:梁德海)
Culturing round pearl with Pinctada maxima (Jameson)
LIU Yong1, ZHANG Chun-fang1, JIAO Zong-yao2, DENG Chen-mao1
(1. Pearl Research Institute of Guangdong Ocean University, Zhanjiang 524025, China; 2. Marine Engineering Vocational and Technology School of Guangdong Province, Guangzhou 510320, China)
S968.31
A
1000-3096(2012)04-0030-07
2011-10-22;
2012-01-17
广东省科技厅农业攻关项目(2007A020200006-4,2009B020308008)
刘永(1968-), 男, 河北沧州人, 高级工程师, 研究方向为海水珍珠及海水经济贝类增养殖, E-mail: liuy89@gdou.edu.cn

