蒲公英内生真菌PG2分子鉴定及抑菌物质的研究
张慧茹 伊艳杰 赵红月 袁 元 李伟南
(河南工业大学生物工程学院,河南郑州 450001)
天然产品是从微生物、植物或动物自然衍生出的代谢物和/或副产物,这些产品已为人类使用数千年,而植物化合物上百年来一直是医药的主要来源。随着植物资源的利用和开发,大量珍稀植物遭到严重的破坏,而其产生的药物来源也受到影响。美国蒙大拿州立大学Strobel小组于1993年在Science上发表文章:从短叶红豆杉中分离得到一株能合成抗癌药物紫杉醇的内生真菌,证明内生真菌具有合成与宿主植物相同或相似生物活性物质的功能[1]。这一发现推动从药用植物中分离内生菌,利用植物内生菌发酵产物生产重要的天然药物的热潮,因此,利用药用植物内生菌产生新型抗性药物,为药用植物生长缓慢、资源紧缺而又超量耗费所引起的药源植物匮乏和生态环境破坏的问题提供了解决新思路,也为我们利用中草药内生菌替代中草药作为抗病营养性饲料添加剂提供了科学的依据。
蒲公英为菊科一年生草本植物。味苦、甘,性寒,具清热解毒、消肿散结、利尿通淋等多种功效。其主要化学成分包括绿原酸、黄酮类、萜类、植物甾醇类等,其中绿原酸为蒲公英的主要抗菌物质[2]。鲜有应用内生菌代谢产物作为治疗畜禽疫病的药物研究的报道。前期研究发现蒲公英内生真菌PG2具有抗禽类病原菌的特性[3],本研究在前期研究的基础上,拟采用分子生物学方法对蒲公英内生真菌PG2进行种属地位的鉴定,并对其产生的抗菌活性物质进行初步研究,为扩宽药物植物内生菌的应用范围,研究蒲公英内生真菌的抗菌机理,开发新型高效的抗禽类疾病的新药奠定理论基础。
1 材料和方法
1.1 菌株
蒲公英内生真菌PG2:河南工业大学生物工程学院动物生理实验室分离,4℃,PDA固体培养基斜面保存。
指示菌:本试验采用禽类常见致病菌为指示菌,共用5株菌。鸡大肠杆菌(Escherichia coli.):本实验室分离、鉴定并保藏;其余4株致病菌均购买于中国兽医药品监察所,鸡大肠杆菌(Escherichia coli.,O78),菌株编号:CVCC1490;鸡白痢沙门氏菌(Salmonella pullorum),菌株编号:CVCC533;鸡多杀性巴氏杆菌(Pasteurella multocida),菌株编号:CVCC474;鸡金黄色葡萄球菌(Staphyloccocus aureus),菌株编号:CVCC2241。
1.2 主要培养基
内生真菌采用PDA固体培养基培养;致病性指示菌采用营养琼脂培养;内生真菌发酵采用马铃薯浸汁添加5%的蒲公英浸汁的液体培养基,参考戴传超[4]的方法制作蒲公英浸汁。
1.3 PCR引物
真菌rDNA ITS序列通用引物ITS4、ITS5。由上海生物工程技术服务有限公司合成。

1.4 试验方法
1.4.1 PG2的分子鉴定
形态学鉴定:见李伟南等前期报道[3]。分子生物学鉴定:采用改进的SDS-CTAB法[5]提取内生真菌基因组DNA并作为模板,利用ITS通用引物扩增内生真菌PG2的基因组DNA,PCR反应体系为:10×Buffer 2.5 μl,2.5 mmol/l dNTP 2 μl,引物 ITS4、ITS5(5 mmol/l)各1 μl,Taq 酶(5 U/μl)0.2 μl,模板 2 μl(40 ng),加 ddH2O补足至 25 μl。扩增条件为:95 ℃、5 min,94 ℃、30 s,55 ℃、1 min,72 ℃、1 min,35 个循环,72 ℃、10 min,然后4℃保温。1%琼脂糖凝胶电泳检测目的片段并切胶回收,纯化目的片段。目的片段与pMD-18T克隆载体连接转化到基因工程菌JM109中,蓝白斑筛选阳性转化子,筛选的阳性转化子送大连宝生物工程公司测序。利用BLAST软件对PG2的ITS序列与GenBank已登录的相似序列进行比对,采用Clustalx1.83软件进行序列分析并构建系统发育树,以确定其种属地位。
1.4.2 PG2的抑菌活性
将蒲公英内生真菌接种于含5%(V/V)蒲公英浸汁(浓度0.1 g/ml)的马铃薯浸汁液体培养基中[3],28℃、160 r/min培养7 d,制备发酵液。取发酵上清液,以兽药监察所购买的4种禽类强致病菌为指示菌,采用打孔法进行抑菌试验,每孔加入约15 μl上清液,以硫酸链霉素为阳性对照。试验重复3次,抑菌直径结果取平均值。
1.4.3 抑菌活性物质的类别鉴定
利用各类有效活性成分的颜色反应,对发酵液中的抑菌活性物质的成分初步鉴定。利用碘与生物碱反应生成无定形红棕色沉淀以检验生物碱的存在;以黄酮类化合物与三氯化铝发生显色反应来检识黄酮类物质的存在;通过糖类的斐林试剂法来进行糖类物质的检识;以氨基酸的双缩脲反应进行蛋白质、氨基酸类、肽类物质的检识;以酸类物质的颜色反应(溴酚蓝遇酸呈黄色)进行检识;以酚类与三氯化铁呈紫色判断酚类物质的存在。
1.4.4 抑菌活性物质的热稳定性
将发酵液置于 25、60、80、90、121 ℃ 5 个不同温度下处理30 min,以本实验室分离的鸡大肠杆菌为指示菌,采用平板打孔法测抑菌圈直径,以室温25℃为对照。试验重复3次,结果取平均值。
1.4.5 活性物质的极性分析
采用极性由小到大的3种试剂:石油醚、正丁醇、乙酸乙酯,对发酵液进行连续萃取,每种萃取液萃取3次,分别收集各萃取相、萃余相,采用旋转蒸发仪40℃减压浓缩除去萃取有机溶剂,以大肠杆菌(O78)为指示菌进行抑菌试验判断活性物质的极性大小,同时对3种溶剂的抑菌性进行检验作为对照。试验重复3次,结果取平均值。
1.4.6 活性物质的初步分离
以300~400目的硅胶装柱(30 mm×500 mm),取PG2发酵液有效成分所在萃取溶剂,40℃减压浓缩,取50 ml浓缩液上样。以环己烷:正丁醇为9:1,8:2,7:3,6: 4,5: 5,4: 6,3: 7,2: 8,1: 9 的溶液为洗脱剂,每次加入50 ml洗脱液,调整流速为3~4 ml/min,按每瓶10 ml进行收集,以鸡大肠杆菌(O78)为指示菌,通过抑菌试验检测洗脱液中活性物质的抑菌效果。
1.4.7 有效活性物质的红外光谱(IR)结构分析
采用溴化钾片压片法,将分离得到的抑菌活性物质洗脱液,滴一滴放在抛光盐片上,将另一抛光盐片覆盖,轻轻压紧并轻微转动,形成无气泡的液膜,进行红外光谱结构分析。
2 结果与分析
2.1 内生真菌的分子生物学鉴定
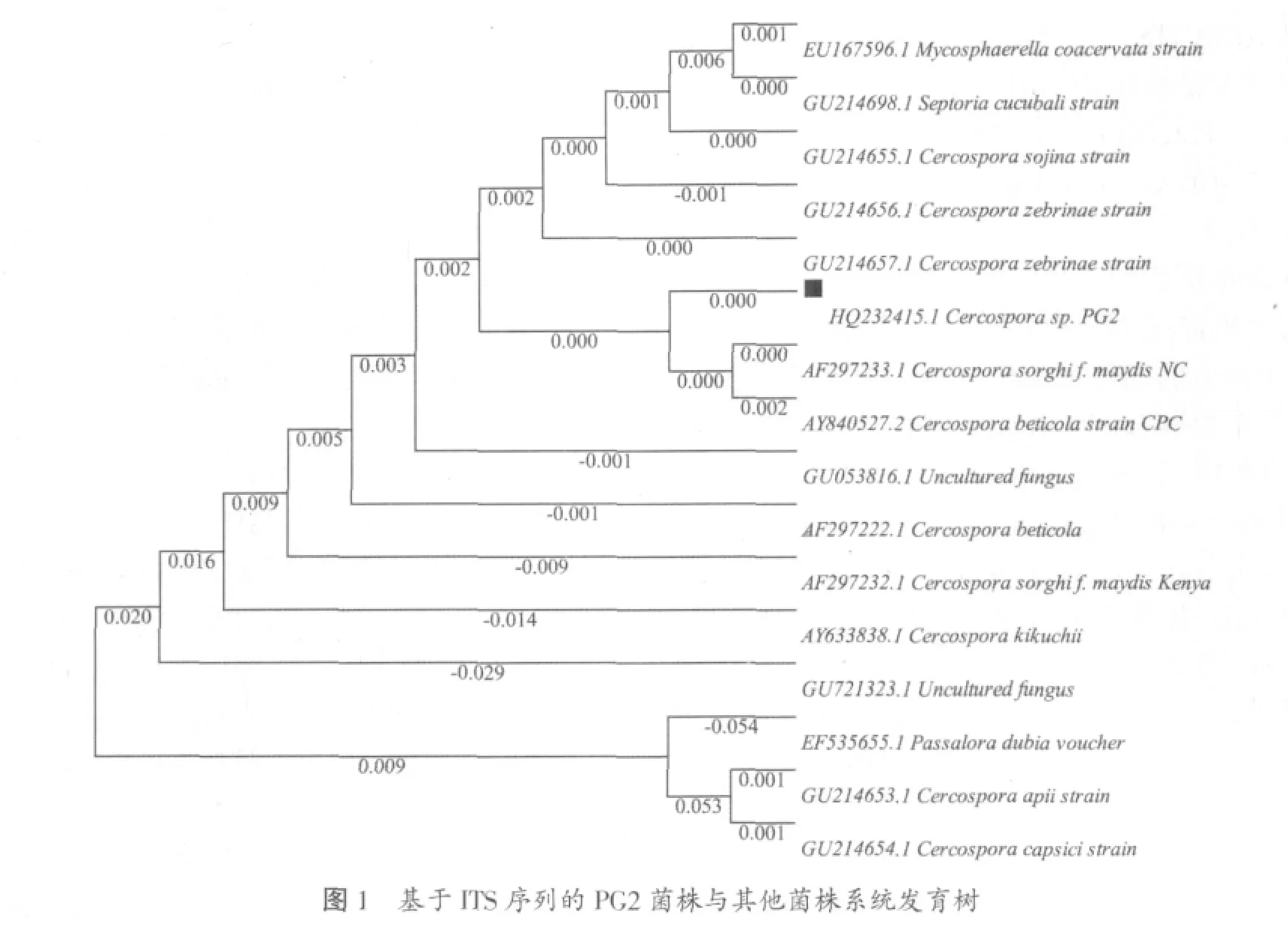
利用真菌通用引物ITS4、ITS5扩增菌株PG2的ITS-5.8 S rDNA片段。目的片段测序结果表明:该目的片段的基因大小为560 bp,将所得序列提交Gen-Bank,获得登录号:HQ232415。
使用BLAST程序对所得序列在Genebank中进行同源性比较。综合同源性比对结果,从GenBank中选择基因序列同源性在99%的真菌序列片段。应用Clustalx1.83软件进行比较后构建系统发育树,如图1所示。由图1可以看出,PG2与半知菌门、丛梗孢科、尾孢霉属在同一分支上,因此将PG2确定为半知菌门、丛梗孢科、尾孢霉属(Cercospora sp.)。
2.2 PG2的抑菌活性
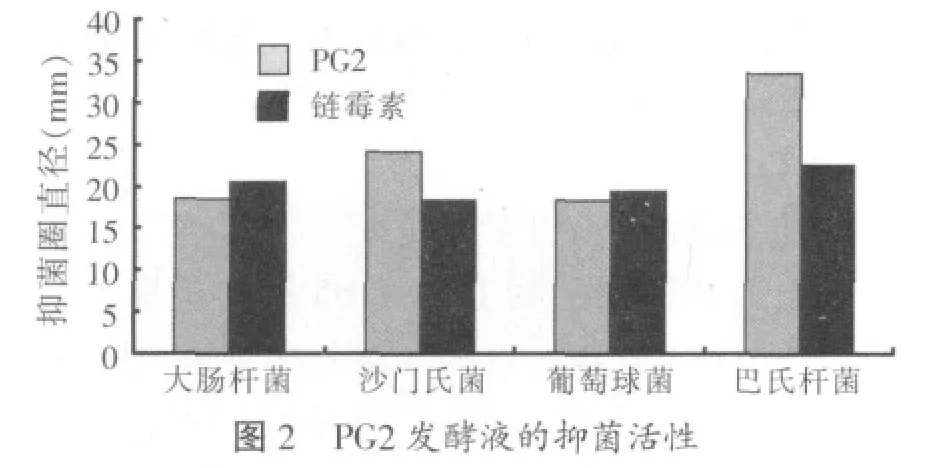
以中国兽医药品监察所购买的4种禽类强致病性致病菌为指示菌,用PG2发酵上清液做抑菌试验,PG2的抑菌活性见图2。
PG2发酵液对4种禽类高致病菌均具有高的抑菌活性。其中,对沙门氏菌和巴氏杆菌的抑菌效果高于链霉素阳性对照,证实PG2为广谱、高效抑菌的内生真菌。

2.3 抑菌活性物质的类别鉴定
利用各种有效活性物质的颜色反应,对PG2发酵液中抑菌成分可能的化学物质类别进行初步鉴定。经化学成分鉴定,生物碱、黄酮类、蛋白质、有机酸类、酚类等均为阴性,糖类反应为阳性。
2.4 PG2抑菌活性物质的热稳定性
对PG2发酵液采取不同温度处理30 min后,以本实验室分离的大肠杆菌为指示菌,其抑菌活性见图3。
从图3可以看出,随着温度的升高,抑菌效果略有下降。因此可以证实,PG2发酵液中的抑菌物质具有热稳定性。
2.5 抑菌活性物质极性的分析
对PG2发酵液采用极性逐级增强的溶剂连续萃取,以大肠杆菌(O78)为指示菌,对各萃取相和萃余相进行抑菌试验,以示踪活性物质的分布(见表1)。
由以上结果分析可见,PG2发酵液对鸡大肠杆菌(O78)具有较强的抑菌活性,抑菌圈直径为18.5 mm。随着发酵液的连续萃取,活性物质不断被富集、抑菌性能不断增强,在各级萃取液中抑菌圈直径均强于原液。活性物质主要分布在正丁醇的萃取相和乙酸乙酯的萃取相,以正丁醇萃取相的抑菌性最强,达到了25.3 mm,强于发酵液1.37倍。3种萃取溶剂无抑菌性。
2.6 抑菌活性物质的初步分离和结构测定
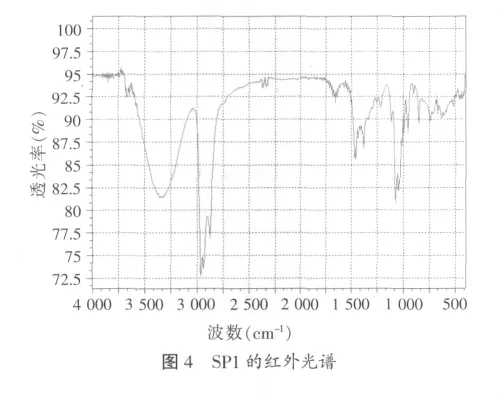
对具有高抑菌活性的正丁醇萃取相进行浓缩、上样、洗脱。经抑菌示踪试验发现,PG2正丁醇萃取相的环己烷:正丁醇(V/V)=9:1的洗脱液具有强的抑菌活性,命名为SP1。对SP1进行红外光谱结构分析发现:SP1在 3 415.9、2 931.8、2 875.8、2 829.5、1 624.0、1 490.9、1 271.0、1 064.7、1 002.9、975.9 等处出现波峰(见图 4)。初步分析SP1含有多糖羰基、羟基等官能团。

表1 PG2发酵液连续萃取后活性物质的分布
3 讨论
目前,国内对于药用植物内生菌的研究正在逐步增加,研究的方法和思路也在不断改进,但限于药用植物内生菌是一类新发现的微生物资源,对其分类方法的研究相对来说还是比较薄弱,大多数采用形态学与分子学鉴定相结合的方法,但当形态学分类和分子生物学分类存在差异时,还需要采用更多的微生物学分类方法才能准确确定其分类地位。
蒲公英是一类常用的清热解毒类中药,广泛地用于人类及动物疾病的治疗。鉴于蒲公英的药用范围非常广泛,人们希望得到蒲公英更多的药用活性成分,以提高治疗效果。齐仁立等[6]、李喜凤等[7]优化蒲公英有效活性物质的提取工艺,获得较好的抗病特性;牛瑞萍[8]用黑曲霉、米根霉和枯草芽抱杆菌等微生物对蒲公英粗提物进行发酵,以提高发酵液中抗菌物质绿原酸的产量。李伟南等[3]首次分离蒲公英内生真菌的方法,获得了高抑菌活性物质,其抗菌能力强于植物提取液,对多种致病菌均具有抵抗能力,具有广谱抗菌性,而且对某些致病菌(沙门氏菌和巴氏杆菌)的抑菌效果强于抗生素(链霉素)。内生菌作为新型抗生素来源的微生物,其产生抗菌活性物质的能力还可以通过优化发酵条件和基因工程改造的方式进行人为调控,从而缩短生产抗生素的时间、提高抗菌特性,因而,从植物内生菌中生产抗生素的研究大有希望。植物内生真菌长期生活在宿主体内,其生理代谢活动与宿主体内环境密切相关[9],一旦离开宿主植物,植物内生真菌的一些特征可能也会随之退化、消失。在本研究中,随着体外培养代数和发酵次数的增加,也出现菌株抗菌特性退化的问题,抑菌效果略有减弱,而新分离的内生菌株抑菌效果往往高于传代、长期保藏过的菌株。因此,本试验中,在培养液中加入少量的蒲公英浸提液以模拟体内环境增加抑菌效果,试验结果证明该方法对于保持菌株的天然特性具有重要的作用。
内生真菌产生的抗菌活性物质是多种多样、丰富多彩的[10],这些抗菌物质的种类和作用可能不同于植物提取液,推测各种抗菌物质之间也可能存在多种相互作用、共同发挥抗菌效果。本试验就发现在乙酸乙酯和正丁醇萃取液中均具有抗菌活性物质,甚至比正丁醇极性还大的萃余相中还有抑菌性,说明PG2发酵液能产生多种抑菌物质,本文仅对PG2正丁醇萃取相部分洗脱中高抑菌成分SP1进行结构分析,而PG2所产生的其他抑菌物质的确切结构及其抗菌特性,还需要进一步深入的研究和探索。
[1]Sticrle A,Strobel G,Sticrle D.Taxol and taxanc production by Taxomyces and reanae,an endophytic fungus of Pacific yew[J].Science,1993,260(5105):214-216.
[2]黄昌杰,林晓丹,李娟,等.蒲公英化学成分研究进展[J].中国现代中药,2006,8(5):32-35.
[3]李伟南,张慧茹.3株蒲公英内生真菌的分离鉴定及抗禽类致病菌活性的初步研究[J].安徽农业科学,2008,36(22):9540-9542.
[4]戴传超,余伯阳,徐曾莱,等.环境因子对乌桕内生真菌生长及脂肪酸的影响[J].应用生态学报,2003,14(9):1526-1528.
[5]黄绍辉,方炎明.改进的SDS-CTAB法提取濒危植物连香树总DNA[J].武汉植物学研究,2007,25(1):98-101.
[6]齐仁立,张慧茹,崔斓斓,等.蒲公英抑菌成分提取工艺的优化[J].安徽农业科学,2007,35(17):5038-5039.
[7]李喜凤,郝哲,邱天宝,等.蒲公英中有机酸类成分的提取工艺研究[J].中成药,2011,33(2):262-265.
[8]牛瑞萍.蒲公英发酵微生物的筛选及其对肉鸡免疫指标和生长影响的研究[D].北京:中国农业科学院,2009.
[9]袁志林,章初龙,林福呈.植物与内生真菌互作的生理与分子机制研究进展[J].生态学报,2008,28(9):4430-4439.
[10]Yu Hongsheng,Zhang Lei,Li Lin,et al.Recent developments and future prospects of antimicrobial metabolites produced by endophytes[J].Microbiological Research,2010,165:437-449.

