脾窦岸细胞血管瘤3例临床病理分析
舒美玲 夏孙文
脾脏(littoral cell angioma, LCA)由1991年Falk等[1]首先提出的一种仅发生于脾脏,起源于脾脏特有的窦岸细胞的肿瘤。一般认为是良性,也有恶性报道,即窦岸细胞血管肉瘤[2],该病十分罕见,文献报道少。现收集我院及外院进修学习的3例病例,探讨临床表现、病理学特征、诊断与鉴别诊断,提高对该肿瘤的认识。
1 材料与方法
1.1 材料 3例脾脏LCA,女2例,男1例,年龄36~47岁,平均45岁,临床2例为左上腹隐痛不适,1例伴贫血及血小板减少性紫癜,1例无症状体检时发现。查体:脾脏肿大边缘规则,表面光滑,质韧,腹部未及包块,叩诊无浊音,肝脏未见异常。B超见脾多发性高回声,CT发现多个低密度病灶。化验室:CA199、CA125、AFP、CEA等均正常,尿、粪常规及肝肾功能正常,血沉加快。血常规检查,一例伴发贫血及血小板减少性紫癜。
1.2 方法 3例脾脾脏切除标本,常规切片,HE染色,光镜观察。PAS及免疫组化染色标记:CD34、CD31、F8、Lysozyme、EMA、CK、CD8、 Ki-67所有抗体及试剂盒均由福州迈新公司提供。
2 结果
2.1 大体观察 脾脏体积增大,切面脾实质内见多个大小不等结节性病灶,直径0.1~1.8cm,色暗红、灰白,部分囊实性海绵状。
2.2 组织学观察 3例组织学形态基本相似,结节位于脾脏红髓内,界限清楚,病变由相互吻合的血管样窦性腔隙构成,部分窦隙囊样扩张,囊内见含纤维血管轴心的乳头状突起,腔隙及乳头状突起均衬以单层肿瘤细胞,瘤间脾脏组织正常。肿瘤细胞有两种形态,一种与周边正常脾窦内皮相似,主要衬覆于窦隙表面;另一种为柱状细胞呈鞋钉状,主要衬覆于宽大窦隙及囊腔表面,部分脱落游离,类似于组织细胞,胞浆泡沫状内可见含铁血黄素颗粒沉积。瘤细胞无异型,无分裂相,无坏死。
2.3 免疫组化 肿瘤细胞同时表达内皮细胞和组织细胞标记物。CD31、F8内皮细胞标记物强阳性,CD34内皮细胞弱阳性表达。CD68、Lys组织细胞标记物呈不同程度的颗粒状阳性,EMA、CK、CD8阴性,Ki-67增殖指数低<5%。PAS染色部分瘤细胞胞质呈红色。见图1~图4。
2.4 病理诊断 脾窦岸细胞血管瘤。
2.5 随访及预后 本组3例随访1~5a,无肿瘤复发、转移。术前左季肋部不适术后消失,血小板恢复正常,生活质量良好。
3 讨论
脾LCA发病罕见,发病范围广,多见30~50岁,无明显性别差异。发病原因不明,文献报道该肿瘤可能与肿瘤、慢性感染性疾病有关[3]。临床症状不典型,多数患者因脾脏肿大,脾功能亢进就诊,部分伴有乏力、发热等症状,也有因健康体检或其它疾病检查发现。B超、CT检查脾脏增大,可见多发或单发界清结节。临床表现及影像学检查并无特殊性,诊断主要靠病理检查,免疫组化对确诊本病具有一定特异性。

图1 大小不等裂隙,被覆立方,柱状肿瘤细胞

图2 裂隙被覆肿瘤细胞CD31阳性
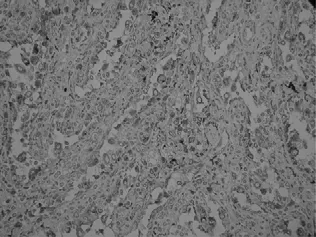
图3 裂隙肿瘤细胞CD68阳性
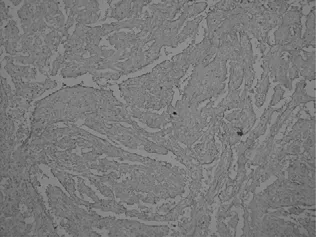
图4 裂隙肿瘤细胞F8阳性
3.1 病理特征 大体观察,脾脏增大,肿瘤呈孤立性多发性或单发结节散布于脾实质内,结节直径0.1~9.0cm,切面暗红或灰白色,囊实性,与周围组织界限较清楚。光镜下, 瘤结位于脾脏红髓内,界限清楚,肿瘤主要由相互吻合的血管性窦性腔隙构成,也可囊样扩张,乳头状突起,腔隙及乳头状突起衬以单层肿瘤细胞。肿瘤细胞有两种形态,一种与周边正常脾窦内皮相似,主要衬覆于窦隙表面,另一种为柱状细胞呈鞋钉状,主要衬覆于宽大窦隙及囊腔表面,部分脱落游离,类似于组织细胞,胞浆泡沫状可见含铁血黄素颗粒沉积。瘤细胞无异型,无分裂相。
3.2 超微结构 瘤细胞胞质内可见一种特征,即0.5~2um的嗜酸细胞小体的局部积聚,充满整个肿瘤细胞的胞质,小体内由大量溶酶体及其残体组成,可能来源于被吞噬的细胞。肿瘤细胞中无层粘连蛋白和饮液小泡,胞质内微管状小体极少见[3]。
3.3 免疫组化 正常的窦岸细胞其内皮细胞标记物阳性,组织细胞标记物呈阴性,但当窦岸细胞在炎症等刺激下表现出吞噬细胞的活性时,也可对组织细胞抗原标记物呈弱阳性表达。LCA肿瘤细胞内皮细胞标记物CD31、CD34、F8及组织细胞标记物CD68、Lysozyme均阳性表达,显示肿瘤的双重分化,目前被认为起源于脾红髓的窦岸细胞或衬细胞,属于网状内皮细胞系统。另外传统认为CD8是脾窦岸细胞的标志,但Arber认为由于一些病例窦岸细胞血管瘤CD8不表达,因此他们认为这种肿瘤来源另有可能[4],本组病例3例均不表达。PAS染色瘤细胞胞质见红色玻璃样小体,可能为吞噬降解的红细胞。
3.4 鉴别诊断 LCA须与以下病变鉴别:(1)血管瘤,脾血管瘤大多为海绵状血管瘤,由扩张的血管腔构成,与LCA的窦样腔隙呈囊性扩张的结构近似。但海绵状血管瘤内衬扁平细胞,通常没有乳头状增生,而LCA内衬的立方、柱状细胞具有内皮及组织细胞相似的形态和结构,免疫组化显示内皮CD31、CD34及组织细胞标记CD68、Lys阳性。(2)弥漫性窦性血管瘤病,也是起源于脾窦岸细胞,但病变呈弥漫性分布,免疫组化上不表达组织细胞标记,而LCA则呈结节状分布,免疫组化上表达内皮及组织细胞标记。(3)脾窦岸细胞血管肉瘤,瘤细胞呈实性片块状排列,示恶性核特征和吞噬血细胞作用,细胞异型性明显,核分裂象增多,伴有坏死,可侵犯周边器官。免疫组化也可同时显示内皮及组织细胞标记,免疫组化鉴别诊断没有意义。(4)脾窦岸细胞血管内皮瘤:为低度恶性肿瘤,大部分区域除有典型的脾窦岸细胞血管瘤外另见实性区域伴坏死灶,瘤细胞核轻度异型,但无明显的恶性特征,仅表达内皮细胞标记物。(5)脾血管肉瘤:发病年龄较大,临床恶性度高,病程进展快,病理组织学瘤细胞异型性明显,核分裂象多见伴坏死,免疫组化表达内皮,组织细胞标记物不表达。(6)脾转移性癌,脾脏实质内缺乏淋巴管,其转移性癌可能性很小。
3.5 治疗与预后 LCA大多数为良性肿瘤,治疗最有效的办法为脾脏切除,一般预后良好。本组3例随访1~5a术后无复发及转移。Falk等[1]报道的17例中有1例发现有远处器官累及。Ben-Izhak等[5]报道1例良性LCA在脾切除术后8a再发,形成腹部肿块伴肝多发转移。Rosso等[6]报道1例恶性脾窦岸细胞血管肉瘤,同时文献报道,有1/3的LCA病例伴有内脏上皮性恶性肿瘤或恶性淋巴瘤。因此严密观察病人有无继发内脏肿瘤及术后密切随访肿瘤复发、转移十分重要。
[1]Falk S,Stutte HJ,Frizzera G.Littoral cell angioma.A novel splenic vascular lesion demonstrating histiocytic differentiation[J].Am J Surg Pathol,1991,15(11):1023-1033.
[2]Rosso R,Paulli U,et al.Littoral cell angiosarcona of the splwwn [J].Am J Surg Pathol,1995,19(10):1203-1208.
[3]Michal M,Slalova A,Fakan Fet F,et al.Littoral cell angiona of spleen:a case report with ultra struat ural and immunohistochemical observations[J].Zentralbl Pathol,1993,39(5):469-475.
[4]Arber DA,Strickler JG,Chen YY,et al,Splenic vascular tumour:A histologic,immunohenotypic and virologic study[J].Am J Surg Pathol,1997,21:827-835.
[5]Ben I zhak O,Bejar J,Ben Eliezer S,et al.Splenic littoral cell haemangioendothelioma:a new low grade vaniant of malignant littoral cell tumor[J].Histopathology,2001,39(5):469-475.
[6]Rosso R,Paulli M,Gianelli U,et al.Littoral cell angiosarcoma of the soleen,Case report with im munohistochemiacl and ultrastructural analysis[J].Am J Surg PATOL,1995,19(10):1230-1238.

