抑制JAK/STAT信号通路对缺血再灌注大鼠心肌的影响
刘冬云 侯云生 王天轶 (白求恩国际和平医院急诊科,河北 石家庄 050082)
随着急诊溶栓、经皮冠状动脉成形术等再灌注治疗的开展,心肌再灌注损伤已成为阻碍缺血心肌从再灌注治疗中获得最佳疗效的主要难题。研究表明,Janus激酶-信号转导子与转录激活系统(JAK/STAT)信号通路与缺血预处理诱导的心肌保护及缺血再灌注损伤(I/R)引起的心功能障碍密切相关〔1〕。但目前有关JAK-STAT信号通路在心肌I/R中的作用还有争议。本课题拟研究抑制JAK/STAT信号通路对I/R大鼠心肌的影响,有助于从细胞信号转导水平研究I/R损伤的发病机制,从而为临床治疗I/R损伤提供新的方法。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级Wistar雄性大鼠24只,体重250~300 kg,河北医科大学实验动物中心购置,于清洁环境下自由饲养。将实验动物随机分为4组,假手术组(C组),开胸后以5-0无损伤缝线直接穿过冠状动脉,不结扎;I/R组,建立I/R模型;JAK抑制剂——AG490(I/R+AG490)组,于 I/R前30 min腹腔注射AG 490(8 μg/g);STAT抑制剂——雷帕霉素(RMP)(I/R+RMP)组,I/R 前30 min腹腔注射 RMP(0.4 μg/g)。
1.1.2 主要试剂 兔抗JAK2多克隆抗体、兔抗STAT1多克隆抗体、兔抗STAT3多克隆抗体均为美国Santa Cruz公司产品,兔抗p-JAK2多克隆抗体、兔抗p-STAT1多克隆抗体、兔抗p-STAT3多克隆抗体均为美国Cell Signaling公司产品,TUNEL细胞凋亡试剂盒购于武汉博士德生物工程有限公司。
1.2 方法
1.2.1 大鼠心肌I/R模型的建立 Wistar大鼠以90 mg/kg选用3%戊巴比妥钠进行腹腔麻醉注射。固定大鼠,常规取材前准备,并记录全导心电图,以潮气量5 ml/100 g的小动物呼吸机辅助呼吸,造模过程中根据呼吸频率、强度调整其参数,于胸骨左侧约0.5 cm处、第3~5肋间切口,钝性分离至肋间隙,剪断第三、四肋,使得在胸腔暴露的情况下刺穿心包膜,用5-0无损伤缝线在左冠状动脉前降支处穿过心肌表层,进针深度为1.0~1.5 mm,宽度为2~3 mm,稳定10 min后将一胶管(1.5~2.0 mm)平行置于冠状动脉表面,连同硅胶管一起结扎冠状动脉前降支,使胶管压迫冠状动脉造成心肌缺血,结扎。
模型成功标准:全导心电图示在心肌I/R过程中伴有ST段变化或QRS波增宽、增高,结扎线以下心肌颜色变暗,表示结扎成功。结扎30 min后,剪断结扎线,拔除硅胶管,再灌注120 min。再灌注成功即心肌颜色变为鲜红。假手术组仅穿线不结扎,AG490组及RMP组于I/R前30 min分别注射AG490 8 mg/kg、RMP 0.4 mg/kg。
1.2.2 Western印迹检测 采用常规方法进行操作。再灌注结束后取出心脏,洗净血迹,剪去右室及心房,用滤纸吸干,取左心室前壁液氮冷冻。从液氮罐中取出心肌组织置于匀浆器中,加入细胞裂解液(50 mmol/L Tris-HCl pH 8.0,150 mmol/L NaCl,0.02%NaN3,0.1%SDS,100 μg/ml PMSF,1 μg/ml抑酞酶,1%NP-40,0.5%去胆酸鈉),置于冰上进行匀浆,裂解30 min后即用移液器移置1.5 ml离心管中,12 000 r/min 4℃离心10 min,取上清液置于-80℃保存。Lowry法测定总蛋白量,调蛋白质浓度为200 μg。总的蛋白提取物经10%十二烷基硫酸钠-聚丙烯凝胶(SDS-PAGE)电泳,将蛋白转移至醋酸纤维膜上,分别与抗JAK2、STAT1、STAT3多克隆抗体,抗pTyr-JAK2、抗pTyr-STAT1、抗pTyr-STST3共同孵育2 h,然后洗脱,封闭后加入1∶2 000的二抗(辣根酶记的羊抗兔IgG抗体),室温下杂交1 h,化学发光试剂增强反应,X光压片曝光,漂洗后自显影。用密度扫描仪测定条带的密度(OD),以光密度代表细胞外信号调节激酶(EPK)蛋白的相对表达值。
1.2.3 组织切片制备 取出心脏,洗净血迹,剪取右心室和心房,用滤纸吸干,置于4%多聚甲醛中固定24 h,从心尖始以间距0.3 cm横向连续切片至冠状动脉穿线处,石蜡包埋切片。
1.2.4 细胞凋亡检测(原位末端标记法,TUNEL) ①冰冻切片用0.01 mol/L磷酸盐缓冲液(PBS)洗2 min,2次,蒸馏水洗2 min,2次;②3%的H2O2阻断内源性辣根过氧化物酶室温处理10 min,蒸馏水洗;③每片加标记缓冲液20 μl,以保持切片的湿润,按每张切片取 TdT 和DIG-d-UTP各1 μl,加入18 μl标记缓冲液中,混匀。甩去切片上多余液体后加标记液。置样品于湿盒中,37℃标记2 h;④0.01 mol/L Tris盐酸缓冲液(TBS),每片加封闭液50 μl,室温30 min甩掉封闭液,不洗;⑤1∶100稀释地高辛抗体,混匀后50 μl/片加至标片上,置样品于湿盒中,37℃反应30 s,0.01 mmol/L TBS冲洗;⑥用抗体稀释液1∶100稀释,生物素-链霉亲合素-过氧化物酶法(SABC):取1 ml抗体稀释液加 SABC 10 μl,混匀后 50 μl/片加至切片,37℃ 反应30 s,0.01 mmol/L TBS洗;⑦二氨基联苯胺(DAB)显色,苏木精轻度复染,脱水、封片。每张切片拍摄5个视野,根据每个视野中心肌细胞阳性数量计算百分比,作为凋亡指数(AI)。
1.3 统计学方法 应用SPSS11.0统计软件进行分析,计量资料采用t检验,以±s表示;计数资料采用χ2检验。
2 结果
2.1 Western印迹检测结果 假手术组 p-JAK2、p-STAT1、p-STAT3少量表达;与假手术组比较,缺血再灌注后p-JAK2、p-STAT1、p-STAT3表达明显增加,且p-STAT1较p-STAT3的表达增加明显;应用 AG490后,p-JAK2、p-STAT1、p-STAT3的表达减少;应用RMP后p-JAK2、p-STAT1的表达无改变,p-STAT3的表达减少。见图1。
2.2 心肌细胞凋亡检测的结果 假手术组、I/R组、AG490组、RMP组 AI分别为4.25±2.04,12.58±1.35,7.36±1.30,13.32±1.58,组间比较差异显著(P<0.05)。
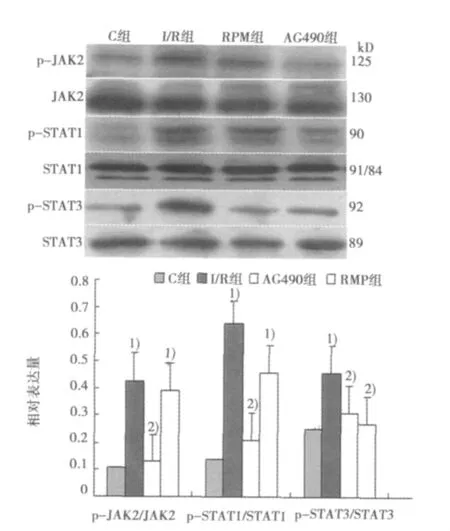
图1 Western印迹检测结果
3 讨论
业已证实,胞内信号转导途径JAK/STAT信号通路主要将胞膜感受的信号直接传递到核内,从而启动基因转录,其中JAK是胞质内非受体型的一类可溶性酪氨酸蛋白激酶,已知有4 个亚型——JAK1、JAK2、JAK3 及 TYK2;而 STATS属于人和哺乳动物共有的可与靶基因调控区DNA结合的另外一类胞质蛋白家 族,有 7 个 亚 型——STAT1、STAT2、STAT3、STAT4、STAT5a、STAT5b、STAT6,上述两种均可在心肌细胞表达。
有研究显示,G蛋白耦联的神经激素(AngⅡ、腺苷、内皮素等)、细胞因子(白介素、肿瘤坏死因子等)等胞外信号转导可通过激活蛋白激酶JAK,进而影响STATS磷酸化,产生心肌I/R,从而进入细胞核发挥生物效应。据此推测,JAK-STAT信号通路可能参与了I/R过程。本研究成功建立了在体大鼠心肌I/R模型,发现缺血30 min再灌注120 min后,大鼠心肌磷酸化的JAK2、STAT1、STAT3数量都增高,同时磷酸化的STAT1数量远较磷酸化的STAT3多,凋亡的心肌细胞也明显增多。于I/R前30 min给大鼠腹腔注射JAK2抑制剂AG490后 JAKs和STATs的活化被显著抑制,凋亡的心肌细胞数量也明显减少。于I/R前30 min给大鼠腹腔注射RMP对磷酸化的JAK2及STAT1数量没有影响,但能抑制STAT3的磷酸化,使p-STAT1和p-STAT3的比例增高,同时凋亡的心肌细胞数量与I/R组相比增多。综上所述,心肌I/R后JAK/STAT信号通路被激活,且STAT1和STAT3的激活对心肌具有相反的作用〔2,3〕,心肌缺血时伴有的细胞凋亡时STAT1表达增加、转录活性增强,而激活的STAT3不仅抑制心肌细胞凋亡,还能发挥心肌保护作用〔4〕。大鼠心肌I/R时,JAK/STAT通路的激活可能加重心肌损伤,而心肌损伤的程度可能与p-STAT1和p-STAT3的比例有关,p-STAT1和p-STAT3的比例越高,心肌损伤的程度可能越重。而AG490作为JAK2的特异性拮抗剂,可减少心肌梗死面积,降低细胞凋亡并促进心功能的恢复〔5,6〕,从而能减轻I/R导致的心肌损伤。
1 Booz GW,Day JN,Baker KM.Interplay between the cardiac renin angiotensin system and JAK/STAT signaling:role in cardiac hypertrophy,ischemia/reperfusion dysfunction,and heart failure〔J〕.J Mol Cell Cardiol,2002;34(11):1443-53.
2 Boengler K,Buechert A,Heinen Y,et al.Cardioprotection by ischemic postconditioning is lost in aged and STAT3-deficient mice〔J〕.Circ Res,2008;102(1):131-5.
3 高美华,张 丽,李 冰,等.川穹嗪对AngⅡ诱导大鼠心肌肥大细胞JAK-STAT通路作用〔J〕.细胞与分子免疫学,2011;27(5):519-22.
4 Barry SP,Townsend PA.Role of the JAK-STAT pathway in myocardial injury〔J〕.Trends Mol Med,2007;13(2):82-9.
5 Ng DCH,Court NW,dos Remedios CG,et al.Activation of signal transducer and activator of transcription(STAT)pathways in failing human hearts〔J〕.Cardiovasc Res,2003;57(2):333-46.
6 刘雪平,董泗芹,郑 敏,等.贝那普利阻断RAS对自发性高血压大鼠心肌JAK-STAT信号通路的影响〔J〕.中国老年学杂志,2007;27(17):1651-4.

