钼酸铵溶液镁盐沉淀法除砷的热力学分析
杨亮,赵中伟,何利华,霍广生,陈爱良
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
在我国贵州遵义和湖南张家界,储存有大量的镍钼矿资源[1-3]。镍钼矿是一种新型的钼矿资源,镍钼矿中钼含量高达约为4%,砷含量约为0.8%[4-5]。浸出镍钼矿时[6],砷与钼同时进入浸出液中。Zhao等[7]开发了N-235萃取提钼工艺,由于砷与钼形成杂多酸离子,与钼共萃取而进入钼酸铵溶液中。典型溶液含钼的质量浓度约为90 g/L时,砷的质量浓度约为8 g/L,砷钼质量比高达0.09。但是钼冶金产品中,砷是严格控制的杂质元素,其中钼酸铵产品 GB 3460—2007中,MSA-0级钼酸铵产品中规定砷质量浓度小于 5×10-6g/L,因此,需要采用适当的方法深度除砷。从钼酸铵溶液中除砷的方法主要有离子交换法[8]、溶剂萃取法[9]、吸附法[10-11]、沉淀法等。离子交换法难以处理砷含量较高以及成分复杂的溶液。采用伯铵和TBP萃取除砷则存在砷萃取率不高且钼损较大的缺点。采用铁盐吸附法除砷,钼损失较大且吸附剂的再生及回收较为困难。铵镁盐沉淀法具有除砷效果好、钼损失率低、滤渣过滤性能好及操作简单等优点而被广泛采用。但是对除砷过程的平衡问题特别是理论研究不太透彻,仅凭经验判断来控制工艺条件。在此,本文作者通过热力学分析,绘制出镁盐除砷过程的热力学平衡图并进行热力学分析,以期能深化认识以及为生产实践提供一定的理论指导。
1 热力学数据处理及计算
钼酸铵溶液中加入氯化镁溶液,砷形成溶解度小的砷酸盐而除去。考虑到钼酸铵溶液为氨性体系,分析了氨浓度较高时([N]T=1~5 mol/L)除砷的热力学过程。考察了不同总氨浓度及不同镁盐加入量对溶液离子组成与固相平衡的关系。
在 NH4+-Mg2+-AsO43--H-H2O 体系中,除了生成MgNH4AsO4外,还可能存在固相 MgHAsO4(s),Mg3(AsO4)2(s)和 Mg(OH)2(s)。由于缺乏 MgNH4AsO4的热力学参数,采用化学中广泛应用的同系线形规律进行估算[12]。估算时所采用的有关化合物的热力学数据[13]如表1所示。

除砷过程中发生的化学反应及表观化学平衡常数如表2所示。
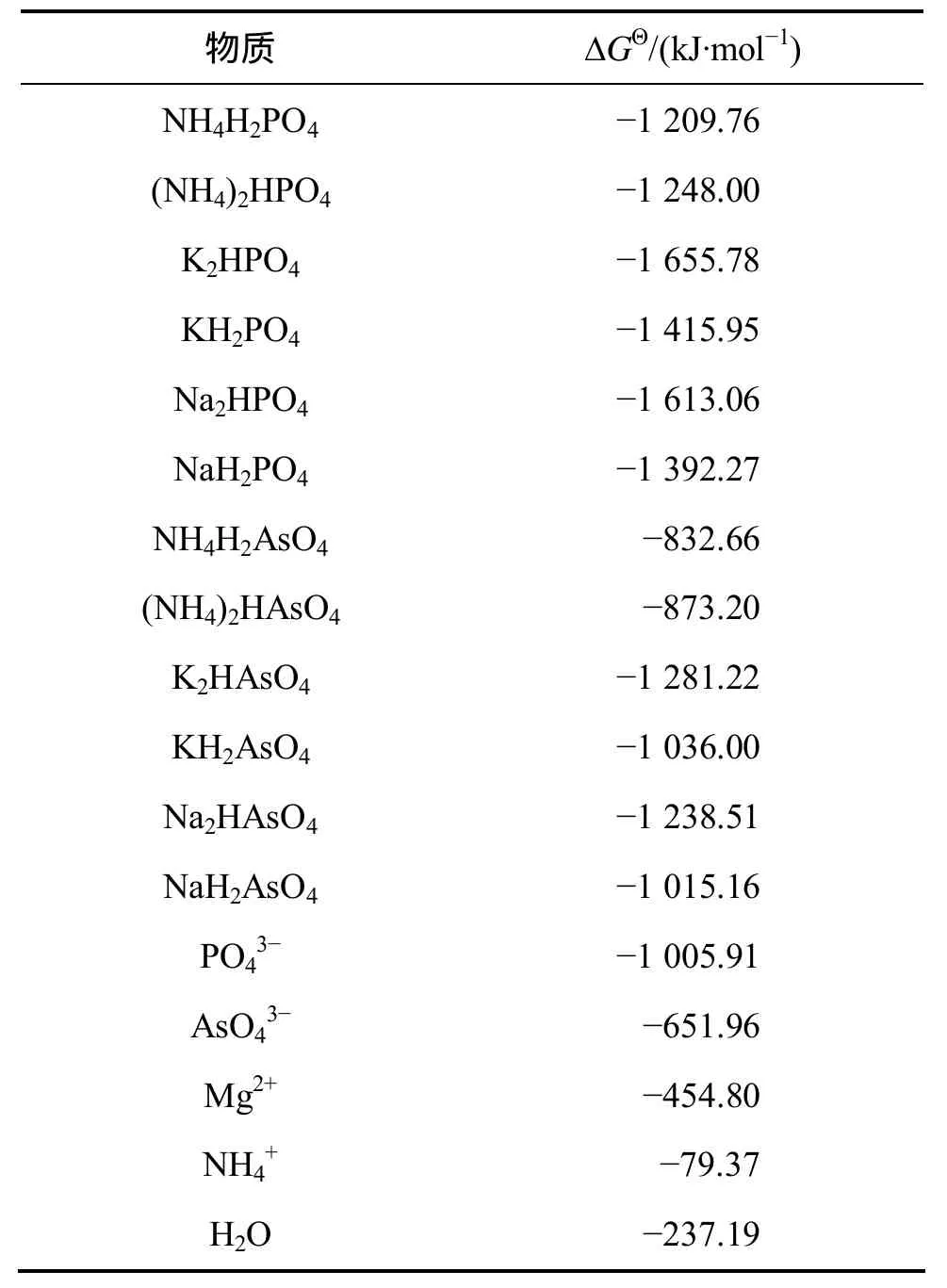
表1 磷和砷化合物的热力学数据Table 1 Thermodynamic data of compounds containing P and As
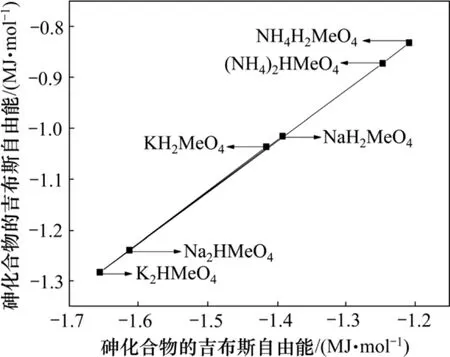
图1 砷盐与磷盐ΔGΘ间的同系线性关系Fig.1 Linearity relation of ΔGΘ between arsenic compounds and phosphorus compounds
由于该体系成分较为复杂,且缺乏相关物质的活度系数,故本计算均以物质的浓度代替活度。由上述平衡关系式可以看出溶液中的N,Mg和As的形态有H2AsO4-,HAsO42-,AsO43-,MgH2AsO4+,MgHAsO4,MgAsO4-,Mg2+,NH3,NH4+和 MgOH+。由表 2 可知:
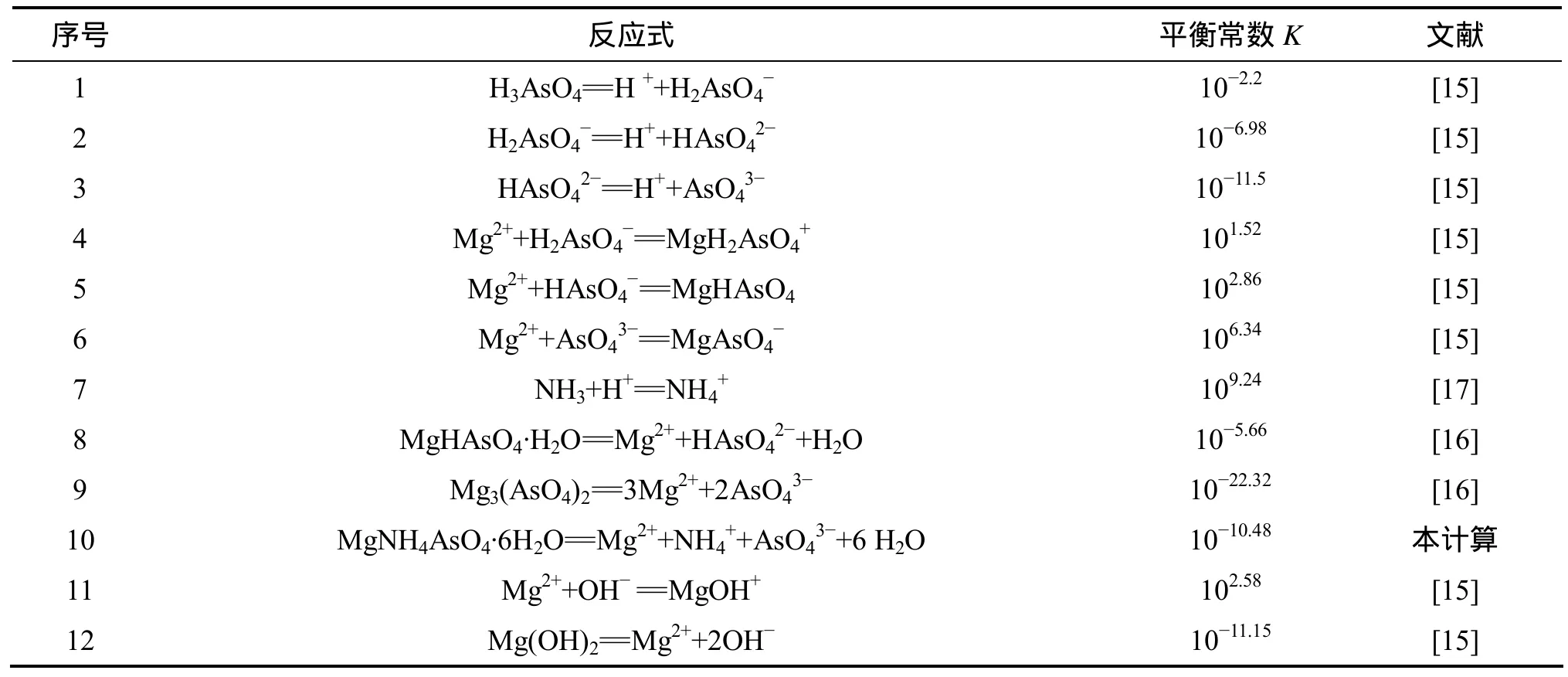
表2 除砷时的化学反应及其在25 ℃下的平衡常数Table 2 Equilibrium constant and chemical reaction in process of arsenic removal (25 ℃)
各离子平衡浓度应满足下列方程:

随着溶液pH的变化,溶液中会出现不同的固相组成,因此它们的溶解平衡需要分别加以考虑。当体系处于MgHAsO4稳定区时,则有平衡关系式:

溶液中各离子浓度满足式(1)~(9),当体系处于MgNH4AsO4稳定区时,则有平衡关系式:
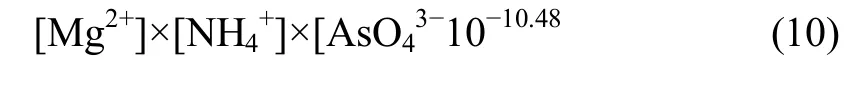
溶液中各离子浓度则满足式(1)~(8)和式(10),当体系处于Mg3(AsO4)2稳定区时,则有平衡关系式:
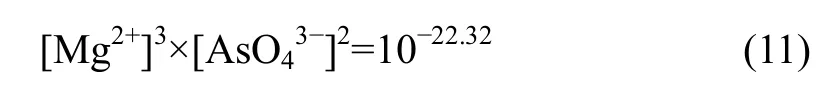
溶液中各离子浓度应满足式(1)~(8)和式(11),当体系处于Mg(OH)2稳定区时,则有平衡关系式:
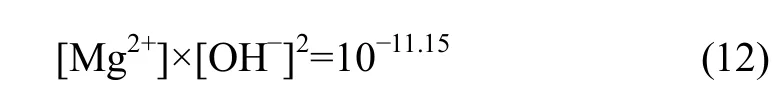
溶液中各离子浓度则满足式(1)~(8)和式(12)。
根据质量平衡原理可知:溶液中总氮、总砷和总镁浓度分别为:

因此,根据同时平衡原理,在固定总氨[N]T、总砷[As]T以及总镁[Mg]T的条件下,可计算出各固相成分稳定存在的 pH区间,以及溶液中各离子的平衡浓度。
2 结果与讨论
2.1 溶液中总氨浓度[N]T对除砷的影响
图2所示为[As]T=0.1 mol/L,[Mg]T=0.1 mol/L时,不同总氨浓度时lg[As]T与pH关系。从图2可知:当溶液中总氨浓度为[N]T=1 mol/L,[Mg]T=[As]T=0.1 mol/L时,随着体系pH的逐渐增大,溶液中稳定存在的固相依次为 MgHAsO4,MgNH4AsO4,Mg3(AsO4)2和 Mg(OH)2,Mg(OH)2,其中 MgNH4AsO4沉淀稳定区域为6.7<pH<10.5。固定其他条件不变,增大总氨浓度至[N]T=5 mol/L时,随pH的变化,溶液中稳定存在的固相依次为MgHAsO4,MgNH4AsO4,MgNH4AsO4和 Mg(OH)2,Mg(OH)2,其中 MgNH4AsO4沉淀稳定区域为6.0<pH<10.7,MgNH4AsO4和Mg(OH)2共沉淀的稳定区间为10.7<pH<11.8。通过对比可以发现:随着体系总氨浓度的提高,MgNH4AsO4沉淀的稳定区域变大,且Mg3(AsO4)2和Mg(OH)2共沉淀区域消失,取而代之的是MgNH4AsO4和Mg(OH)2共沉淀。从图2还可以发现:控制溶液的 pH使体系处于MgNH4AsO4沉淀的稳定区时,除砷效果最好,而且溶液中总氨浓度越高,则平衡时溶液中总砷浓度越低。处理镍钼矿得到的钼酸铵溶液总氨浓度较高(约为 5 mol/L),与钼酸钠溶液中除砷不同,无需调整氨浓度便可达到较好的除砷效果。

图2 [As]T=0.1 mol/L、[Mg]T=0.1 mol/L时,不同总氨浓度时lg[As]T与pH关系Fig.2 lg[As]T-pH at different total ammonium concentrations([As]T=0.1 mol/L, [Mg]T=0.1 mol/L)
2.2 镁盐用量对除砷的影响
处理镍钼矿得到的钼酸铵溶液中总氨浓度约为 5 mol/L,砷约为 0.1 mol/L。在实际操作中,加入理论用量的MgCl2往往难以将砷除尽,因此,实践中往往加入过量的氯化镁。参考生产实际参数,考察镁加入量为理论量1.2倍时,平衡时体系各组分随溶液pH的变化关系。
图3所示为[N]T=5 mol/L, [As]T=0.1 mol/L时,不同镁盐用量时lg(As)T与pH关系。从图3可知:控制适当的pH使得体系处于MgNH4AsO4稳定区域时,随着镁盐加入量的增大,平衡时溶液砷含量更低,除砷效果更好。随着镁盐加入量的增大,MgNH4AsO4沉淀的稳定区域缩小,其稳定区域由原来的6.0<pH<10.7缩小至6.0<pH<9.5,在图3中显示即由①线向左平移至②线位置,而MgNH4AsO4与Mg(OH)2共沉淀稳定区增大。因此,钼酸铵溶液中加入过量的氯化镁除砷时,需要严格控制溶液的pH。倘若钼酸铵溶液pH大于9.5时,将形成MgNH4AsO4与Mg(OH)2共沉淀,不仅溶液中砷含量增大,除砷效果变差,而且由于生成的Mg(OH)2沉淀比较黏稠,容易吸附溶液中的钼而造成钼的回收率下降。从图3还可以发现:当加入1.2倍理论量的氯化镁除砷时,控制溶液pH为9时,除砷效果较好,热力学上可将砷质量浓度降低至2×10-6g/L左右,此时,由图5和图6可知:溶液中残留的砷主要以MgAsO4-离子形态存在,残留的镁则主要以游离的Mg2+存在,且由图4可知:残留的镁浓度约为0.02 mol/L(即0.48 g/L)。当溶液pH位于9.5和11.7之间,平衡固相组成为MgNH4AsO4和Mg(OH)2,且随着 pH增大,共沉淀中砷酸铵镁逐渐减少,氢氧化镁含量逐渐增大(见图7)。当溶液pH大于11.7时,溶液中稳定存在的是氢氧化镁沉淀。实际上,处理镍钼矿所得的钼酸铵溶液pH约为9,无需调整溶液的pH即可达到较好的除砷效果。

图3 [N]T=5 mol/L, [As]T=0.1 mol/L时,不同镁盐用量时lg(As)T与pH关系Fig.3 lg[As]T-pH at different dosages of magnesium salt([N]T=0.1 mol/L, [As]T=0.1 mol/L)

图4 [N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,各种离子分布随pH变化分布图Fig.4 lg c-pH diagram for different ions of Mg-NH4-As-H2O system ([N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L)

图5 [N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,各种含砷离子百分比-pH图Fig.5 Percentage of various arsenic-bearing ions versus pH([N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L)

图6 [N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,各种含镁离子百分比-pH图Fig.6 Percentage of various magnesium-bearing ions versus pH ([N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L)
3 实验验证

图7 [N]T=5 mol/L, [As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,沉淀成分比例(摩尔比)与pH关系Fig.7 Mole ratio of solid species at different pH of Mg-NH4-As-H2O system ([N]T=5 mol/L, [As]T=0.1 mol/L,[Mg]T=0.12 mol/L)
取 100 mL钼酸铵溶液,其中钼的质量浓度为96 g/L,砷的质量浓度为7.5 g/L,总氨浓度为5 mol/L,加入1.2倍理论量的MgCl2,在25 ℃搅拌1 h,控制反应终点pH为9左右,过滤,除砷后的钼酸铵溶液中镁和砷的质量浓度分别为0.51 g/L和9.5 mg/L,砷钼质量比为9.8×10-5。将理论计算值与实验值对比可以发现:理论计算除砷率为99.97%,实验中除砷率为99.87%,两者非常接近,除砷后溶液中砷钼质量比为9.8×10-5,可使得钼酸铵产品中砷含量不超标;溶液中残留的镁浓度与计算值较为接近,相对误差为5.8%,这可能是热力学计算过程中以浓度代替活度所导致。
除砷后钼酸铵溶液中过量的镁,会在后续钼酸铵酸沉结晶时析出,使得产品中镁含量超标,因此,在酸沉结晶之前可用阳离子交换法除去溶液中多余的镁[18]。
4 结论
(1) 应用同系线性规律估算出 MgNH4AsO4溶度积,并且绘制出了25 ℃时,NH4-Mg-As-H2O系的热力学平衡图。
(2) 随着溶液中总氨浓度和镁盐用量的增大,平衡时砷含量更低。当溶液中总氨浓度[N]T=5 mol/L,[As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,整个pH范围内的沉淀稳定区如下:4.0<pH<6.0时为 MgHAsO4的稳定区,6.0<pH<9.5时为MgNH4AsO4的稳定区,9.5<pH<11.7时为 MgNH4AsO4和 Mg(OH)2的稳定区,pH>11.7时为Mg(OH)2的稳定区。
(3) 当溶液中总氨浓度[N]T=5 mol/L,[As]T=0.1 mol/L, [Mg]T=0.12 mol/L,控制溶液的pH为9时,除砷效果最好,热力学上可将砷质量浓度除至 2×10-6g/L,溶液中残留的镁浓度为 0.02 mol/L,且主要以Mg2+形态存在。
(4) 通过实验验证,理论计算结果与实验数据较为符合。当溶液中总氨浓度[N]T=5 mol/L,[As]T=0.1 mol/L, [Mg]T=0.12 mol/L时,镁平衡浓度相对误差为5.8%。
[1] Jiang S Y, Yang J H, Ling H F, et al. Extreme enrichment of polymetallic Ni-Mo-PGE-Au in Lower Cambrian black shales of South China: An Os isotope and PGE geochemical investigation[J]. Palaeogeography, Palaeoclimatology,Palaeoecology, 2007, 254(1/2): 217-228.
[2] Kribek B, Sykorova I, Pasava J, et al. Organic geochemistry and petrology of barren and Mo-Ni-PGE mineralized marine black shales of the Lower Cambrian Niutitang Formation (Southern China)[J]. International Journal of Coal Geology, 2007, 72(3/4)240-256.
[3] Orberger B, Vymazalova A, Wagner C, et al. Biogenic origin of inter-grown Mo sulfide and carbonaceous matter in Lower Cambrian black shales (Zunyi Formation, SouthernChina)[J].Chemical Geology, 2007, 238(3/4): 213-231.
[4] 陈代雄, 唐美莲, 薛伟, 等. 高碳镍钼矿可选性试验研究[J].湖南有色金属, 2006, 22(6): 9-11.CHEN Dai-xiong, TANG Mei-lian, XUE Wei, et al. Study on dressing of high carbon nickel-molybdenum ore[J]. Hunan Nonferrous Metals, 2006, 22(6): 9-11.
[5] 吴海国. 含碳镍钼矿提取镍钼冶炼新工艺实验研究[J]. 湖南有色金属, 2008, 24(2): 16-18.WU Hai-guo. Ni-Mo carbon molybdenum smelting of nickel ore to test new technology research[J]. Hunan Nonferrous Metals,2008, 24(2): 16-18.
[6] ZHAO Zhong-wei, ZHANG Gang, HUO Guang-sheng, et al.Kinetics of atmospheric leaching molybdenum from metalliferous black shales by air oxidation in alkali solution[J].Hydrometallurgy, 2009, 97(3/4): 233-236.
[7] ZHAO Zhong-wei, YANG Liang, HUO Guang-sheng, et al.Solvent extraction of molybdenum blue from alkaline leaching solution of the Ni-Mo ore[J]. International Journal of Refractory Metals and Hard Materials, 2011, 29(2): 232-236.
[8] An B, Fu Z, Xiong Z,et al. Synthesis and characterization of a new class of polymeric ligand exchangers for selective removal of arsenate from drinking water[J]. Reactive & Functional Polymers, 2010, 70(8): 497-507.
[9] ZHAO You-cai, CHEN Jia-yong. Extraction of phosphorus,arsenic and/or silica from sodium tungstate and molybdate solutions with primary amine and tributyl phosphate as solvents.Ⅰ: Synergistic extraction and separation of phosphorus, arsenic and/or silica from tungstate and molybdate solutions[J].Hydrometallurgy, 1996, 42(3): 313-324.
[10] 刘锐平,李星, 夏圣骥, 等. 高锰酸钾强化三氯化铁共沉降法去除亚砷酸盐的效能与机理[J]. 环境科学, 2005, 26(1): 72-75.LIU Rui-ping, LI Xing, XAI Sheng-ji, et al. Effectiveness and mechanism of permanganate enhancing arsenite co-precipitation with ferric chloride[J]. Environmental Science, 2005, 26(1):72-75.
[11] Masue Y K, Loeppert R H, Kramer T A. Arsenate and arsenite adsorption and desorption behavior on co-precipitated aluminum:Iron hydroxides[J]. Environ Sci Technol, 2007, 41(3): 837-842.
[12] 聂长明, 范明舫. 有机同系物性质的递变规律研究[J]. 有机化学, 2000, 20(1): 122-130.NIE Chang-ming, FAN Ming-fang. Regularity of physicochemical properties for homologous organic compounds[J]. Chinese Journal of Organic Chemistry, 2000,20(1): 122-130.
[13] Dean J A. Langep′s handbook of chemistry[M]. 15th ed. New York: Me Graw-Hill professional, 1999: 681-696.
[14] Warmadewanthi Liu J C. Recovery of phosphate and ammonium as struvite from semiconductor wastewater[J]. Separation and Purification Technology, 2009, 64(3): 368-373.
[15] Cornelis G, Poppeb S, Gervena T V, et al. Geochemical modelling of arsenic and selenium leaching in alkaline water treatment sludge from the production of non-ferrous metals[J].Journal of Hazardous Materials, 2008, 159(2/3): 271-279.
[16] García-Lara A M, Montero-Ocampo C. Improvement of arsenic electro-removal from underground water by lowering the interference of other ions[J]. Water Air Soil Pollut, 2010,205(1/2/3/4): 237-244.
[17] Udert K M, Larsen T A, Gujer W. Estimating the precipitation potential in urine-collecting systems[J]. Water Research, 2003,37(11): 2667-2677.
[18] Huggins D K, Queneau P B, Ziegler R C, et al. Ion exchange purification of ammonium molybdate solutions[J].Hydrometallurgy, 1980, 6(1/2): 63-73.

