适于肝干细胞培养的壳聚糖-硫酸肝素-透明质酸复合支架①
雷菠,曲鑫建,李韬,孔保庆,莫颂轶,王凤永
(1.右江民族医学院基础学院,广西 百色 533000 E-mail:qxjnm312@yahoo.com.cn;2.大连理工大学干细胞与组织工程研发中心,辽宁 大连 116024)
近年来,广西地方性肝脏疾病流行广泛,严重影响当地居民健康[1,2]。随着肝脏病治疗技术的发展,细胞移植治疗备受关注,利用干细胞再生医学的“人工肝脏”修复功能缺失的组织器官成为技术要点[3,4]。肝组织工程就是利用三维支架、种子细胞在适宜的环境中构建体外可移植的肝脏替代组织,以求解决治疗肝脏疾病这一难题[5~7]。壳聚糖(chitosan,C)、硫酸肝素(heparin sulfate,HS)和透明质酸(hyaluronate,Ha)是具有很好的生物相容性的药用天然材料[8~10]。已有研究通过对C的改性,构建与其他材料的复合支架等进行临床应用,但是此类支架的性能存在着不同的缺陷,如孔的贯穿性不大,支架与细胞的黏附率不高等[11,12]。复合生物材料加入Ha,则孔的贯穿性较好,细胞在支架上分布均匀[13,14];复合支架中若有 Hs,则利于肝前体细胞生长[15]。笔者研究一种新型C-HS-Ha复合支架,并探索此支架与肝干细胞(hepatic stem cells,HSCs)共培养模型,用于体外构建适合细胞生长增殖和细胞黏附作为三维支架材料3D模型,为用于肝组织工程和药物筛选奠定研究基础。
1 材料与方法
1.1 材料 表皮生长因子(EGF),胰岛素(insulin),胶原酶(Sigma),溶 菌 酶 (Sigma)DMEM/F12 粉 (Gibco),Hoechst33342(Sigma),CCK-8Kit(日本同仁化学研究所。C(90%的脱乙酰度)、HS和Ha购于上海伯奥生物科技有限公司。2-吗啉乙烷磺酸 (MES),碳化二亚胺(EDAC),N-羟基琥珀酰亚胺(NHS)购于北京恒业中远化工有限公司。
冷冻干燥机(德国GT2-9);倒置相差显微镜(OLYMPUS IX70);扫描电子显微镜(日立公司S2520);酶标仪(Thermo Labsystems MK3)。
1.2 实验方法
1.2.1 支架材料的制备 在60℃水浴下,将 HS、Ha各以0.036%(W/V)一起溶于水,作为原液1;将C溶于2%(V/V)的乙酸溶液制得百分含量为1.8%(W/V)的原液2,进行离心、除渣和脱泡。将原液1∶原液2以体积比为3∶7、4∶6、5∶5混合后,高速旋转震荡,使成分混匀充分,静置除泡。取96孔板,每孔注入200ml混合液,预冻4h(-80℃冰箱),冷冻干燥24h,支架成型。随后进行交联支架,将支架浸入含50mmol/L MES、50mmol/L EDAC、50mmol/L NHS的40%(V/V)乙醇试剂中,室温交联6h。将交联剂去除,为中和残留乙酸,再加入0.1mol/L Na2HPO4(pH=7.4)室温孵育2h;用乙醇40%(V/V)清洗4次,每次30min,经双蒸水反复冲洗至pH值为7.0左右,再次冷冻干燥,即得C-HS-Ha复合3D支架(以不加Ha和HS制备的C复合支架作为对照组)。相差显微镜下观察,选择结构均一的支架,修剪成可适宜放置培养器中大小形状,消毒备用。
1.2.2 吸水率、降解率、支架孔径和孔隙率的测定 ①吸水率:设支架干态时的质量为(W0),室温下浸泡于三蒸水中24h后支架的质量为(W1),分析天平称量。则支架材料吸水率为:②降解速率:将C-HS-Ha支架放置在含有溶菌酶1×105u,胶原酶的磷酸盐缓冲液(PBS)的试管内,置于37℃水浴6周,每隔1周取出支架,蒸馏水洗后冷冻干燥并称重(W)。支架材料降解率为:d(%)③平t均孔径:将支架C-HS-Ha真空喷金后,扫描电镜下观察支架表面形态学结构。在支架的内部选取4个不同的视野,每个视野下测量10个孔径值,计算支架的平均孔径。④孔隙率:设C-HS-Ha支架材料的质量(Ms),盛满乙醇的比重瓶质量(M1),乙醇充分充盈于支架材料孔隙并加满乙醇后的质量(M2),取出支架材料后的剩余乙醇与比重瓶质量(M3),分别用分析天平称量。材料孔隙率为:ε(%)=
1.2.3 HSCs分离培养 新鲜分离细胞用F12/DMEM培养液悬浮,计数后以一定密度接种在6孔和24孔培养板中。F12/DMEM 培养液含10%FCS 、100u/ml青霉素 G、100μg/ml链霉素、5μg/ml胰岛素(insulin)、各种生长因子等,于CO2培养箱37℃培养。一般待细胞增殖80%瓶底面积时对其传代。
1.2.4 HSCs的种植和3D培养 复合支架(直径0.5cm,高0.4cm)浸泡在基础培养基(DMEM∶F12=1∶1)中12h,除去支架表面水分,放置于另一个孔板(ⅰ号)中。酶解消化肝干细胞并调整细胞的浓度(c)为每5×105cells/ml,取10μl体积(v)的细胞接种到支架上。将细胞与支架复合物置于37℃、5%的CO2培养箱内孵育0.5h,待细胞贴壁后,向ⅰ号板补加新鲜含10%胎牛血清的完全培养基。4h后将支架移至24孔板,并向24孔板补加完全培养基,计算ⅰ号板溶液中未黏附的细胞总数a1。则细胞实际上架总数为c×v-a1。按下式计算黏附率:黏
1.2.5 细胞与支架复合物的扫描电镜观察 收集培养6天的复合支架上的细胞,PBS洗涤细胞3次,室温下用2.5%戊二醛固定2h,PBS洗涤细胞3次;室温下1%锇酸固定2h,PBS洗涤细胞2次;用乙醇分别以浓度为30%、50%、70%、80%、90%、100%系列脱水各20min。然后包埋切片喷金,电镜下观察。
1.2.6 细胞增殖检测 以浓度为5×105cells/ml的HSCs,取10μl分别接种于每个C-HS-Ha复合支架组和C复合支架组中,同时以浓度为5×105cells/ml的 HSCs,体积100μl接种于96孔板培养(二维悬浮培养对照组),每组3个重复。应用CCK-8试剂分别在第1周内每天用酶标仪检测。
2 结果
2.1 扫描电镜观察空支架 电镜照片显示冻干后的C-HS-Ha复合材料呈纤维状排列并有大小不等的隆起,其表面粗糙,呈乳白色;材料内部有较多的孔隙,各孔隙相互贯穿,孔较均匀,呈海绵状多孔隙结构;孔壁厚约2.5μm(见图1)。支架孔的结构与原料的体积比有关,壳聚糖与明胶体积比为3∶7的复合支架最为疏松,5∶5的支架最致密。
3.2 支架孔径、孔隙率、吸水率及黏附率的测定 C-HSHa复合支架的孔径大部分分布在90~100μm之间,孔隙率均大于80%;孔径和空隙率随着C与G比例的增大而减小;当壳聚糖与明胶质量百分含量相同配比时(C∶0.9%,G∶0.9%),C-HS-Ha复合支架与C-G复合支架相比较,两者孔径和孔隙率相差不大,但前者的黏附率比后者增大约1.0倍,高达70.1% (见表1)。
2.3 扫描电镜观察空支架及HSCs在支架上的生长状态HSCs接种到C-HS-Ha复合支架内培养至第7天,可见细胞在支架孔壁上进行贴壁生长且相互连接(见图2A);在孔隙间通过细胞连接的细胞群体(见图2B)形成网络样结构,使得不同孔之间的HSCs相互联系形成上皮样结构。继续培养1周,细胞团簇紧密(见图2C),覆盖在支架表面与空隙之间,可见到大量增殖细胞。

图1 扫描电镜观察C-HS-Ha复合支架两原液(C和D)体积比:3∶7(A),4∶6(B),5∶5(C)

图2 扫描电镜下HSCs在C-HS-Ha复合支架内的生长状态
2.4 支架降解率的测定 C-HS-Ha复合支架在体外能降解,第1周降解约10%;在6周的降解测试中,前4周降解较快,之后降解较慢,到第6周降解趋于平缓,降解率达到30%左右。
2.5 HSCs在支架内生长增殖的检测 将等量的HSCs注入C-HS-Ha复合支架和C-G复合支架,由于支架不同,细胞的黏附率也不同,第1天所测的吸光度值不同,C-HS-Ha的吸光度值约为C-G的2倍(见图4)。从结果来看,在C-HS-Ha和C-G支架和二维环境中培养,HSCs生长曲线都呈S型,由于各种环境的情况有所不同而有所差别。细胞在3D下C-HS-Ha和C-G复合支架与二维96孔板培养,达到最高数量值的时间分别为第6天、第5天、第4天,随后细胞生长都进入生长平台期;在C-HS-Ha复合支架组中,由于C与G体积比不同,其增殖倍数也不同,体积比3∶7、4∶6、5∶5的细胞增殖倍数分别为11.3、11.2、10.3;C-G支架和二维悬浮培养的细胞增殖倍数分别约7.8倍和3.0倍(见图4)。
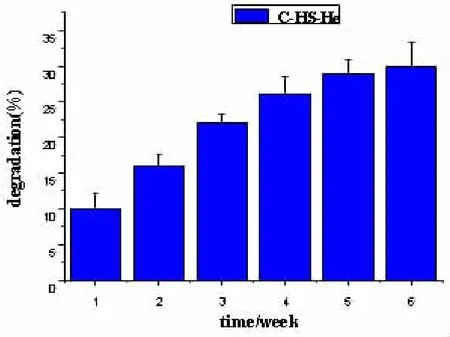
图3 C-HS-Ha复合支架的体外降解率
3 讨论
在干细胞与组织工程中,利用种子细胞、支架材料和生长因子在体外构建的类似三维功能环境是研究重点。作为组织工程支架的材料要求具备以下条件:无免疫源性,生物相容性良好;生理环境材料可降解和具有疏松多孔结构;可塑性和一定的力学支撑强度,利于细胞黏附和增殖[16,17]。由于C-G支架的细胞黏附率不高、孔的贯穿性不好、细胞分布均一性差,因而为了提高其黏附率、孔的贯穿性及细胞的分布均一性,我们制造了一种新支架C-HS-Ha复合支架材料,并将HSCs接种至此新支架中培养,进而考察细胞黏附及细胞的生长增殖等情况。
采用冷冻干燥法制备的C-HS-Ha复合支架孔隙均匀、孔的贯穿性较好且比表面大,又具有一定的机械强度,可维持支架的基本形状8周时间,从而对细胞起到有效的支撑作用;该支架能够降解,其降解产物对细胞无毒害作用,最重要的是HSCs接种到C-HS-Ha复合支架与C-G复合支架相比较,前者的细胞黏附率高达80%,约为后者的2倍;细胞分布比后者更均匀。这可能与以下因素有关。其一,通过调节支架表面的亲水性和表面电荷而促进细胞的黏附。三种材料除含有羟基外,C含有氨基;HS含有磺酸基;而Ha含有羧基。复合支架从成分上看增加了羟基、磺酸基、羧基官能团进而调节了支架表面的亲水性和表面电荷,有助于促进细胞粘附以及材料的生物相容性。其二,Ha可结合大量水的性质使支架的吸水率增大。有报道证实Ha在体内具有调节渗透压及细胞迁移等生理功能[18,19]。在Ha的作用下,细胞在支架上可进行生理迁移活动,避免了平面培养的接触抑制现象发生,有利于在支架内的细胞均匀生长分布;当Ha比例降解时,支架所提供的生长空间促使细胞形成团块状生长。其三,从支架结构上看,选择合适的条件如原料种类、原料浓度、各成分比例及冷冻干燥条件等可以制备不同的支架结构,本支架材料的孔径、孔隙率等都较理想,且孔的贯穿性较好,这些有利于细胞的生长。通过检测HSCs在C-HS-Ha复合支架内的生长增殖状态可知,细胞在支架内增殖约11倍,是C-G复合支架的1.4倍,是二维培养的3.7倍。电镜图片显示,HSCs形成了网络样结构生长并有类似组织样结构,说明C-HS-Ha比C-G复合支架更适合HSCs的生长增殖。制备的HSCs在C-HS-Ha支架上培养方式构成了模拟体内3D培养环境,其比表面积增加并且生长空间更大,因此,在培养器中可以一次性多添加培养基不用频繁更换,有利于细胞生长增殖。在正常生理环境上,细胞外基质是由胶原蛋白、糖蛋白、蛋白多糖等生物大分子所组成,这些分子相互交联成复杂功能的网状结构。本实验所选择的三种材料:C、HS和Ha都属于生物相容性良好的天然生物性材料,与细胞外基质成分相关。C是多糖物质,HS是蛋白聚糖类,Ha也是高分子多糖,应用此三种原料合成支架,其成分类似于细胞外基质成分,构成了对细胞生长有利的环境。另外,C-HS-Ha复合支架中含有HS以其可富集环境中的生长因子的作用[20],有利于细胞按自身信号来调节营养因子的释放,更好地促进HSCs的生长增殖等。Ha的作用使细胞分布均匀,从而提高了支架的空间利用率,因此更利于细胞的生长增殖。

图4 HSCs的标准曲线和HS/Cs在C-HS-Ha复合支架内的生长状态
理想的组织工程三维支架应该模拟体内细胞生存的微环境,诱导细胞与此微环境密切接触,并使细胞与材料很好地黏附,并最终在其上伸展与增殖,制备的C-HS-Ha复合支架,就是以此理念构建的具有良好细胞相容性的复合支架。从整体上看,本研究所构建的C-HS-Ha支架材料具备与细胞外基质结构和功能相似的特点,能很好地维持细胞黏附、生长、增殖,可作为HSCs的理想三维支架材料。

表1 复合支架的孔径、孔隙率、吸水率、细胞黏附率
[1] 盛治国,郭家彬,彭双清.体外细胞三维培养技术在药理毒理学研究中的应用[J].中国药理学与毒理学杂志,2007,21(5):444-448.
[2] Li Z,Leunq M,Hopper R,et al.Feeder-free self-renewal of human embryonic stem cells in 3Dporous natural polymer scaffolds[J].Biomaterials,2010,31(3):404-412.
[3] Irons HR,Cullen DK,Shapiro NP,et al.Three-dimensional neural constructs:a novel platform for neurophysiological investigation[J].J Neural Eng,2008,5(3):333-341.
[4] Tan H,Chuc R,Payne KA,et al.Injectable in situ forming biodegradable chitosan-hyaluronic acid based hydrogels for cartilage tissue engineering[J].Biomaterials,2009,30(13):2499-2506.
[5] He J,Li D,Liu Y.Fabrication and characterization of chitosan/gelatin porous scaffolds with predefined internal microstructures [J].Polymer,2007,48(13):4578-4588.
[6] Zehe C,Engling A,Wegehingel S,et al.Cell-surface heparan sulfate proteoglycans are essential components of the unconventional export machinery of FGF-2[J].Proc Natl Acad Sci USA,2006,103(42):15479-15484.
[7] Mao JS,Zhao LG,Yin YJ,et al.Structure and properties of bilayer chitosan-gelatin scaffolds[J].Biomaterials,2003,24 (6):1067-1074.
[8] Marcos GF,Anne JM,Monika H,et al.Silk fibroin/hyaluronan scaffold for human mesenchymal[J].Biomaterials,2009,30(28):5068-5076.
[9] Seidlits SK,Khaing ZZ,Petersen RR,et al.The effects of hyaluronic acid hydrogels with tunable mechanical properties on neural progenitor cell differentiation [J].Biomaterials,2010,31(14):3930-3940.
[10] 刘巨超,赵云山,刘广民,等.肝组织工程支架评价方法研究[J].医疗卫生装备,2009,30(7):12-13,1.
[11] 亚雄,李涤尘,赵倩,等.肝细胞体外培养平台的仿生设计与构建[J].中国生物医学工程学报,2010,29(6):889-893.
[12] 杨照,申少波,刘文晶,等.蚕丝蛋白和明胶复合组织工程材料的组织相容性研究[J].华南国防医学杂志,2011,25(1):44-47.
[13] 赵倩,刘亚雄,高琨,等.肝组织工程支架的仿生设计与有限元分析[J].西安交通大学学报,2011,45(8):108-112.
[14] 郝星,贺健康,高琨,等.蚕丝蛋白/明胶多孔肝组织支架的制备及性能研究[J].西安交通大学学报,2011,45(11):121-126.
[15] 万涛,刘利.肝组织工程的影响因素[J].中国组织工程研究与临床康复,2007,11(6):1137-1140.
[16] 康玉占,汪艳,高毅.脱细胞化肝脏生物衍生支架的制备及鉴定[J].中国组织工程研究与临床康复,2009,13(8):1505-1508.
[17] Li K,Qu X,Wang Y,et al.Improved performance of primary rat hepatocytes on blended natural polymers[J].Journal of Biomedical Materials Research:Part A,2005,75A (2):268-274.
[18] Liu H,Fan H,Wang Y,et al.The interaction between a combined knitted silk scaffold and microporous silk sponge with human mesenchymal stem cells for ligament tissue engineering[J].Biomaterials,2008,29(6):662-674.
[19] Lu Q,Zhang X,Hu X,et al.Green process to prepare silk fibroin/gelatin biomaterial scaffolds[J].Martomolecular Bioscience,2010,10(3):289-298.
[20] Tiyaboonchai W,Chomchalao P,Pongcharoen S,et al.Preparation and characterization of blended bombyx mori silk fibroin scaffolds[J].Fibers and Polymers,2011,12(3):324-333.

