不同类型树莓果实发育期间主要成分的变化
杨国慧,张 伟,韩德果,谢 娟
(东北农业大学园艺学院,哈尔滨 150030)
树莓为蔷薇科(Rosaceae)悬钩子属(Rubus)多年生半灌木性果树,可分为夏果型和秋果型两个类型。其中秋果型树莓为我国近年新引入的一种栽培类型,和传统上种植的夏果型树莓相比,秋果型树莓只利用其1年生枝条结果,在越冬前可将枝条剪除,只保留基部2、3个芽,不需埋土,可减少病虫害发生,因而此栽培类型在生产中受到关注。
果实品质性状一直是果树研究的重点,而果实生长发育对果实品质形成起关键作用。目前,对树莓果实成分分析主要集中在成熟果实上,除对常规成分糖、酸、维生素进行测试外,国外对和果实成熟相关的细胞壁成分进行分析[1-3],国内对一些具有保健作用的功效成分,如蛋白质、氨基酸、鞣花酸、花青素、水杨酸等进行研究[4-5],对树莓果实的香气成分进行研究[6-8]。而对于树莓果实发育期间主要成分的动态变化尚未见研究报道。本研究采用夏果型和秋果型两种不同类型树莓,通过对其在果实不同生长发育期间主要成分研究,以期了解树莓果实生长发育的动态变化,为制订科学的栽培管理措施提供指导依据。
1 材料与方法
1.1 材料
果实采自于黑龙江龙源工贸集团尚志试验基地,采样日期为2010年6~10月,品种为夏果型树莓“费尔杜德”(Fertod Zamatos)和秋果型树莓“哈瑞太兹”(Heritage),株龄均为5年生。选取同1 d开放的花朵挂标牌标记,“费尔杜德”标记时间为6月19日,“哈瑞太兹”标记时间为8月9日,分别于花后7、14、21、28、30、32和34 d采集果实用冰壶带回实验室进行测定,于-20℃保存。各期采集果实的状态分别为:果小绿色、膨大绿色、绿白黄相间、少量着红、大部分着红、成熟、过熟。
1.2 方法
可溶性总糖测定采用蒽酮比色法;还原性糖测定采用斐林试剂比色法;可滴定酸测定采用酸碱中和法;果胶含量测定采用咔唑比色法[9];淀粉含量测定参照碘显色法;纤维素含量测定采用蒽酮比色法[10]。
1.3 数据分析
采用SPSS16.0与Excel处理数据。
2 结果与分析
2.1 可溶性总糖与还原性糖含量的变化
由图1可知,随着果实的生长发育,费尔杜德和哈瑞太兹的可溶性总糖含量呈上升趋势,在花后7~21 d(果实从青色转为黄白色)可溶性糖增长相对缓慢,日增量分别是0.12%和0.27%;花后21~32 d(果实绿黄白相间到成熟)可溶性糖增长较快,日增量分别是0.36%和0.53%。由图2可知,两品种的还原性糖含量随果实生长发育也表现上升趋势,在花后32 d达到最大值,过熟时略有下降。
2.2 可滴定酸含量的变化
费尔杜德和哈瑞太兹果实总酸含量变化趋势一致,均先增加,于花后28 d达到最高值,从花后28 d(即果实开始着红)到果实成熟,含酸量显著降低,总酸含量分别由1.96%降低到1.29%、1.84%降低到1.07%,日减少量分别为0.10%和0.13%。

图1 果实发育期间可溶性糖含量的变化Fig.1 Changes of soluble sugar content during fruit development
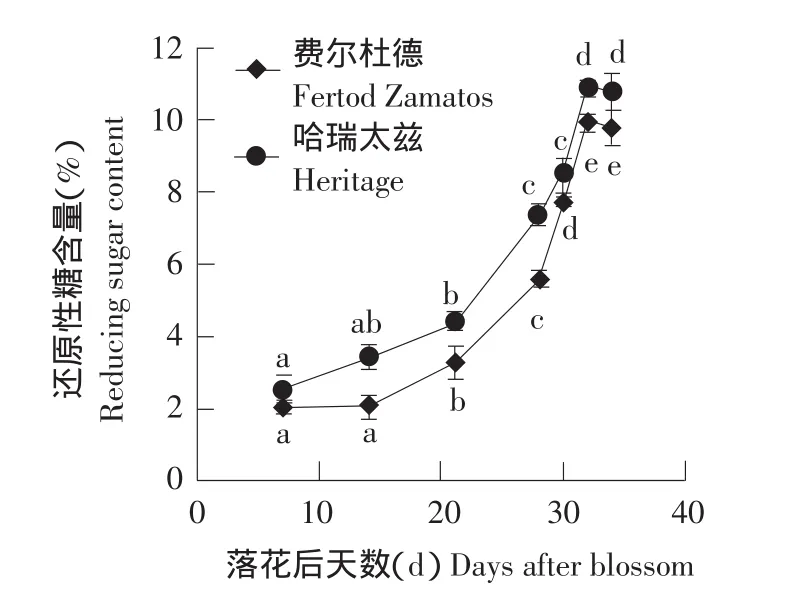
图2 果实发育期间还原性糖含量变化Fig.2 Change of reducing sugar content during fruit development

图3 果实发育期间可滴定酸含量变化Fig.3 Changes of titrable acidity content during fruit development
2.3 糖酸比的变化
费尔杜德和哈瑞太兹的糖酸比在花后7~28 d(果小绿色到少量着红)均表现为下降,花后28 d分别达到3.35和5.20,花后34 d(过熟期)则达到最大值,分别为7.57和12.19。

图4 果实发育期间糖酸比的变化Fig.4 Changes of sugar acid ratio during fruit development
2.4 原果胶含量的变化
由图5可知,费尔杜德和哈瑞太兹的原果胶含量在落花后7~21 d(果小绿色到绿白黄相间)显著增加,21 d分别达到最高值6.98和6.45 mg·g-1FW;然后开始下降,在花后34 d(过熟期)达到最低值,分别下降到3.30和2.58 mg·g-1FW。

图5 果实发育期间原果胶含量的变化Fig.5 Changes of protopectin content during fruit development
2.5 可溶性果胶含量的变化
由图6可知,在果实生长发育期间,费尔杜德和哈瑞太兹的可溶性果胶均一直表现为上升趋势,在花后21 d前,上升相对缓慢,从花后28 d显著上升,到过熟期达到最大值。

图6 果实发育期间可溶性果胶含量的变化Fig.6 Changes of soluble pectin content during fruit development
2.6 淀粉含量的变化
由图7可知,费尔杜德和哈瑞太兹的淀粉含量在花后7~14 d(果小绿色到绿白黄相间)迅速增加,14 d时达到最高值,分别为2.49和2.72 mg·g-1。之后逐渐下降,在果实成熟时,没有检测到淀粉。

图7 果实发育期间淀粉含量的变化Fig.7 Changes of starch content during fruit development
2.7 纤维素含量的变化
由图8可知,在果实生长发育期间两品种纤维素含量均表现为下降趋势,在花后7~14 d(果小绿色到绿白黄相间)哈瑞太兹的下降速度较费尔杜德快,而花后14~30 d费尔杜德比哈瑞太兹下降速度快。哈瑞太兹花后28~30 d(少量着红到大部分着红)下降不明显,而费尔杜德花后32~34 d(成熟到过熟)下降不显著。

图8 果实发育期间可溶性糖含量的变化Fig.8 Changes of cellulose content during fruit development
3 讨论
树莓果实属于聚合小核果,从落花坐果后到果实成熟一般需要30 d时间。在果实生长发育前期,即从绿色到出现黄白色期间(座果后到花后21 d),果实主要进行膨大生长,果实硬度较大,味道酸;在果实生长发育中后期,即从绿黄白相间到全部着红(花后21 d到花后32 d),果实除继续膨大外,硬度显著下降,果实开始着红,逐渐变甜,一直达到可采成熟期,果实变得柔软多汁。可采成熟期后,果实转为深红色,硬度更小,这时为过熟状态。
果实中糖含量和种类对于果实品质有很大影响。试验表明,夏果型树莓费尔杜德和秋果型树莓哈瑞太兹果实中的可溶性总糖含量在花后7~21 d平稳缓慢上升,在花后21 d到果实成熟上升幅度较大。这与许晖对甜樱桃的研究结果[11]基本一致,甜樱桃果实在幼果期可溶性总糖含量较低,从硬核期后可溶性总糖的含量迅速增高[11]。而赵树堂、于希志、王永章对杏、李和苹果的研究结果则是在果实的硬核前期总糖含量稍高,硬核期下降至最低,在第二个迅速生长期时果实糖含量急剧增加,他们认为果实糖分的积累主要是在果肉生长成熟期完成[12-14]。虽然本试验与以上研究结果不完全一致,但是得出一个共同的结论是糖分在果实发育后期积累速度较快。根据树莓果实成熟过程中可溶性总糖和还原糖含量的变化,可以看出树莓果实成熟时积累的主要是还原糖,也就是葡萄糖和果糖。
果实中有机酸含量对于果实风味和品质有显著影响,糖酸比是决定果实品质最主要指标之一。试验中树莓两品种总酸含量变化趋势是先持续上升,花后28 d达到最高,之后显著降低,这一变化趋势与狗枣猕猴桃、苹果果实的研究结果相似[15-16]。秋果型“哈瑞太兹”的含糖量和糖酸比高于夏果型“费尔杜德”。原因可能是由于“哈瑞太兹”果实在9月份成熟,较大的昼夜温差有利于糖分积累所造成,也可能与品种遗传特性有关。
构成细胞壁的主要成分是纤维素、半纤维素、果胶。在细胞壁酶的作用下中胶层和细胞壁构成物进行水解,结果导致细胞壁结构的变化。这也是果实软化的主要原因。随着果实成熟,已经在很多树种的果实发育中证实原果胶含量减少、可溶性果胶含量增加、淀粉含量减少的趋势,而报道关于半纤维素、纤维素的变化趋势存在较大差异[17-20]。对树莓而言,纤维素含量一直呈下降趋势,在花后14 d淀粉上升到最高值,随后也逐渐减少。原果胶含量在花后7~21 d呈上升趋势,花后21 d时达到最高,然后逐渐下降。而可溶性果胶含量随着果实发育一直呈现上升趋势。果胶是构成细胞初生壁和中胶层的主要物质,果实未成熟之前主要是以不溶态的原果胶形式存在,随着果实不断成熟,原果胶逐渐降解为可溶性果胶,淀粉和纤维素含量逐渐下降,果实硬度下降。为了深入探索树莓果实成熟软化的原因进而提高品种硬度,应进一步研究果实发育过程中相关生理指标的变化和超微结构变化,以及二者的对应关系,找出影响果实软化的关键因素。也可从分子生物学角度来探讨,利用转基因技术手段来提高树莓果实的硬度。
[1]Perkins-Veazie P,Nonnecke G.Physiological changes during ripening of raspberry fruit[J].HortScience,1992,27(6):331-333.
[2]Stewart D,Peitro P M,Davies H V.Ripening-related changes in raspberry cell wall composition and structure[J].Phytochemistry,2001,56(5):423-428.
[3]杜鹏飞,杨国慧.树莓果实维生素C含量测定方法的研究[J].东北农业大学学报,2009,40(2):31-33.
[4]杨锉珍,景询.树莓营养成分及果汁加工适应性研究[J].中国果树,1992(1):10-13.
[5]王文芝.树莓果实营养成分初报[J].西北园艺,2001(2):13-14.
[6]郭琳,于泽源,李兴国.几种小浆果挥发性成分研究概述[J].园艺学报,2008(4):611-617.
[7]高玉李,辛秀兰.树莓功能性成分及提取方法的研究进展[J].食品工业科技,2011(7):451-454.
[8]张运涛.树莓和蓝莓香味挥发物的构成及其影响因素[J].植物生理学通讯,2003,39(4):377-379.
[9]韩雅珊.食品化学实验指导[M].北京:中国农业大学出版社,1992:122-123.
[10]郝再彬.植物生理实验技术[M].哈尔滨:哈尔滨工业大学出版社,2004:56-118.
[11]许晖,王飞,郝文红.甜樱桃果实发育及其营养成分的变化[J].果树科学,1992,9(4):228-230.
[12]赵树堂.李果实发育过程中糖、维生素C及矿质元素含量变化[D].保定:河北农业大学,2003.
[13]于希志,金锡风.核果类果实营养成分测定及相关分析[J].落叶果树,1992(4):22-25.
[14]王永章,章大鸱.乙烯对成熟期新红星苹果果实碳水化合物代谢的调控[J].园艺学报,2000,27(6):391-395.
[15]苍晶,王学东,桂明株,等.狗枣猕猴桃果实生长发育的研究[J].果树学报,2001(2):87-90.
[16]申曙光.红富士苹果果实发育期间生理生化变化的研究[J].果树科学,1991,8(l):l-8.
[17]杨德兴,戴京晶,庞向宇,等.猕猴桃衰老过程中PG、果胶质和细胞壁超微结构的变化[J].园艺学报,1993,20(4):341-345.
[18]王军虹,闰丽梅,刘武林.大香水梨成熟过程生理生化反应[J].北方园艺,1998(6):24-25.
[19]周萍,郭荣,张自萍.枸杞果实发育过程中营养成分的变化规律及其影响因素研究进展[J].农业科学研究,2007,28(3):59-62.

