水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响
吴建慧,郭瑶,崔艳桃
(东北林业大学园林学院,黑龙江哈尔滨150040)
水分胁迫对绢毛委陵菜叶绿体超微结构及光合生理因子的影响
吴建慧,郭瑶,崔艳桃
(东北林业大学园林学院,黑龙江哈尔滨150040)
以绢毛委陵菜(Potentillasericea)为材料,通过盆栽试验进行水分胁迫处理并分析幼苗叶片超微结构与净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、水分利用率(WUE)的关系。结果表明,未胁迫的叶肉细胞结构完整。叶绿体基粒片层结构清晰,基粒数目多且排列整齐,基粒类囊体排列致密,类囊体片层叠垛整齐。叶绿体嗜锇程度低,嗜锇颗粒少,且体积小;随着自然失水胁迫程度的加强,叶绿体基粒和膜结构断裂,片层排列紊乱,基粒垛叠程度下降;线粒体双膜结构膨大或破裂,内含物流出,嵴减少。光合作用与叶绿体的结构变化相关,随着土壤逐步干旱和叶绿体受损程度的加重,Pn、Tr、WUE有所下降。表明在干旱胁迫下绢毛委陵菜通过改变叶绿体结构和光合生理因子来提高抗旱性。
绢毛委陵菜;水分胁迫;叶绿体;光合生理因子
绢毛委陵菜(Potentillasericea)是蔷薇科委陵菜属多年生草本植物,抗逆性较强,对温度、水分、养分及光照等条件的适应范围很宽,能适应北方寒冷、干旱的气候环境,有良好的涵养水源、保持水土及护坡作用,耐阴性较强;并且具有花色艳丽、花期较长、株型低矮、绿色期长等特点,是一种良好的早春及初夏时节的观花地被植物,可以丰富北方城市的园林绿化素材。随着经济的发展和人民生活水平的提高,人们对周围环境和绿化的关注度日益提高,城市及小区绿化率越来越高,耐阴性强的材料可广泛用于小区、公园、绿地等景观设计中楼宇旁、林下、树荫下等荫蔽地[1]。目前对委陵菜属植物的研究主要集中在资源开发利用、药用和观赏价值、引种驯化工作及花粉、叶表皮形态等方面[2-5],生理方面特别是干旱胁迫的研究极少。本研究通过对水分胁迫后绢毛委陵菜叶片超微结构及光合作用的变化情况进行分析,进一步了解其对干旱环境的适应机理,以期为干旱地区的城市绿化提供更多的植物材料。
1 材料与方法
1.1 试验材料 研究对象为绢毛委陵菜一龄幼苗,于2010年6月从黑龙江省植物园移至东北林业大学苗圃中进行培育和繁殖。
1.2 试验处理 2011年6月选取生长一致、发育正常的植株,用盆长35cm、宽20cm、高12cm的盆栽试验对其进行自然失水胁迫,土壤为草炭土(土∶草炭=3∶1)。采用连续控水的方法,试验前对植物进行正常的管理,给予充足的水分,确保植株生长良好。水分胁迫试验设为对照组和处理组。对照组每天正常浇水,使土壤含水量始终保持在35%~40%;处理组连续停水21d,每3d进行一次取样,测定土壤含水量和光合生理因子;叶绿体超微结构观察从处理组胁迫的第6天(土壤含水量为25%~27%:轻度干旱胁迫)、第9天(土壤含水量为15%~17%:中度干旱胁迫)和第18天(土壤含水量为5%~7%:重度干旱胁迫)取样,取样均重复3次。
1.3 试验方法
1.3.1 叶片超显微结构样品的制备 取对照组和处理组相同部位的叶片,切取叶片中脉附近部位,取材大小为1mm×1mm的方块,在3%戊二醛中固定24h以上,磷酸缓冲液漂洗3次,每次15~20min,再用1%锇酸在4℃温度下固定4h,去离子水漂洗3次,每次20min;再用乙醇脱水后在丙酮中过渡,之后用环氧树脂812进行渗透与包埋。LKB-5型超薄切片机切片;醋酸双氧铀和柠檬酸铅双染;采用H7650型透射电镜观察并照相。
1.3.2 土壤含水量的测定 分别取对照组和处理组各胁迫梯度的原状土样进行测定。取盆内0~5cm土层的土样10g左右,采用烘干法测定,置于105℃下连续烘干8h,再置于80℃烘24h,按如下公式计算土壤含水量:

1.3.3 光合作用相关生理因子的测定 采用美国LI-Cor公司生产的LI-6400便携式光合仪测定光合数据,测量均在09:00-11:00,天气晴朗无风条件下完成。测定时选取生长良好、大小相近的叶片以自然光为光源进行测定,对照组和处理组各选取4片叶子测定,并做好标记,每片叶子每次测量重复记录5组数据,计算平均值。测定指标包括叶片净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)和水分利用率(WUE)。

1.4 数据处理 数据采用Excel软件进行计算和绘制图表,用SAS 17.0软件进行相关性分析。
2 结果与分析
2.1 土壤含水量在水分胁迫下的变化 随着胁迫天数的增加,处理组土壤含水量呈逐渐下降的趋势。胁迫开始的几天土壤失水较快,从第9天开始,下降的趋势有所减缓,直到胁迫结束,水分几乎完全丧失。对照组土壤含水量始终保持在正常范围内(图1)。
2.2 叶绿体超微结构在水分胁迫下的变化正常状态下绢毛委陵菜叶肉细胞细胞质内细胞器完整,叶绿体呈椭圆形,结构规则,紧贴细胞壁,膜与壁结合紧密。基粒片层和基质片层清晰可见,排列紧密且有序,基质浓厚,贮藏有淀粉粒,叶绿体嗜锇程度低,嗜锇颗粒少,且体积小(图2-Ⅰ)。胁迫第6天(土壤含水量为25%~27%)时,细胞壁稍厚,叶绿体的类囊体片层膨胀,片层扭曲不明显,有局部膜和片层结构变模糊,叶绿体体积增大,部分移向细胞中央,绝大多数仍靠细胞壁,但与细胞壁的相邻面积有所减少,叶绿体中嗜锇颗粒小(图2-Ⅱ)。胁迫第9天(土壤含水量为15%~17%)时,叶片细胞出现质壁分离,内膜清楚,外膜模糊,细胞壁厚度增加;叶绿体嗜锇程度增高,嗜锇颗粒增多,体积增大;基粒片层膨胀、溶解或空泡化、破裂、基粒垛叠程度下降(图2-Ⅲ)。胁迫第18天(土壤含水量为5%~7%)时,叶绿体的被膜破裂甚至完全解体,内含物外流,仅剩排列紊乱的片层结构;类囊体膜互相粘连,基粒类囊体部分没有,部分小且模糊,基质片层大部分溶解,嗜锇颗粒膨大,叶绿体细胞甚至解体(图2-Ⅳ)。
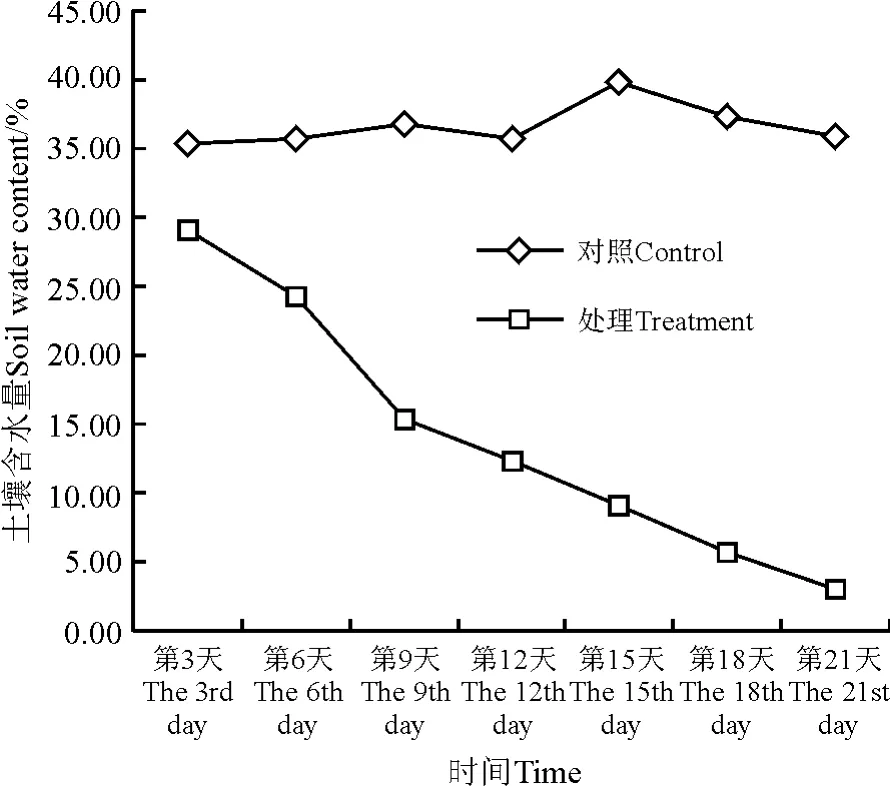
图1 不同水分条件下土壤含水量的变化Fig.1 Change on water content of soil under water stress
2.3 叶片净光合速率、蒸腾速率在水分胁迫下的变化 对照组的光合速率一直保持在较高的水平,且数值上下波动不大;处理组随着胁迫天数的增加和土壤含水量的下降Pn也呈逐渐下降的趋势(图3)。胁迫第3天,处理组Pn同对照组基本一致,从胁迫第6天开始处理组Pn始终明显低于对照组,且一直呈下降趋势,下降的幅度也大于对照组。在胁迫的第6-9天和第12-15天是下降最明显的时间段,此时正是胁迫梯度由轻度向中度和重度过渡的时期。
随着胁迫时间的延长,胁迫程度的加大,对照组Tr呈先下降再升高后又下降的走势,但始终保持较高的水平,且变化范围不大,变化趋势同光合速率一致;处理组则呈明显的下降趋势,且处理组Tr均低于对照组。处理组在胁迫的第12-15天下降最明显,之后都是缓慢的下降,胁迫第3、6、9、12、15天时Tr分别降至5.04、4.99、3.31、2.86、0.76 μmol·m-2·s-1(图3)。
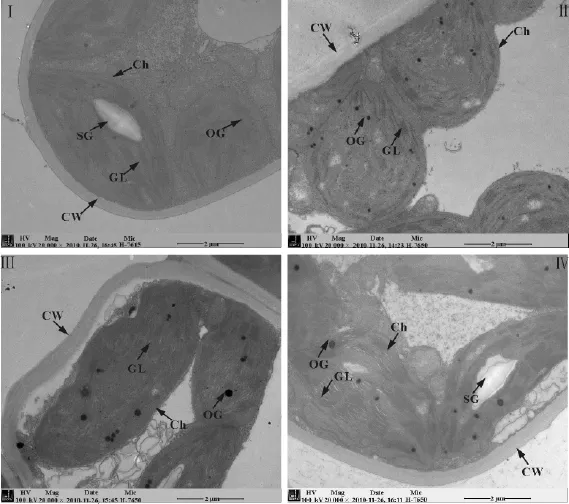
图2 水分胁迫对叶片叶绿体超微结构的影响Fig.2 Effects of water stress on chloroplast in leaf

图3 水分胁迫对叶片净光合速率、蒸腾速率的影响Fig.3 Effects of water stress on net photosynthetic rate and transpiration rate of leaf
2.4 叶片气孔导度、胞间CO2浓度在水分胁迫下的变化 水分胁迫刚开始的几天处理组气孔导度与对照组相差不大,随着胁迫加剧,对照组一直保持较高的水平,从第9天开始(即土壤含水量为15.39%,达到中度胁迫)处理组气孔导度的值开始明显小于对照组,胁迫15d以后处理组气孔导度变化范围最小,而且在胁迫过程中总体上呈下降的趋势(图4)。
在土壤含水量达到12.41%(即胁迫的第12天以前),处理组胞间CO2浓度和对照组差别不大,从第9天开始处理组胞间CO2浓度要高于对照组,从第12天开始两组的差异开始增大,处理组整体呈先下降后上升的趋势(图4)。
2.5 叶片水分利用率在水分胁迫下的变化处理组WUE呈下降趋势,一直持续到胁迫结束(图5)。WUE下降说明Pn下降的幅度要显著大于Tr,水分胁迫会降低绢毛委陵菜叶片的Pn,缺水严重影响绢毛委陵菜正常的能量生产和传递。
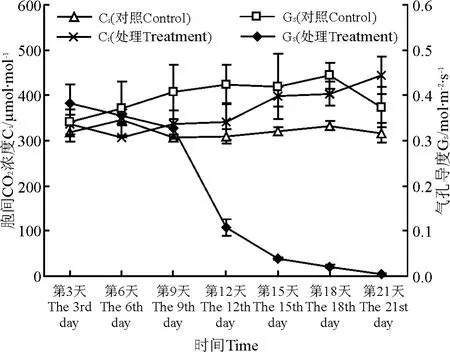
图4 水分胁迫对叶片气孔导度、叶片胞间CO2浓度的影响
2.6 光合因子和土壤含水量的相关性分析土壤含水量与Pn、Tr、Ci、Gs和WUE几个光合因子间均有一定的相关性。其中Pn、Tr、Gs和WUE均与土壤含水量呈极显著正相关(P<0.01),而同Ci呈极显著负相关(表1)。说明除了Ci以外,其他各光合因子随着水分胁迫程度的加重均受到显著抑制,水分胁迫严重影响了绢毛委陵菜的光合作用,进而影响植物的正常生长。叶片Pn和Tr与Gs均呈极显著正相关,说明在水分胁迫条件下,叶片蒸腾强弱与Gs同步变化,随着气孔闭合数量的增加植物的蒸腾作用相应的受到了抑制,光合速率也就随之下降。

图5 水分胁迫对叶片水分利用率的影响Fig.5 Effects of water stress on WUE of leaf
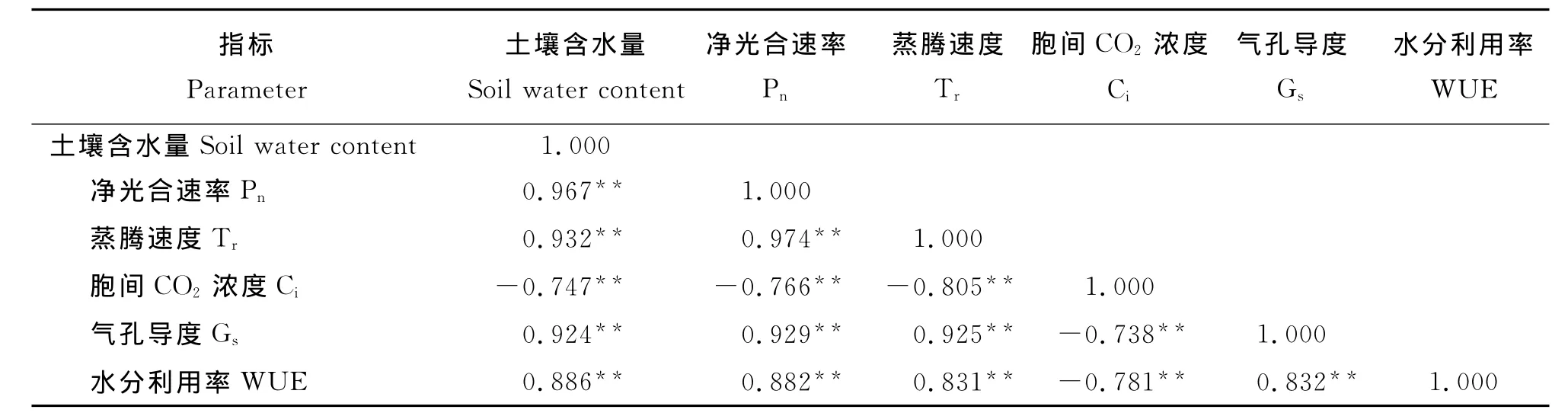
表1 光合指标及土壤含水量间相关性分析Table 1 Correlation analysis between photosynthetic Parameters and soil water content
3 讨论
干旱是影响植物分布、观赏性状和生长发育的主要环境因子之一,其危害程度在诸多非生物胁迫中占首位。随着全球气候变化,干旱频繁发生,水分短缺成为干旱地区限制植物生产力的主要因素[6]。叶片是植物体暴露在环境中面积最大的器官,在复杂的外界环境中反应最为敏感,最容易为适应环境而改变其形态和结构[7-9]。不同植物对干旱具有不同的适应对策,在叶片结构上,主要是向着降低蒸腾、增强储水性和提高光合效率几个方面发展[10]。叶绿体是植物细胞产生活性氧的一个重要细胞器,正常情况下其处于动态平衡状态[11],当叶绿体基粒片层和基质片层受到外界环境胁迫而破坏解体甚至消失时,会抑制光合作用的正常进行。水分胁迫会导致叶绿体光合机构的破坏,引起光合CO2同化效率的降低,使叶片光合速率降低[12]。蒸腾作用和光合作用一样,既受到外界因子的影响,也受植物体内部结构和生理状况的调节[13],而水分利用效率是植物光合与蒸腾特性的综合反映,它是用来说明植物消耗单位质量的水分所固定的CO2的数量[14]。植物的光合性能可以通过光合速率、蒸腾速率、气孔导度、水分利用效率和胞间CO2浓度等衡量[15]。
本研究表明,当植株受到轻度水分胁迫时绢毛委陵菜的叶绿体体积增大,部分移向细胞中央,绝大多数仍靠细胞壁。此时叶绿体受影响程度不大,叶片气孔导度出现了明显的下降,净光合速率、蒸腾速率和胞间CO2浓度也都有所下降,说明在轻度水分胁迫下是气孔的关闭导致CO2进入叶片受阻,从而直接影响植物的光合作用。此时,气孔限制是造成光合下降的主要原因。随着胁迫天数的增加,当植株受到中度胁迫后委陵菜的叶绿体出现嗜锇程度增高,嗜锇颗粒增多,体积增大,叶绿体受到了较大程度的影响;达到重度胁迫后叶绿体的被膜破裂甚至完全解体,内含物外流,基质片层大部分溶解,嗜锇颗粒膨大,叶绿体细胞甚至解体,细胞趋向于死亡,是不可逆的伤害。在中度和重度胁迫下叶绿体超微结构受到了较大程度的影响,尤其是在重度胁迫下叶绿体超微结构受到了不可恢复的破坏,叶片的气孔导度、净光合速率和蒸腾速率依然呈下降的趋势,但胞间CO2浓度却开始升高,说明此时光合作用的下降是由非气孔因素造成的,而不再是由气孔关闭引起的。气孔限制并不是影响光合作用的唯一因素,水分胁迫抑制植物光合作用包括气孔限制和非气孔限制两个方面,随着水分胁迫程度的加剧,光合速率下降有一个从气孔限制向叶肉细胞光合活性限制转变的过程,也就是向非气孔因素转变的过程,表现为光合器官活性的下降[16],即中度和重度胁迫下叶绿体超微结构的变化。
综上所述,水分胁迫直接影响委陵菜的光合能力,随着胁迫时间的延长和胁迫程度的加重,叶片的净光合速率、蒸腾速率、气孔导度和水分利用率都逐渐下降,胞间CO2浓度逐渐升高,说明水分胁迫对光合因子有显著的影响。表明在干旱胁迫下绢毛委陵菜通过改变叶绿体结构和光合生理因子来提高抗旱性。
[1]高鹤,宗俊勤,陈静波,等.7种优良观赏草光合生理日变化及光响应特征研究[J].草业学报,2010,19(4):87-93.
[2]卞勇,吕冬霞,张玉泉等.扁蓄和叉叶委陵菜的草坪利用研究[J].草业科学,2004,21(7):66-68.
[3]张彦芬,吴学明.青藏高原东北部鹅绒委陵菜资源及开发利用前景的研究[J].西北农业学报,2006,15(3):193-200.
[4]尤凤丽,梁彦涛,曲丽娜,等.大庆地区委陵菜属植物花粉形态研究[J].中国农学通报,2010,26(16):337-340.
[5]田丽,周新宗,孙航,等.7种委陵菜属植物叶表皮微形态的研究[J].草业科学,2009,26(2):53-56.
[6]Klich M G.Leaf variation inElaeagnusangustifoliarelated to environmental heterogeneity[J].Environmental and Experimental Botany,2000,44:171-183.
[7]Castro-Diez P,Puyravaud J P,Cornelissen J H C.Leaf structure and anatomy as related to leaf mass per area variation in seedlings of a wide range of woody plant species and types[J].Oecologia,2000,124:476-486.
[8]England J R,Attiwil P M.Changes in leaf morphology and anatomy with tree age and heigh in the species,EucalypturegnansF.Muell[J].Trees Structure and Function,2006,20:79-90.
[9]Kocsis M,Darok J,Borhidi A.Comparative leaf anatomy and morphology of some neotropical Rondeletia(Rubiaceae)species[J].Plant Systematics and Evolution,2004,248:205-218.
[10]郑国琦,张磊,郑国保,等.不同灌水量对干旱区枸杞叶片结构、光合生理参数和产量的影响[J].应用生态学报,2010,21(11):2806-2813.
[11]Asada K.The water cycle in chloroplasts:scavenging of active oxygen and dissipation of excess photons[J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50:601-639.
[12]郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):643-649.
[13]高松,苏培玺,严巧娣,等.C4荒漠植物猪毛菜与木本猪毛菜的叶片解剖结构及光合生理特征[J].植物生态学报,2009,33(2):347-354.
[14]廖行,王百田,武晶,等.不同水分条件下核桃蒸腾速率与光合速率的研究[J].水土保持研究,2007,14(4):30-34.
[15]杨秀芳,玉柱,徐妙云,等.2种不同类型的尖叶胡枝子光合-光响应特性研究[J].草业科学,2009,26(7):61-65.
[16]姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制[J].热带农业科学,2005(4):80-85.
Effects of water stress on ultrastructure and photosynthetic physiological factors of Potentilla sericea
WU Jian-hui,GUO Yao,CUI Yan-tao
(The College of Landscape,Northeast Forestry University,Harbin 150040,China)
The leaf ultrastructure ofPotentillasericeaunder water stress was investigated by transmission electron microscopy.The leaf photosynthetic rate(Pn),transpiration rate(Tr),stomata conductance(Gs),intercellular CO2concentration and water use efficiency(WUE)were measured by portable photosynthesis system(LI-6400).The results showed that the leaf ultrastructure was complete under control. Grana lamellaes of chloroplasts were distinct.The number of granas was abundant and the structure was compact.The thylakoids were compact and the grana stacks of thylakoids were regular.The chloroplasts showed lowly osmiophilic.There were few and small osmiophilic grain in the chloroplasts.With the intensive of drought stress,the grana and envelope damaged,the lamella swelled or dissolved and the grana stacks of thylakoids were disorder.Mitochondrial doublemembranes swelled or rived and its inclusion effused.The net photosynthetic rate was closely related to the change in chloroplast structure.The Pn,Trand WUE of leaf decrease with the declining of soil water content and the damage of chloroplast.
Potentillasericea;water stress;chloroplast;photosynthetic physiological factors
WU Jian-hui E-mail:wujianhui20002002@yahoo.com.cn
S688.4;Q945.11
A
1001-0629(2012)03-0434-06
2011-09-18 接受日期:2011-11-16
黑龙江省自然科学基金(41308602)
吴建慧(1966-),女,黑龙江哈尔滨人,副教授,博士,主要从事植物生理与分子生物学研究。E-mail:wujianhui20002002@yahoo.com.cn

