肝门阻断再灌注致脑皮层血管内皮损伤中TNF-α和IL-10的变化
黄风怡 郑晓春 李荣钢 涂文劭
单一肝缺血再灌注(IR)可致脑损害[1],临床肝移植中也见术后血清S100β蛋白升高,提示血脑屏障(BBB)通透性发生改变[2]。肝门阻断(Hepatic Protal Occlussion,HPO)再灌注损伤包含肝脏IR损伤和肠道淤血再灌注损伤,后者再灌注后血流恢复较缺血损伤更加缓慢。HPO对脑皮层血管内皮和血脑屏障(BBB)的影响未见报道。本研究观察HPO再灌注后血脑屏障的损害并探讨机制。
1 资料与方法
1.1 实验材料 健康雄性wistar大鼠,体重200~250 g,由福建医学科学研究院实验动物中心提供。室温20℃ ~27℃,湿度40% ~60%,白天黑夜各12 h。全部动物均接受异氟烷(Isoflurane)持续吸入麻醉。尾静脉穿刺置入24 g套管针并固定,连接三通后输液,微量注射泵输入乳酸林格氏液10 ml/(kg·h)。肝素500U/kg以0.9%生理盐水稀释成1 ml缓慢静脉注射,注射时间不小于5 min。仰卧位固定四肢,灯照加温,Datex多功能监测仪(芬兰)半导体温度传感器监测直肠温度,保持直肠温37℃ ~38℃。RBP-1B型大鼠血压计(北京)监测尾动脉非创血压。伊文思蓝(Evans Blue,EB)为SIGMA公司产品,进口分装,取2 g溶于100 ml大鼠血浆中,临用前预热至36℃。其他试剂均为国产分析纯。
1.2 模型的制备 肝门阻断模型:常规备皮消毒后取腹部正中切口入腹,离断肝周韧带以消除肝脏侧支循环,以Pringle'法用无损伤小动脉夹于肝十二指肠韧带处完全阻断门脉、肝动脉及胆总管,使全肝缺血,暂时关腹。30 min后原路入腹松开血管夹恢复肝血供。观察肝及肠管血供复流良好后关腹。肝门阻断期间监测血压,必要时乳酸林格液扩容保持MAP不低于60 mm Hg。术毕关腹前腹腔内注入含青霉素20万U的温生理盐水1 ml。腹壁皮肤缝合后停止麻醉,保温至苏醒后归笼饲养。术后自主饮用100 g/L葡萄糖水,至预定时间点取材。术中失血量超过2 ml者弃用。
1.3 实验分组和标本取材 所有实验对象随机分成:①假手术组(Sham组):n=16,经腹正中切口入腹,切断全部肝周韧带,不作肝血流的阻断,缝合腹腔。6 h后处死取材。②肝门阻断组(HPO组):n=16,Pringle'法阻断全肝血流,30 min后复流再灌注,缝合腹腔。6 h后处死取材。
每组8例大鼠专门用于伊文氏蓝(EB)脑组织渗透率和组织含水率测定。另外8例供取材:吸入麻醉后开腹,经心尖取血4 ml,静置10 min后4℃3600rpm离心15 min取上清,置于-20℃冰箱保存待测血浆肿瘤坏死因子-α(TNF-α)和白介素-10(IL-10)浓度。取Tris韧带下20 cm处取小肠5 cm,纵向剪开后用0-4℃生理盐水冲洗干净,黏膜朝上在滤纸上展平,待测髓过氧化酶(MPO)活性。然后断头-20℃冰玻上迅速取皮层脑组织,切取小块1 mm3,2.5%戊二醛前固定,4℃保存过夜备电镜检查。最后取脑皮层和肠组织约0.5 g置于10%中性甲醛液中固定过夜。常规取材、脱水、石蜡包埋、HE染色、切片、40倍物镜下观察并摄像待测光镜病理。
1.4 观察指标和检测方法
1.4.1 脑皮层光镜病理及透射电镜下血管内皮超微结构取前处理后的皮层1 mm3在1%锇酸后固定2 h;50%1,70%1酒精梯度脱水;80%1,90%1,100%3丙酮脱水,浸透过夜;环氧树脂812包埋,35℃、45℃、60℃聚合各24 h;瑞典公司LKB-Ⅴ超薄切片机切片;醋酸铀-柠檬酸铅染色;日立HITACHI H-600透射电镜下观察、诊断,摄影。
1.4.2 BBB通透性和脑皮层含水量的测定 每组单列一半大鼠(8例)处死前经尾静脉给与 EB(2 mg/kg,1 min内推完),30 min后用50 ml生理盐水经左心室灌注冲洗血液,经心内注入10%福尔马林15 ml原位固定。取大脑沿冠状切面切开,取位置相同的皮层组织约1 g匀浆后用分光光度计(吸收光谱635nm)检测伊文氏蓝含量。再取脑皮质约200 mg,电子天平精确称重两次取均值后,置于红外线烤箱,110℃恒温烘烤24 h后称干脑重。脑组织含水量=(湿重-干重)/湿重100%。
1.4.3 肠黏膜损伤评价 肠黏膜损伤程度参考Chiu评分法评分[3]:0分:正常黏膜;1分:绒毛顶端上皮下间隙增大;2分:上皮层和固有层中度分离;3分:绒毛两侧有大量分离伴有部分绒毛顶端破损;4分::绒毛破损伴有固有层毛细血管大量暴露;5分:固有层破坏、出血及溃疡。每个动物观察10个视野,评分总和为小肠病理评分。
1.4.4 肠黏膜MPO活性测定 参考Luis[4]采用比色法。试剂盒由南京建成生物有限公司提供,按说明书进行操作。取组织约100 mg,加入5%溴化十六烷基三甲胺(Cetyltrimethylammonium Bromide,CTAB,购自 Sigma 公司)溶液 2 ml,匀浆器匀浆,超声粉碎亚细胞成分(50瓦10 s,共5次),于4℃以12000 g离心20 min。取上清0.1 ml加0.167 g/L邻联茴香胺二盐酸化物(Sigma公司)及0.0005%过氧化氢混合液2.9 ml。保持温度27℃,紫外分光光度计在460nm处记录1 min内吸光度的变化代表酶活力的改变。即用每分钟△OD/g表达MPO活性(27℃)。
1.4.5 血浆TNF-α浓度和IL-10浓度 采用放免法检测,试剂盒由上海放射免疫分析技术研究有限公司提供。取聚苯乙烯试管编号后加入标本血浆,加入分离剂后充分混匀,室温放置20 min,4℃500 g离心25 min,吸弃上清液,在SN-682型放射免疫γ计数器(上海核福光电仪器有限公司)自动计数,分析程序直接给出有关技术参数、标准曲线及待测样品浓度ng/ml。
1.4.6 血液主要电解质和酸碱值 心尖部取血1 ml送检血气分析(M3562A,德国 Philips公司),比较[K+]和[Ca2+]差异和酸碱失衡。
2 结果
2.1 脑皮层血管内皮和周围组织学改变 光镜下HPO组再灌注后皮层神经细胞较为稀疏,间质水肿,见血管内皮损伤,周围组织有明显空亮水肿。电镜下:Sham组大致正常。核圆形核仁明显,染色质均匀。HPO组脑组织水肿,胶质细胞变性。血管周围神经突起水肿,崩解;有少数变性线粒体。(见图 1、2)。
2.2 BBB通透性和脑组织含水量变化 和Sham组比较,HPO组脑皮质EB含量和组织含水量均明显增高,分别为(13.11±1.5)ng/mg vs(4.99±0.6)ng/mg以及(82.1±1.9)%vs(78.1±1.2)%,(均P<0.05),提示BBB通透性增加(见图4)。
2.3 肠黏膜损伤 和Sham组比较,HPO组小肠黏膜表面糜烂,炎症渗出,PMN细胞聚集,可见血管内皮损伤,Chiu'评分312±42(P<0.01)。肠黏膜MPO活性:HPO组再灌注后肠MPO活性相对Sham组显著增高(P<0.01)。提示HPO再灌注后肠道组织PMN数量明显增加。(见表1、图3)
2.4 血浆细胞因子TNF-α和IL-10浓度的变化:与Sham组比较,单纯HPO组TNF-α和IL-10浓度升高,其中TNF-α升高明显,均数约为对照组2.75倍(P<0.01),IL-10升高约1.55倍(P<0.05)。(见表1)
表1 两组肠黏膜Chiu'评分、MPO活性、血清 TNF-α、IL-10和[K+]、[Ca2+]的比较(±s)

表1 两组肠黏膜Chiu'评分、MPO活性、血清 TNF-α、IL-10和[K+]、[Ca2+]的比较(±s)
与Sham组比较,*P<0.01,△P<0.05
Group(n=8)肠黏膜Chiu'评分肠黏膜MPO活性(每分钟ΔOD/g)TNF-α]IL-10(ng/ml)pH [K+][Ca2+(mmol/L)Sham 30±11 0.46±0.11 1.2±0.2 17.1±2.7 7.1±0.2 5.5±0.2 1.8±0.1 HPO 312±42* 0.99±0.25△ 3.3±0.1△ 26.5±4.4△6.9±0.1 7.2±1.9 1.1±0.2
2.5 主要电解质和酸碱值 再灌注6 h后HPO组和Sham组pH值7.1±0.2和6.9±0.1;[K+]:7.2±1.9和5.5±0.2(mmol/L);[Ca2+]:1.1±0.2和 1.8±0.1(mmol/L),(均P<0.05)。(见表1)

图1-2 光镜和电镜下两组脑皮层组织和血管内皮比较

图3 光镜下各组肠黏膜组织比较
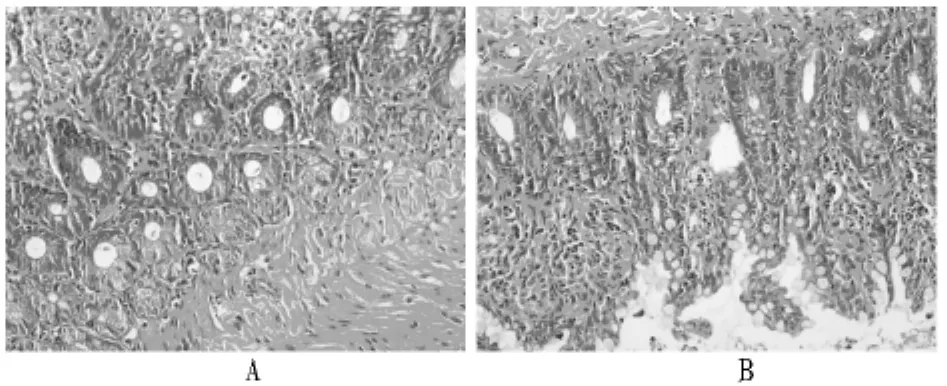
图4 各组脑皮层EB含量和组织含水率的比较
3 讨论
HPO后再灌注损伤的病理生理改变比单一肝和肠的缺血再灌注损伤更为复杂。不但有肝脏IR损伤,而且阻断门静脉后肠道血液回流中断、组织严重淤血,当循环阻力增加到一定程度后动脉血流将完全停止,可有出血和血栓形成,再灌注过程中产生淤血再灌注损伤,淤血组织血流恢复较缺血组织更缓慢和不完全,损伤较缺血性损伤更为严重[5]。这些病理生理基础也是HPO围术期所有病理改变的根源,在原位损害的基础上还可伤及远隔脏器。lexin等[6]发现阻断肝门2 h再灌注后80%大鼠在48 h内死亡,直接原因分别是肺损伤(30%)、心衰(26%)等,死于肝衰竭的仅20%。大脑由于血流和代谢特点可在远程脏器再灌注损伤中受损[7]。实验结果见HPO再灌注后脑皮层出现明显的血管内皮损伤,血管周围组织水肿。BBB完整性的破坏是脑水肿等脑血管疾病发生、发展的重要原因之一。伊文氏蓝(EB)是经典的BBB示踪剂,正常情况下与白蛋白成复合物不能通过BBB,当BBB完整性破坏时可进入脑组织间隙,其渗出量与BBB的破坏程度成正相关,可反映BBB的损伤程度[8]。实验结果提示HPO后出现脑皮层组织EB含量明显升高,均值约为sham组的2.63倍,提示BBB明显。同时也见脑组织含水率轻度增加,有脑水肿倾向。临床肝移植中也见术后血清S100β蛋白升高,提示血脑屏障(BBB)通透性发生改变[2],这种病理变化可能也是临床病例出现术后认知功能障碍的原因之一。
本实验条件下脑皮层和BBB本身没有经历缺血再灌注过程,其损伤的来源是肝门阻断再灌注后肝肠缺血/淤血再灌注的损伤。实验结果见HPO后肠损伤严重,Chui'评分远大于sham组。IR损伤致肠黏膜中中性粒细胞(PMN)被致炎因子激活而在组织内聚集,脱颗粒、释放溶酶体酶,其中弹性蛋白酶对血管和组织有较强的破坏性。过度的炎症反应又可引起PMN呼吸爆发,产生大量的超氧阴离子和过氧化氢能导致组织细胞和血管内皮细胞损伤[9],在再灌注的后期对组织损伤有着明显的放大作用,氧源性损害是重要原因之一[10]。PMN还能产生大量的脂质代谢产物如前列腺素、白三烯、PAF等伤害因子通过血液和循环系统传递到全身脏器,引起脑皮层等远隔脏器的继发损害。因此肠黏膜屏障损害一直被认为是机体全身炎性反应(SIRS)的引擎。髓过氧化物酶(MPO)是PMN嗜天青颗粒中含量较高的酶,每个PMN中所含的MPO相对恒定,所以组织中MPO活性的高低基本上可定量表达组织中PMN的数量。实验结果显示虽然HPO模型中肝门仅阻断30 min,但再灌注6 h后肠黏膜组织中即有MPO活性增加,和病理结果中组织PMN浸润程度符合。Tetik等[11]的研究结果也与此一致。
肠道IR损伤后局部炎性细胞大量释放的细胞因子是引起PMN激活和聚集的主要因素,许多研究已表明和粘附分子(Ams)、TNF-α、血小板活化因子(PAF)、基质金属蛋白酶(MMPs)、紧密连接结构(TJ)以及氧自由基等多种因素[11]有关。在这些细胞因子中TNF-α作用居首位,在受到致病因素作用后,它产生最快、到达高峰时间最早,并且能刺激其他几种促炎因子如IL-1、IL-6、IL-8、PAF等的产生和释放,具有诱导内皮细胞活化、白细胞迁移、粒细胞脱颗粒及抑制纤溶反应、增加微血管通透性、促进血栓形成等广泛的生物学效应,是SIRS形成的重要因素[10]。实验结果中HPO组TNF-α升幅较大,均数为对照组的2.75倍,提示TNF-α在HPO后肠损伤中有重要作用。
TNF-α等促炎因子还能反馈引起内源性抗炎介质(如IL-10)的释放,通过抑制单核巨噬细胞产生促炎因子以达到制衡炎症反应的作用。当IR损伤严重引起大量炎症介质入血(瀑布样释放),而内源性抗炎介质又不足以抵消其作用时,细胞因子由保护作用转变为自身破坏作用,不但损伤肠道局部组织细胞,同时打击远隔器官,最终导致MODS的发生。本研究结果显示HPO组TNF-α升高明显,但IL-10分泌量较小,不足以调节再灌注过程中细胞因子间的平衡,难以抑制PMN在肠道组织中的聚集和炎性因子的致炎伤害。实验中还观察到HPO再灌注后还能引起体循环内高钾血症和酸血症,酸碱失衡和所致的电解质紊乱可能也是造成脑皮层血管内皮损伤的原因之一。研究不足之处是未能将上述几种可能原因分别单列,研究单一因素对脑血管内皮的影响,这也将在进一步的深入研究中进行。
综上所述,HPO后再灌注损伤比单一肝和肠的IR损伤更为复杂,肠淤血再灌注损伤严重,产生和释放致炎因子经过血液和循环伤及远隔脏器,可致脑皮层BBB通透性增加,有脑水肿倾向。
[1]Zdeno Pirnik,Jana Bundzikova,Tomas Francisty,et al.Effect of liver ischemia-reperfusion injury on the activity of neurons in the rat brain.Cell Mol Neurobiol,2009,29(6-7):951-960.
[2]龙波,李妍,陈卫民.肝移植患者血清中S-100β蛋白浓度变化及机制.世界华人消化杂志,2008,16(6):640-644.
[3]ChiL C J,AliceH,Mc,Mdle,et al.Intestinal mueosal lesion in low flow states.Arch Surg,1970,101(5):478.
[4]Luis H,Pereyra T,Shohachi S,et al.Neutrophils cytokines and adhe2 sion molecules in hepatic ischemia and reperfusion injury.J Am CollSurg,1994,179:758-762.
[5]朱春富,刘胜利,徐皓,等.大鼠小肠淤血再灌注损伤的实验研究. 中国血液流变学杂志,2005,15(2):200-203,229.
[6]Lexin Liu,C-H Hakansson,B Jeppsson,et al.Extra-hepatic multiple organ damage following prolonged hepatic inflow interruption:A new experimental finding.Med Sci Res,1994,22:361-364.
[7]Kapinya KJ.Ischemic tolerance in the brain.Acta Physiol Hung,2005,92(1):67-92.
[8]Carrera RM,Pacheco AM Jr,Mastroti RA.Qualitative evaluation of the blood-brain barrier after the use of hypertonic saline solution in young rats.Eur Surg Res,2001,33(5-6):311.
[9]Gasche Y,Copin JC.Blood-brain barrier pathophysiology and ischaemic brain oedema.Ann Fr Anesth Reanim,2003,22(4):312-319.
[10]郑晓春,陈彦青,吴晓丹,等.肢体缺血预处理对大鼠肝脏缺血再灌注所致心肌损伤的影响.中华麻醉学杂志,2008,28(7):654-657.
[11]Tetik C,Ozden A,Calli N,et al.Cytoprotective effect of trimetazidine on 60 minutes of intestinal ischemia reperfusion injury in rats.Transpl Int,1999,12:108-112.

