犬瘟热病毒RT-LAMP检测方法的建立和初步应用
温 海,秦海斌,贺星亮,朱 骞,高一龙,张汇东
(公安部南京警犬研究所分子生物学实验室,南京210012)
犬瘟热病毒RT-LAMP检测方法的建立和初步应用
温 海,秦海斌,贺星亮,朱 骞,高一龙,张汇东
(公安部南京警犬研究所分子生物学实验室,南京210012)
目的 利用环介导等温扩增(LAMP)技术建立一种检测犬瘟热病毒感染的新方法。方法 根据GenBank中NP基因序列,设计4条LAMP特异性引物,对反应条件、特异性、可视化效果和应用效果进行研究。结果 在60℃等温的条件下、1 h内可完成RT-LAMP扩增过程;特异性和可视效果良好;对63份临床标本进行检测,阳性检出率为71.4%(45/63),检出率高于RT-PCR的63.5%(40/63)。结论 建立的RT-LAMP检测方法,显示了较高的特异性和敏感性,而且兼具高效、快捷、可视化的优势,为临床检测犬瘟热病毒感染提供了一种快速简便的新途径。
环介导等温扩增;犬瘟热病毒;检测
犬瘟热(canine distemper disease,CD)是由犬瘟热病毒(canine distemper virus,CDV)引起的一种急性、高度接触性传染病,可引起大批食肉目动物的发病和死亡,死亡率高达30%~80%,其自然宿主包括犬科动物(犬、狼、豺、狐等),鼬科动物(貂、臭鼬、黄鼠狼等),浣熊科动物(浣熊、小熊猫、大熊猫等),还可感染灵长类动物(如日本猕猴等)[1],近年来随着生态环境改变和病毒的进化,CDV自然感染的宿主范围正在不断扩大[2],已经出现人感染 CDV的报道[3]。犬瘟热病毒的常用检测方法包括病毒分离、病理组织包涵体检查、血清学检测、核酸探针、原位杂交、胶体金快速诊断试纸条和RT-PCR等方法[3,4],其中胶体金快速诊断试纸条和 RT-PCR在临床诊断中的应用最为广泛,但是近几年研究表明,试纸条的假阴性和假阳性比例很高、准确性较差,RT-PCR受样本、RNA降解等因素的影响,检出率远未达到理想水平,因此,为适应临床检测对准确性和可操作性的更高要求,我们应用环介导的等温扩增技术(loop-mediated isothermal amplification,LAMP)建立了 CDV的反转录-环介导等温扩增(RT-LAMP)快速诊断方法,进一步提高了对 CDV的检出率、准确性,增强了临床实践中及时、准确地检测犬瘟热病毒的能力。
1 材料和方法
1.1 材料
1.1.1 主要毒株和细胞:CDV-Onderstepoort株,由公安部南京警犬研究所分子生物学实验室保存;63份待检样本(结膜分泌物23份、鼻拭子18份、死亡肺脏15,血清7份),采集自南京和山东地区疑似CDV感染犬或水貂;非洲绿猴肾细胞(Vero)购自中国兽药监察所.
1.1.2 主要试剂:10×ThermoPol反应缓冲液、BstDNA聚合酶(8 U/μL)购自 New England BioLabs公司;5.0mmol/L Betaine购自 Sigma-Aldrich公司;dNTP mixture、AMV 酶(5 U/μL)、TaqDNA 聚合酶、DNA/RNA提取试剂盒均为TaKaRa公司产品。
1.2 引物的设计与合成
根据GenBank中登录的犬瘟热病毒基因序列,用在线软件 PrimerExplorerversion 4(http://primerexplorer.jp/lamp4.0.0/index.html)在 NP 基因保守区域筛选4条RT-LAMP引物(表1),引物由上海皓佳生物技术有限公司合成。
1.3 RT-LAMP检测方法的建立
1.3.1 RNA模板的制备:RNA采用TaKaRa RNA提取试剂盒进行提取,立即进行RT-LAMP反应。
1.3.2 RT-LAMP检测体系:LAMP反应总体积25 μL,内含引物 BIP 和 FIP 各 1 μL(40 pmol)、F3 和B3 各 0.5 μL(10 pmol)、2.5 μL 10× ThermoPol反应缓冲液[200mmol/L Tris-HCI,100mmol/L KCI,20mmol/L MgSO4,100mmol/L(NH4)2SO4,1.0%Tween 20]、4.0 μL 5.0mmol/L Betaine、4.0 μL 2.5mmol/L dNTPs mixture、8 U Bst DNA polymerise、2 μL 模板 RNA;1μL AMV(5 U/μL),0.5 μL RNA 酶抑制剂(40 U/μL),2μL RNA 模板,ddH2O 补足体积到 25 μL。体系在 60℃、63℃ 和 65℃ 孵育 30、45和60 min,孵育反应结束后,再在80℃作用10 min终止反应。根据反应产物的量选择合适的扩增条件。
1.3.2 LAMP特异性鉴定:提取CPIV GN株、CDV GN株和正常 F81细胞培养产物的RNA,于上述选择的适宜循环参数下进行 RT-LAMP扩增,判断其特异性。
1.3.3 LAMP结果可视化效果检测:分别以 CDV GN株和蒸馏水作为阳性和阴性对照,对63份临床样本在最佳LAMP条件下进行检测,以琼脂糖凝胶电泳结果为参照,观察SYBR green I染色的可视化效果。琼脂糖凝胶电泳:10 μL LAMP产物,以1.5%浓度的琼脂糖凝胶电泳,成像、观察。SYBR green I染色:按照1∶100的比例向 LAMP反应管中加入 SYBR green I,静置观察。
1.4 与RT-PCR诊断方法的比较和应用
对63份临床送检的不同种类的病料应用RTLAMP、RT-PCR[5]方法进行检测,比较两者的符合率和检出率的高低,初步判定RT-LAMP方法临床使用效果。
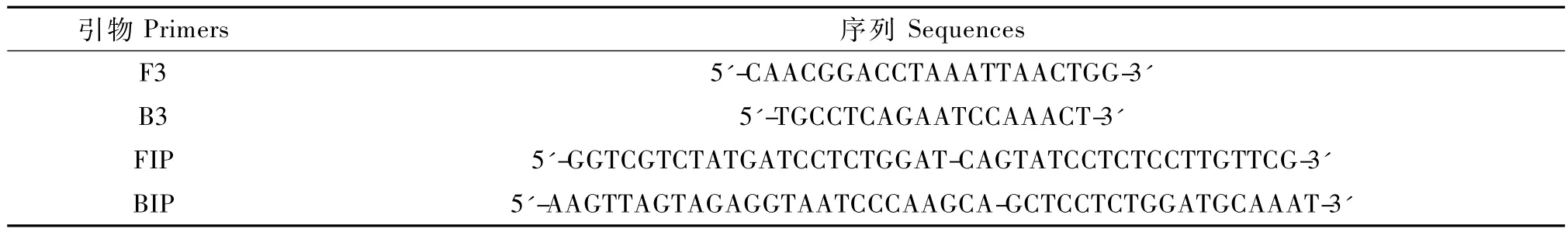
表1 RT-LAMP引物序列Tab.1 Sequence of each primer for CDV RT-LAMP
2 结果
2.1 RT-LAMP检测方法的建立
以CDV GN株DNA为模板,分别以60℃、63℃和65℃反应60 min,1.5%琼脂糖凝胶电泳,显示在60℃时该实验的条带清晰、分辨率较高(图1)。在60℃,分别反应30 min、45 min和60 min,以1.5%琼脂糖凝胶电泳,表明在45 min、60 min即可实现扩增,本实验选择60 min以提高反应的灵敏度(图2)。

图1 CDV GN株的RT-LAMP反应在不同温度的扩增结果M.DNA 标准 DL 2 000;1.65℃;2.63℃;3.60℃ .Fig.1 RT-LAMP products amplified at different temperaturesM.DNA marker DL2000;1.65℃;2.63℃;3.60℃.
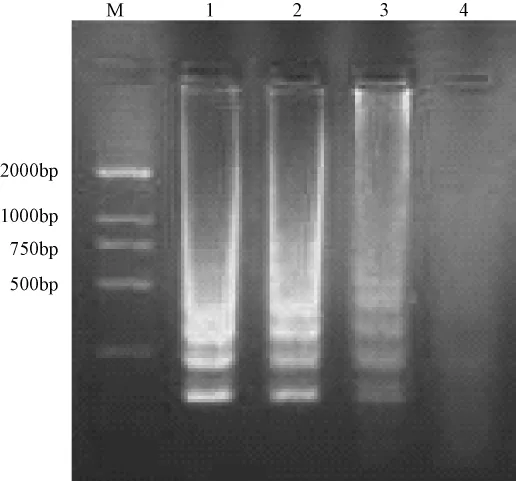
图2 CDV GN株的RT-LAMP反应在不同时间的扩增结果M.DNA标准 DL2000;1.60min;2.45min;3.30min;4.阴性对照Fig.2 RT-LAMP products amplified at different time pointsM.DNA marker DL2000;1.60 min;2.45 min;3.30 min;4.Negative control
2.2 RT-LAMP反应特异性试验
分别以CDV GN株、CPIV GN株和蒸馏水对照DNA为模板,在60℃反应60 min,产物以1.5%琼脂糖凝胶电泳,CDV对照的阳性条带明显,CPIV GN株和蒸馏水对照均未出现准确条带,表明RT-LAMP反应特异 (图3)
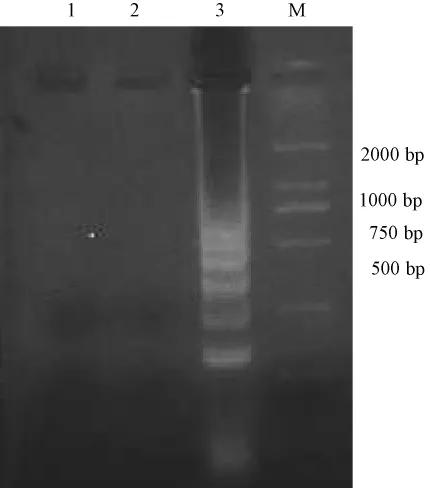
图3 CDV RT-LAMP反应的特异性扩增结果M.DNA标准DL2000;1.阴性对照;2.CPIV GN株;3.CDV GN株.M.DNA标准 DL2000;Fig.3 RT-LAMP specific amplified products of CDV1.negative control;2.CPIV GN strain;3.CDV GN strain
2.3 RT-LAMP方法的可视化效果
LAMP反应结束后在产物内加入1∶100稀释的SYBR Green I,肉眼可见CDV RT-LAMP反应阳性管颜色变绿,而阴性对照管颜色仍为橙黄色,颜色变化明显。对63份临床样本进行检测,SYBR Green I染色判定的阳性检出率和阴性检出率与电泳法相比符合率均为100%,可视化判定操作简单、效果良好。此方法可作为RT-LAMP方法现场检测的判定标准,不必经过电泳、凝胶成像等繁琐的步骤和仪器。
2.4 RT-LAMP方法的应用结果
对63份疑似CDV感染的病料进行RT-PCR和RT-LAMP检测,RT-PCR总体检出率为(40/63)63.5%,RT-LAMP方法的阳性检出率为(45/63)71.4%;其中,对23份结膜拭子和7份血清样品,两种方法的检测结果完全相同,18份肺脏样品 RTPCR检测出8份阳性,RT-LAMP方法检测出12份阳性,15份鼻拭子中RT-PCR检测出7份阳性,RTLAMP方法检测出8份阳性。说明 RT-LAMP方法的检出率更高,不易出现假阴性结果(表2)。

表2 CDV RT-LAMP方法和RT-PCR方法的应用比较Tab.2 Comparison between RT-LAMP and RT-PCR in clinical diagnosis
3 讨论
近年来,CDV的自然感染宿主已由传统的犬科(Canidae family)、鼬科(Mustelidae family)及浣熊科(Procyonidae family)扩展到了食肉目(Carnivora oder)所有8个科及偶蹄目猪科(Suidae family)、灵长目猕猴属(Macaca Lacepede)和鳍足目海豹科(Phocidae family)等多种动物,并且免疫动物爆发犬瘟热的病例在世界多个国家和地区都有报道。这些日趋复杂的临床症状给CDV的诊断带来一定难度。仅根据流行病学、临床症状、包涵体检查和病毒分离等常规方法很难确诊CDV感染。因此国内外许多学者建立了 RT-PCR、巢式 PCR、套式 PCR、原位杂交、原位杂交与RT-PCR结合等多种分子生物学检测方法,但是对于CDV而言,不同种类、不同病理阶段的检测材料对检测结果的影响存在在很大差异,上述各种检测方法在应用中均有其不足之处。Doo KIM等应用RT-PCR方法对人工感染犬在不同病理时期采集的样本进行了检测效果的评价,证实不同时期采集的外周血、结膜拭子、鼻拭子、尿液的检出率差别很大,在攻毒后连续采样20 d中,前2 d采集的鼻拭子和外周血中检测不到CDV,前5 d内采集的尿液中检测不出CDV,而结膜拭子从第1天到第20天均能达到100%的检出率(7/7),证实了采样部位和采样时机对RT-PCR结果的重要影响[6]。Frisk等基于 NP基因设计了 3对不同引物,研究不同引物对的检出率的影响,在29个病毒阳性病例中,三对引物的检出率分别为82%、53%、41%,分析认为RT-PCR的敏感性受到所选引物的影响,取决于扩增片段的位置,而且由于病程和发病类型的不同病毒的分布会有很大差异,同样会影响检测结果。因此,在一个病例中选择多种样本(血清、外周血、鼻拭子、脑脊髓液)或者采取不同时间的多个样本同时进行检测能够显著提高检测的准确性[7]。
无论是检材种类的不同、采样时间的差别、还是RNA降解的影响,犬瘟热病毒检测时存在假阴性的一个重要原因,是受到检测方法本身灵敏度的限制,导致当病毒(或其RNA)低于某个限量的时不能检出。要进一步提高CDV的检测准确性,就必需采用具备更高灵敏度核酸检测技术。环介导的等温扩增技术(loop-mediated isothermal amplification,LAMP)是近些年开发的一种简单、迅速、特异且具成本效益的新的核酸扩增技术[8],它利用4条不同引物识别6个不同区域的靶基因,在恒温条件(约60~65)0C能够通过一步反应在15 min~60 min内将DNA扩增109~1010倍,其灵敏度被证明是常规PCR 的 10-100 倍[9-12]。鉴于 LAMP 技术在灵敏度上的优势,本文建立了检测犬瘟热病毒的RTLAMP方法,经体系优化后,证实该方法可在60℃等温的条件下、1 h内完成扩增,且对感染犬类的其他病毒不出现非特异性反应;对63份临床可疑样本的检测结果证明,该RT-LAMP方法阳性检出率高于RT-PCR方法,能够减少的临床检测中假阴性的比例;另外,与常规PCR方法相比,LAMP技术独特的可视化的结果判定方法和检测时间上的优势,也大大增加了将之应用于现场检测的前景。但与其高超的灵敏度相对应,LAMP方法的假阳性也是一个争论的焦点,尤其检测大批量样本时阳性产物产生的气溶胶是造成假阳性的重要原因,在本文中由于临床送检样本中内容物有限,不足以对阳性样本进行假阳性验证,因此仅对水貂肺脏样本进行了免疫组织化学检测(另文发表),证实了LAMP检测阳性而RT-PCR阴性的5份病料中可见典型的犬瘟热病毒核内包涵体,之所以RT-PCR检测阴性,可能是病料运送过程较长或者大量的内源性RNA酶在RNA提取过程中导致了核酸的降解,超出了RT-PCR方法的检测下限,这在相关研究已有提及[6]。
综上,本研究针对犬瘟热病毒建立的RT-LAMP检测方法,灵敏、迅速、特异性强,无需使用昂贵的仪器设备,具备可视化判定结果的能力,可作为一种高效检测CDV的手段,广泛应用于CDV的诊断和流行病学调查等相关研究。
[1]Soma T, Ishii H, Hara M, et al. Comparison of immunoperoxidase plaque staining and neutralizing tests for canine distemper virus[J].Vet Res Commun,2001,25(4):311-325.
[2]Appe IMJ,Yates RA,Foley GL,at al. Canine distemper epizootic in lions,tigers,and leopards in North America[J].J Vet Diagn Invest,1994.6:277-288.
[3]Hoyland JA,Dixon JA,Berry JL,et al.A comparison of in situhybridization,reverse transcripitase-polymerase chain reaction(RT-PCR)and in situ-RT-PCR for detection of canine distemper virus RNA in Paget’s disease[J].J Virol Methods,2003.109(2):253-259.
[4]Jozwik A,Frymus T.Comparison of the immunofluorescence assay with RT-PCR and nested PCR in the diagnosis of canine distemper[J].Vet Res Commun,2005,29(4):347-359.
[5]肖定福,张汇东,李文平,等.RT-PCR检测宠物犬的犬瘟热病毒[J].经济动物学报,2005,9(4):221-224.
[6]Frisk AL,Konig M,Moritz A,at al.Detection of canine distemper virus nucleoprotein RNA by reverse transcription-PCR using serum,whole blood,and cerebrospinal fluid from dogs with distemper[J].J Clin Microbiol,1999,37:3634-3643.
[7]Doo KIM,Jeoung SY,So-Jeo AHN,at al.Comparison of tissue and fluid samples for the early detection of canine distemper virus in experimentally infected dogs[J].J.Vet Med Sci,2006,68(8):877-879.
[8]Notomi T,Okayama H,Masubuchi H,et.al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63.
[9]Cho HS,Kang JI,Park NY.Detection of canine parvovirus in fecal samples using loop-mediated isothermal amplification[J].J Vet Diagn Invest,2006,18(1):81-84.
[10]Imai M,Ninomiya A,Minekawa H.Rapid diagnosis of H5N1 avian influenza virus infection by newly developed in fluenza H5 hemagglutinin gene-specific loop-mediated isothermal amplification method[J].Vaccine,2006,24(44-46):6679-6682.
[11]Poon LL,Wong BW,Ma EH,et.al.Sensitive and inexpensive molecular test for falciparum malaria: detecting Plasmodium falciparum DNA directly from heat-treated blood by loopmediated isothermal amplification[J].Clin Chem,2006,52(2):303-306.
[12]Pham HM, Nakajima C, Ohashi K, et al. Loop-mediated isothermal amplification for rapid detection of Newcastle disease virus[J].J Clin Microbiol,2005,43(4):1646-1650.
Detection of Canine Distemper Virus by Reverse Transcriptase Loop-Mediated Isothermal Amplification Method
WEN Hai,QIN Hai-bin,HE Xing-liang,ZHU Qian,GAO Yi-long,ZHANG Hui-dong
(Nanjing Policedog Research Institute of MPS,Nanjing 210012,China)
Objective To develop a new method for rapid detection of canine distemper virus by reverse transcriptase loop-mediated isothermal amplification method(RT-LAMP).Method According to the published GenBank sequence,four strips of primers specific recognizing NP gene of canine distemper virus were designed.We studied the optimal reaction conditions,specificity,sensitivity,and its visualized judging method of products.Then we used 63 clinical specimens to verify its efficiency in field detection.Results The amplication can be performed at a constant temperature 60℃ within 1 hour.Specific primers did not recognize genes of other virus commonly infecting canine.The results of RTLAMP could be easily observed by naked eyes after SYBR green I staining.In 63 specimens collected from Nanjing and Shangdong,45 samples(71.4%)were positive,but only 40 samples(63.5%)were positive using RT-PCR.Conclusion The results of our study demonstrate a higher superiority of specificity,sensitivity,efficiency and convenience of the RTLAMP method,and provide a new detection method for canine distemper virus.
RT-LAMP;canine distemper virus,CDV
S852.65+5;S858.292;R33
A
1671-7856(2012)08-0051-05
10.3969.j.issn.1671.7856.2012.008.012
2012-05-24
公安部应用创新计划(2007YYCXNJJQS161)。
温海(1961-),男,副研究员,从事动物疫病防控工作。E-mail:hingull@sina.com。
张汇东,研究员,E-mail:zhhuido@163.com。

