实时荧光定量PCR技术在SPF鸡四种垂直传播疾病监测中的应用
王 静,陈冬妮,欧芷华,袁 文,邓庆丽,陆勇军,张 钰
(1.广东省实验动物监测所(广东省重点实验室),广州 510262;2.中山大学生命科学学院,广州 510275)
实时荧光定量PCR技术在SPF鸡四种垂直传播疾病监测中的应用
王 静1,陈冬妮2,欧芷华2,袁 文1,邓庆丽2,陆勇军2,张 钰1
(1.广东省实验动物监测所(广东省重点实验室),广州 510262;2.中山大学生命科学学院,广州 510275)
目的 探讨荧光定量PCR检测技术对SPF鸡四种垂直传播病毒的检测应用。方法 采集60份SPF鸡及70份普通鸡群蛋清、泄殖腔试子样品,提取样品核酸,分别进行 ARV、REV、CAV、ALV四种病毒实时荧光定量PCR检测,根据标准曲线及溶解曲线分析判读样品病毒拷贝数。结果 SPF鸡 ALV 2份阳性,检出率3.3%,其余病毒检测均为阴性;普通鸡样品REV检测2份阳性,检出率2.9%,ALV 10份阳性,检出率14.3%。结论 荧光定量PCR检测方法最低可检测到100个拷贝核酸,检测灵敏度较高,有望应用于SPF鸡临床样品的病原检测。
实时荧光定量PCR;禽网状内皮增生症病毒;鸡传染性贫血病毒;禽白血病病毒;禽呼肠孤病毒;SPF鸡
SPF鸡及SPF鸡胚是农业、生物医学及生物制品研究、生产、检验中不可缺少的标准实验动物和实验材料,其质量是否达标,直接影响科研结果和实验数据的可靠性以及生物制品产品质量。2010年版《中国兽药典》附录《生产、检验用动物标准》明确要求,用于禽类制品毒种制备与鉴定、病毒活疫苗生产与检验、灭活疫苗检验的鸡和鸡胚应符合国家无特定病原体(SPF级)动物标准[1]。近年来,我国兽用生物制品行业发展迅猛,企业在进行疫苗外源病毒质量控制的过程中对SPF鸡(蛋)的量和质会提出愈来愈高的要求,迫切需要加快我国SPF鸡的微生物学监测方法、试剂的研究。
网状内皮细胞增生症病毒(REV)、鸡传染性贫血病病毒(CAV)、和 J型禽白血病毒(ALV-J)、禽呼肠孤病毒(ARV)是养禽业中最常见的几种垂直传播的免疫抑制病毒,近年来国内流行病学调查多次报道这几种病毒在我国养鸡场中均普遍存在,且常出现多重感染[2-5],给我国养禽业带来了巨大的经济损失。这些蛋传性病毒除了会引起亲代自身条件性持续性感染、免疫抑制、生产性能下降等危害之外,更严重的是能通过种蛋引发垂直感染,若是SPF种鸡感染蛋传性疾病,就会通过鸡胚污染疫苗,更将会造成不可估量的严重后果,对于SPF鸡生产企业来说,也是首要排除的重点病原[6]。本研究中开展对 SPF鸡(蛋)威胁最大的 ARV、REV、CAV、ALV 4种蛋传性疾病病毒的荧光定量PCR检测技术的研究,以及检测技术在普通鸡和SPF鸡群中的应用,通过对数据的分析,4种病毒的荧光定量PCR检测技术有望应用于SPF鸡病原检测中。
1 材料和方法
1.1 样本
广东某SPF鸡场 SPF鸡泄殖腔拭子 30份,蛋清样品30份;广东某普通养鸡场普通鸡泄殖腔拭子40份,蛋清样品30份;其中 SPF鸡、普通鸡均未进行4种病毒疫苗的免疫。
1.2 抗体检测
采集 SPF鸡及普通鸡血清,分别进行 CAV、ARV,REV、ALV血清抗体ELISA检测,并进行 SPF蛋清 ALV病毒 ELISA检测,试剂盒均购自 Idex公司。
1.3 核酸抽提
CAV、REV、ALV提取病毒 DNA,泄殖腔拭子用Omega公司E.Z.N.A stool DNA kit进行提取,蛋清样品用E.Z.N.A HP Viral DNA/RNA kit进行提取,操作按照试剂盒说明书进行。ARV提取病毒RNA,泄殖腔拭子用 Invitrogen公司 Trizol进行 RNA抽提,操作按照试剂说明书进行。
1.4 cDNA制备
粪便及蛋清样品提取病毒RNA进行反转录,反应体系:5×primerScript buffer 2 μL,PrimerScript RT enzyme mixI 0.5 μL,oligo dT 25 pmol,random 6 mers 50 pmol,total RNA 6~7 μL,H2O up to 10 μL;反应程序:37℃ 20 min,85℃ 5 s。反转录试剂盒购置 Takara 公司,PrimerScript RT reagent kit。
1.5 四种病毒SYBR green荧光定量PCR引物设计合成
参照Genbank中登录的相应毒株序列 ARV 1133株s1基因(Gene ID:13310185);REV LTR片段序列(GI:57865344);ALV gag基因片段(GI:308053557);CAVvp2基因片段序列(GI:299474029),通过软件 Primer 5.0设计荧光定量PCR引物。
1.6 实时荧光定量PCR检测
利用前述报道建立的四种病毒实时荧光定量PCR方法进行检测。
1.6.1 ARV荧光定量 PCR检测:标准品:取 pTARV标准质粒进行梯度稀释,以2.1×106到2.1×102copy 6个梯度稀释度的质粒作为定量标准曲线。每一个梯度2个复孔;阴性对照3个复孔。样品:SPF鸡及普通鸡粪便及蛋清cDNA。SYBG QPCR体系:ddH2O 9.5 μL,上下游引物(SYBR)各 0.4 μL,模板 cDNA 2 μL,SYBR green master mix 12.5 μL,总体系25 μL。冰上混匀,稍微离心。上机进行 PCR反应,反应程序:95℃ 10 min,1 cycle;95℃ 5 s,57.5℃ 10 s,72℃ 31 s,45 cycles;55℃~95℃ 读取溶解曲线。QPCR试剂盒为Roche公司FastStart SYBR green master(ROX),荧光定量PCR仪为ABI 7500。
1.6.2 REV荧光定量 PCR检测:标准品:取 pTREV质粒进行梯度稀释,以5.2×106到5.2×102这6个梯度稀释度的质粒作为标准品进行荧光定量PCR,每一个梯度采用2个复孔,阴性对照3个复孔。样品:SPF鸡及普通鸡粪便及蛋清样品DNA进行REV前病毒DNA的荧光定量PCR检测。SYBG QPCR 体系:ddH2O 9.5 μL,上下游引物(SYBR)各0.4 μL,模 板 DNA 2 μL,SYBR green master mix12.5 μL,总体系 25 μL。冰上混匀,稍微离心。上机进行PCR反应,反应程序:95℃,10 min 1 cycle;95℃ 10 s,54℃ 10 s,72℃ 31 s,45 cycle;55℃~95℃读取溶解曲线。
1.6.3 ALV荧光定量 PCR检测:标准品:取 pTALV质粒进行梯度稀释,以1.9×106到1.9×102这6个梯度稀释度的质粒作为标准品进行荧光定量PCR,每个梯度2复孔,阴性对照3个复孔。样品:SPF鸡及普通鸡粪便及蛋清提取样品DNA进行ALV前病毒 DNA的荧光定量 PCR检测。SYBG QPCR 体系:ddH2O 9.5 μL,上下游引物(SYBR)各0.4 μL,模 板 DNA 2 μL,SYBR green master mix 13.5 μL,总体系 25 μL。冰上混匀,稍微离心。上机进行PCR反应,反应程序:酶活化95℃,10 min;变性 95℃ 10 s,退火 50℃ 10 s,延伸 72℃ 31 s;50℃~95℃读取溶解曲线。
1.6.4 CAV临床样品荧光定量PCR检测:标准品:取pT-CAV质粒进行梯度稀释,以1.1×107到1.1×102这6个梯度稀释度的质粒作为标准品,进行荧光定量PCR,每一个梯度采用2个复孔,设置阴性对照3个复孔。样品:SPF鸡及普通鸡粪便及蛋清样品DNA。SYBG QPCR 体系:ddH2O 9.5 μL,上下游引物(SYBR)各 0.4 μL,模板 DNA 或 cDNA 2 μL,SYBR green master mix 12.5 μL,总体系 25 μL。冰上混匀,稍微离心。上机进行PCR反应,反应程序:酶活化94℃,10 min;变性 94℃ 10 s,退火 59℃ 15 s,延伸72℃ 31 s;50℃~95℃读取溶解曲线。
1.7 数据统计分析
根据标准品定量做出标准曲线结合溶解曲线进行样品分析,样品Ct值位于定量可信区间且Tm值与标准品一致的判为可疑,复检确认。Ct值大于定量标准品最低拷贝数Ct值以后的判为阴性,
2 结果与分析
2.1 ELISA检测结果
40份 SPF 鸡血清 CAV、REV、ARV、ALV-J抗体检测均为阴性,30份SPF蛋清样品ALV抗原检测均为阴性;52份普通鸡血清抗体检测结果为:CAV阳性率 82.7%(43/52)、REV 23.1%(12/40)、ARV 100%(52/52)、ALV-J 9.6%(5/52);30 份普通鸡蛋ALV病原检测阳性率7%(2/30)。
2.2 ARV荧光定量PCR检测结果与分析
根据标准质粒pT-ARV拷贝数做出标准曲线(图1.1,1.3),标准曲线在 2.1× 106到 2.1×102拷贝范围内呈现良好的线性关系。相关系数为r2为0.999,扩增效率约为 103%,检测下限为210个拷贝。30份SPF鸡的泄殖腔拭子,30份蛋清液样品Ct值均落于阴性区,拷贝数都<2.1×102,溶解曲线分析也为阴性。(图1.1,1.2)。普通鸡的泄殖腔拭子和蛋清液样品的Ct值均落于阴性区,拷贝数都 <2.1×102,溶解曲线分析也为阴性(图1.3,1.4)。
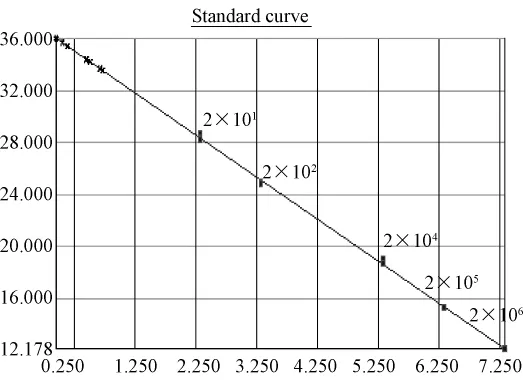
图1.1 SPF鸡样品ARV(SYBR)荧光定量PCR标准曲线及样品定量图:pT-ARV质粒拷贝数依次2.1×106到2.1×101,样品Ct值均落在阴性区间。Y=-3.23X+35.86,R2=0.999Fig.1.1 Quantitative real-time standard curve of pT-ARVplasmid and quantitative plot of SPF chicken samples.Serial dilutions of pT-ARV plasmid from 2.1×106to 2.1×101copies/μL were tested to generate a standard curve:y=-3.23X+35.86,R2=0.999.The Ct values of samples were all below the detection threshold
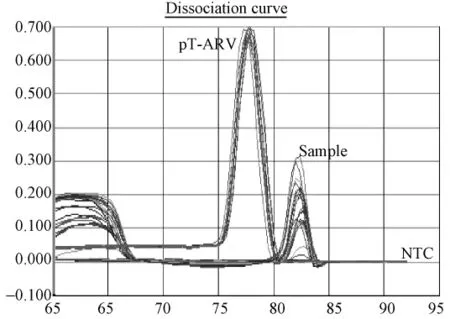
图1.2 SPF鸡样品ARV(SYBR)荧光定量PCR溶解曲线图:pT-ARV的溶解曲线对应单一溶解峰,Tm值在78.4℃;阴性对照对应平缓的线条,样品孔均为Tm值不同的溶解峰。Fig.1.2 Melting curve analysis of pT-ARV plasmid and SPF chicken samples.Tm of stanrdard pT-ARV plasmid was 78.4℃.The melting curves of SPF chicken samples exhibited nonspecific melting peaks.

图1.3 普通鸡样品ARV(SYBR)荧光定量PCR标准曲线及样品定量图:pT-ARV质粒拷贝数依次为2.1×106到 2.1× 102,y=-3.33X+36.92,R2=0.99,样品Ct值均落在阴性区间。Fig.1.3 Quantitative real-time standard curve of pT-ARV plasmid and quantitative plot of common chicken samples.Serial dilutions of pT-ARV plasmid from 2.1×106to 2.1×102copies/μL were tested to generate a standard curve:y=-3.33X+36.92,R2=0.99.The Ct values of samples were all below the detection threshold.
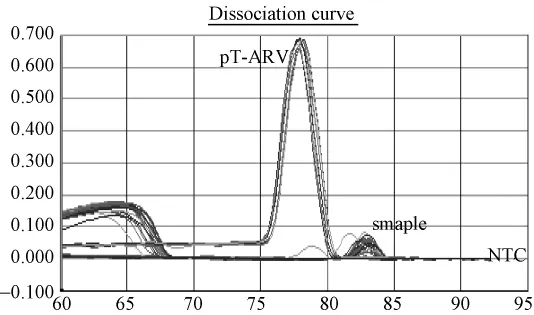
图1.4 普通鸡样品ARV(SYBR)荧光定量PCR溶解曲线图:pT-ARV标准品对应单一溶解峰,Tm值78.4℃;阴性对照对应平缓的线条,部分样品有非特异溶解峰。Fig.1.4 Melting curve analysis of pT-ARV plasmid and common chicken samples.Tm of stanrdard pT-ARV plasmid was 78.4℃.The fluorescence melting curves of common chicken samples showed non-specific melting peaks.
2.3 REV荧光定量PCR检测结果与分析
根据标准质粒pT-REV拷贝数做出标准曲线进行样品分析(图2.1、2.3、2.5),标准曲线在5.2×106到5.2×102拷贝范围内呈现良好的线性关系。相关系数为r2为0.993~0.995,扩增效率约为97%~98%。检测下限为520个拷贝。30份SPF鸡的泄殖腔拭子,30份蛋清液样品REV前病毒DNA拷贝数都低于检测下限,部分样品Ct值落在定量范围内,但溶解曲线分析为非特异扩增。(图2.1,2.2);40份普通鸡的泄殖腔拭子和30份蛋清液样品REV前病毒DNA拷贝数大部分都低于520拷贝,溶解曲线分析,样品出现非特异溶解峰。排除Tm值及溶解曲线异常检测孔,初步筛选出来的阳性可疑样品3份。3份可疑阳性样品再次实验确认2份为阳性(图2.3~2.6)。
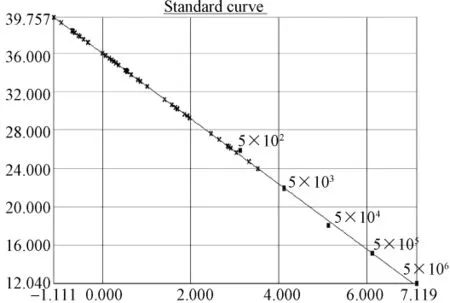
图2.1 SPF样品REV(SYBR)荧光定量PCR标准曲线及样品定量图:标准品pT-REV质粒拷贝数依次5.2×106到 5.2×102,Y=-3.398X+35.983,R2=0.995.Fig.2.1 Quantitative real-time standard curve of pT-REV plasmid and quantitative plot of SPF chicken samples.Serial dilutions of pT-REV plasmid from 5.2×106to 5.2×102copies/μL were tested to generate a standard curve:Y=-3.398X+35.983,,R2=0.995.
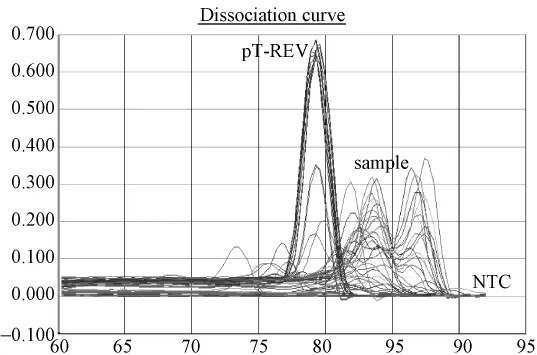
图2.2 SPF鸡样品REV(SYBR)荧光定量PCR溶解曲线图:pT-REV标准品对应单一溶解峰,Tm值79.6℃;样品出现非特异溶解峰。排除Tm值及溶解曲线异常检测孔,未发现阳性孔。Fig.2.2 Melting curve analysis of pT-REV plasmid and SPF chicken samples.Tm of standard pT-REV plasmid was 79.6℃.The fluorescence melting curve of SPF chicken samples showed non-specific melting peaks.
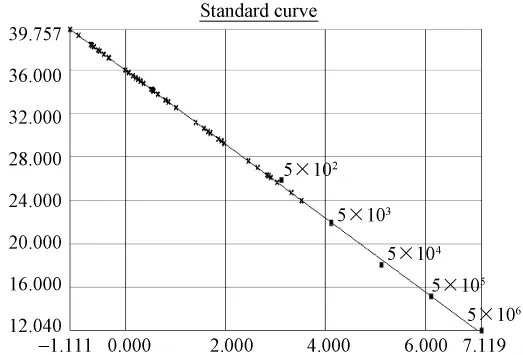
图2.3 普通鸡样品REV(SYBR)荧光定量PCR标准曲线及样品定量图:标准品pT-REV质粒拷贝数依次5.2×106到5.2×102,部分样品孔落在检测区间。Fig.2.3 Quantitative real-time standard curve of pT-REV plasmid and quantitative plot of common chicken samples.Serial dilutions of pT-REV plasmid from 5.2×106to 5.2×102copies/μL were tested to generate a standard curve:Some samples'Ct values were located within the detection range.
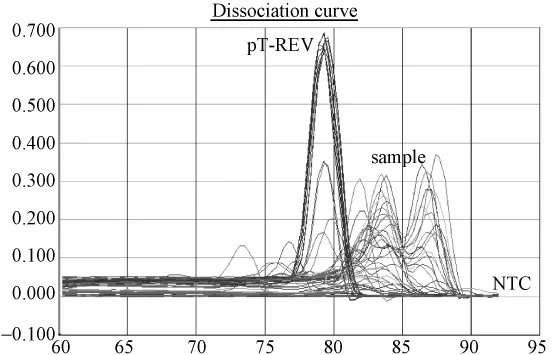
图2.4 普通鸡样品REV(SYBR)荧光定量PCR溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在79.6℃;样品出现非特异溶解峰。排除Tm值及溶解曲线异常检测孔,初步筛选出来的阳性可疑样品3份。Fig.2.4 Melting curve analysis of pT-REV plasmid and common chicken samples.Tm of standard pT-REV plasmid was 79.6℃.Three samples displayed the same Tm peak with that of standard plasmid,and were regarded as suspicious samples.
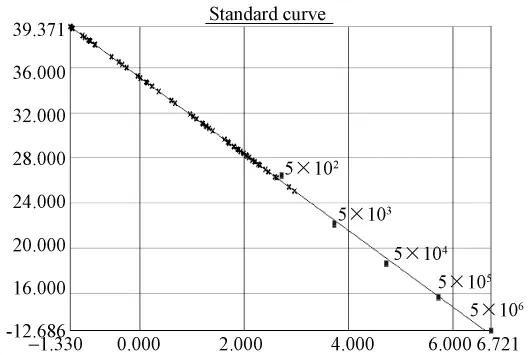
图2.5 普通鸡REV可疑样品再次荧光定量PCR标准曲线及样品定量图:标准品拷贝数依次5.2×106到5.2×102,可疑结果仍有两份样品结果阳性。Y=-3.36X+35.159,R2=0.993Fig.2.5 Confirmation by QPCR detection of suspicious samples.pT-ARV plasmids were serially diluted from 5.2×106to 5.2×102copies/μL to obtain quantitative standard curve:Y=-3.36X+35.159,R2=0.993.There were still 2 suspicious samples which showed positive results.
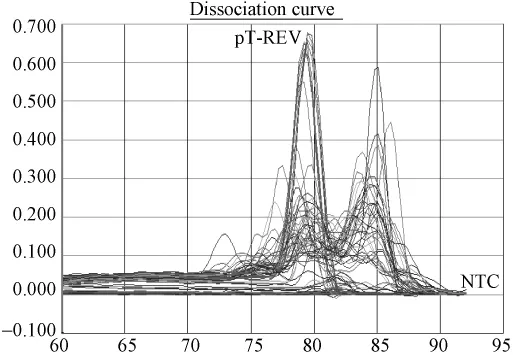
图2.6 普通鸡样品REV可疑样品再次荧光定量PCR溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在79.6℃;样品有低拷贝特异峰和杂峰。Fig.2.6 The melting curves of suspicious samples tested by QPCR detection.Tm of standard pT-REV plasmid was 79.6℃,2 samples with the same melting curve of standard plasmid,and the others were non-sense noisy.
2.4 ALV荧光定量PCR检测结果与分析
根据标准质粒pT-ALV拷贝数做出标准曲线进行样品分析(图3.1、3.3、3.5),标准曲线在 1.9×106到1.9×102拷贝范围内呈现良好的线性关系。相关系数为 r2约为0.999,扩增效率约为98%~102%。检测下限为190个拷贝。30份SPF鸡的泄殖腔拭子,30份蛋清液样品中ALV前DNA拷贝数大部分都小于190,3份样品Ct值落在定量范围内。溶解曲线分析其2份可疑样品出现与标准品一致的单一溶解峰,1份为非特异杂峰(图3.1~3.2)。30份普通鸡的泄殖腔拭子和40份蛋清液大部分样品ALV前DNA拷贝数都小于190,大部分样品Ct值均落于阴性区,14份样品Ct值落在定量范围内;大部分样品出现非特异溶解峰,排除两份Tm值不同样品,12份可疑样品出现与标准品一致的单一溶解峰或出现杂峰(图3.3,3.4),17份可疑样品进行重复实验,12份可疑样品出现与标准品一致的单一溶解峰,拷贝数在 199~326之间,判为阳性。(图3.5,3.6)。
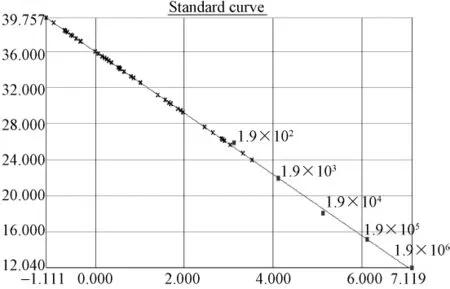
图3.1 SPF鸡样品ALV(SYBR)荧光定量PCR标准曲线及样品定量图:质粒拷贝数依次1.9×106到1.9×102。3份样品Ct值落在定量范围内。Y=-3.3797X+36.9035,R2=0.999Fig.3.1 Quantitative real-time PCR standard curve of pT-ALV plasmid and quantitative plot of SPF chicken samples.Serial dilutions of pT-ALV plasmid from 1.9×106to 1.9×102copies/μL were tested to generate a standard curve:Y=-3.3797X+36.9035,R2=0.999.'The Ct values of three samples were within the detected range.
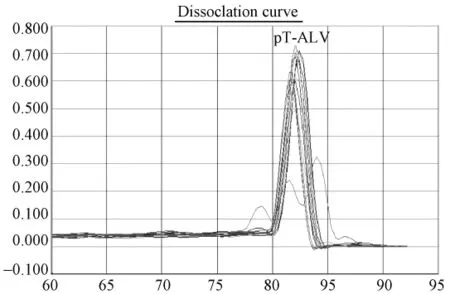
图3.2 SPF鸡样品ALV(SYBR)荧光定量PCR5份可疑样品溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在82.1℃;2份可疑样品孔出现与标准品孔一致的单一溶解峰,1份出现杂峰。Fig.3.2 Melting curve analysis of pT-ALV plasmid and SPF chicken samples.Tm of standard pT-ALV plasmid was 82.1℃.Two samples displayed the same Tm peak with that of standard plasmid,were regarded as suspicious samples,and the others showed to be non-specific melting curves.
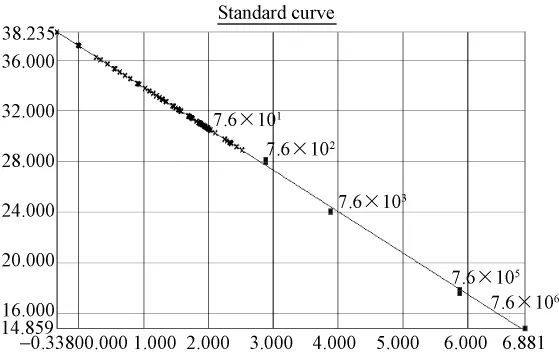
图3.3 普通鸡样品ALV(SYBR)荧光定量PCR标准曲线及样品定量图:质粒拷贝数依次7.6×106到7.6×101,14份样品拷贝数大于检测最低拷贝数 190。Y=-3.2649X+37.1308,R2=0.998。Fig.3.3 Quantitative real-time standard curve of pT-ALV plasmid and quantitative plot of common chicken samples.Serial dilutions of pT-ALV plasmid from 7.6×106to 7.6×101copies/μL were tested to generate a standard curve:Y=-3.2649X+37.1308,R2=0.998,and the Ct values of 14 samples were located within the detection range.

图3.4 普通鸡样品ALV(SYBR)荧光定量PCR 14份可疑样品溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在82.1℃;排除两份Tm值不同样品孔,12份可疑样品出现与标准品一致的单一溶解锋或出现杂峰。Fig.3.4 Melting curve analysis of pT-ALV plasmid and common chicken samples.Tm of standard pT-ALV plasmid was 82.1℃.There were 12 suspicious samples showing the same Tm with that of standard plasmid except 2 non-specific melting curves.

图3.5 SPF及普通鸡ALV 17份可疑样品DNA再次荧光定量PCR标准曲线及样品定量图:标准品拷贝数依次7.6×106到7.6×102,4份样品低于检测最低拷贝数190。Y=-3.2803X+37.1187,R2=0.991。Fig.3.5 Confirmation by QPCR detection of suspicious samples.pT-ALV plasmids were serially diluted from 7.6×106to 7.6×102copies/μL to obtain quantitative standard curve:Y=-3.2803X+37.1187,R2=0.991.There were still 13 samples in the suspicious samples which showed positive results.
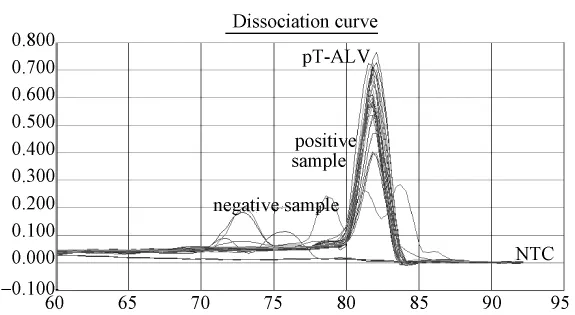
图3.6 SPF及普通鸡ALV 17份可疑样品再次荧光定量PCR标准曲线及样品定量图:标准品溶解曲线对应单一溶解峰,Tm集中在82.1℃;12份可疑样品孔出现与标准品孔一致的单一溶解峰。5份为非特异杂峰,排除。Fig.3.6 The melting curves of suspicious samples were tested by QPCR detection.Tm of standard pT-ALV plasmid was 82.1℃,12 samples with the same melting curves of standard plasmid,and the other 5 samples were non-specific melting curves.
2.5 CAV荧光定量PCR检测结果及分析
根据标准质粒pT-CAV拷贝数做出标准曲线进行样品分析(图3.1、3.3、3.5),标准曲线在 1.1×107到1.1×102拷贝范围内呈现良好的线性关系。相关系数为r2约为0.998~0.999之间,扩增效率约为86%~94%。检测下限为110个拷贝。30份SPF鸡的泄殖腔拭子,30份蛋清液样品的拷贝数小于检测下限110,且溶解曲线分析均为无意义噪音或直线,CAV检测均为阴性(图4.1,4.2)。30份普通鸡的泄殖腔拭子和30份普通鸡蛋清液样品的拷贝数都小于检测下限110,且溶解曲线分析均为无意义噪音或直线,CAV检测均为阴性(图4.3,4.4)
2.6 ELISA检测方法与qPCR检测方法的比较
SPF鸡的4种病毒抗体检出率为0,说明 SPF鸡未感染4种病毒。然而,普通鸡样品都能检出4种病毒抗体,检出率分别是 ARV 100%,CAV 82.7%,REV 23.1%,ALV 9.6%,说明普通鸡已感染4种病毒。QPCR检测病原方法,4种病毒在SPF鸡中仅ALV检2/60份阳性,检出率3.3%,其余病毒检测均为阴性,而普通鸡场样品 REV检测2/70份阳性,检出率 2.9%,ALV 10/70份阳性,检出率14.3%。
3 讨论
3.1 ALV、CAV、REV、ARV 的感染特征
ALV是一群逆转录病毒,具有多种亚型。其中A、B、C、D亚型主要在蛋鸡引发淋巴样肿瘤,J亚型主要在肉鸡引发骨髓细胞瘤,但近年来在蛋鸡中的发生率也在上升。各种年龄鸡均可感染ALV发病,患病鸡极度消瘦,生长发育不良,免疫反应低下,产蛋率下降,死亡率高。ALV感染前期虽不产生明显可见肿瘤,但可诱发鸡群的免疫抑制状态,引起感染鸡只消瘦,产蛋下降等问题,还会导致不同程度的继发感染。CAV感染特征是导致雏鸡的全身淋巴组织萎缩和再生障碍性贫血,并伴随免疫抑制,是一种既能垂直感染又能横向感染的病毒,垂直感染的雏鸡一般表现为急性临床症状,水平传播感染的雏鸡表现为亚临床症状,成年鸡能感染CAV病毒,而且排毒,但不表现临床症状,产蛋量、受精率、孵化率等均无明显影响。ARV一些毒株可引发雏鸡的病毒性关节炎,多数毒株可能只是表现消化道功能紊乱、羽毛生长差,生长缓慢等亚临床症状,但可造成不同程度的免疫抑制,特别是垂直感染的雏鸡,易导致并发或继发其他疾病。REV是反转录病毒科病毒,感染后引起以网状细胞增生为主要特征的综合征。REV可水平传播,也可垂直传播。一般感染低日龄鸡,特别是新孵出的雏鸡及胚胎,感染后引起严重的免疫抑制或免疫耐受[6,7]。近年来REV、ALV、CAV、ARV这四种垂直传播病原在种鸡业中的发生率有上升的趋势,这类病毒不仅能通过水平接触传播,而且还可通过种蛋垂直传播而将疫情扩大,感染鸡群常常表现为亚临床形式,并造成不同程度的免疫抑制,导致免疫失败从而给生产带来损失,而使用携带了病原的SPF鸡胚生产的疫苗更有可能导致种鸡接种后商品代的感染,危害被放大,导致严重的经济损失。因此及时检出和淘汰病鸡对控制这类疾病具有重大意义。
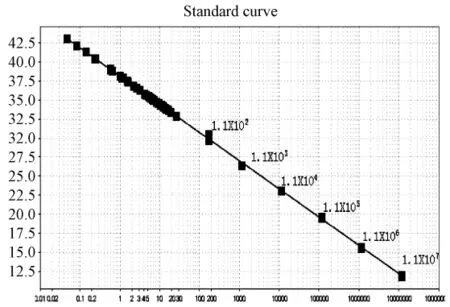
图4.1 SPF鸡样品CAV(SYBR)荧光定量PCR标准曲线及样品定量图:质粒拷贝数依次1.1×107到1.1×102,样品Ct值均落在不可信区间,远低于最低拷贝数,判断为阴性。Y=-3.70X+38.11,R2=0.998Fig.4.1 Quantitative real-time standard curve of pT-CAV plasmid and quantitative plot of SPF chicken samples.Serial dilutions of pT-CAV plasmid from 1.1×107to 1.1×102copies/μL were tested to generate a standard curve:Y=-3.70X+38.11,R2=0.998.The Ct value of samples were all below the detection threshold.
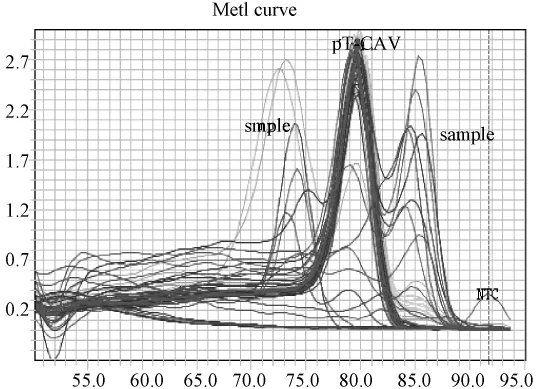
图4.2 SPF鸡样品CAV(SYBR)荧光定量PCR溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在79.9℃附近;样品孔均为无意义噪音或直线。Fig.4.2 Melting curve analysis of pT-CAV plasmid and SPF chicken samples.The Tm of standard pT-CAV plasmid was 79.9℃.The melting curves of all SPF chicken samples demonstrated as non-specific melting peaks.
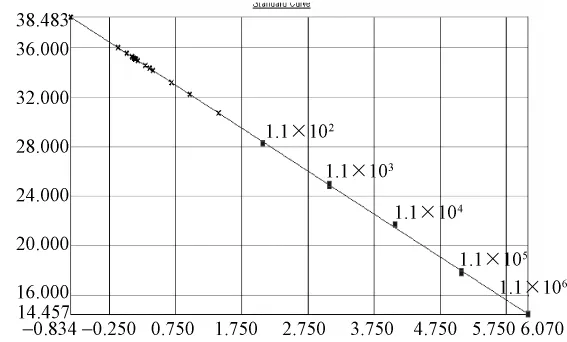
图4.3 普通鸡样品CAV(SYBR)荧光定量PCR标准曲线及样品定量图:质粒拷贝数依次1.1×106到1.1×102,样品Ct值均落在阴性范围。Y=-3.47X+35.59,R2=0.999。Fig.4.3 Quantitative real-time standard curve of pT-CAV plasmid and quantitative plot of common chicken samples.Serial dilutions of pT-CAV plasmid from 1.1×106to 1.1×102copies/μL were tested to generate a standard curve:Y=-3.47X+35.59,R2=0.999.The Ct values of samples were all below the detection threshold.
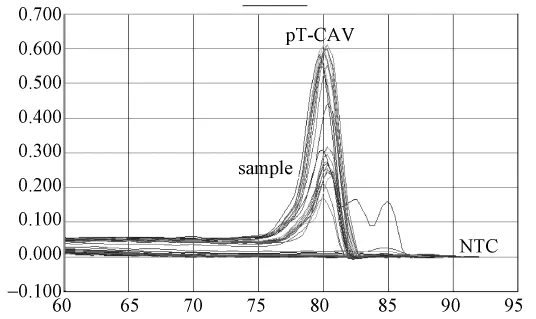
图4.4 普通鸡样品CAV(SYBR)荧光定量PCR溶解曲线图:标准品溶解曲线对应单一溶解峰,Tm集中在80.3℃;样品孔为低拷贝无意噪音或直线。Fig.4.4 Melting curve analysis of pT-CAV plasmid and common chicken samples.The Tm of standard pT-CAV plasmid was 80.3℃ .The melting curves of common chicken samples demonstrated as non-specific melting peaks.
3.2 实时荧光定量PCR(qPCR)
既保持了 PCR技术灵敏、快速、特异的特点,又克服了以往PCR技术中存在的假阳性及不能进行准确定量等缺点,近年来在基础研究及临床应用方面发挥着越来越大的作用。禽网状内皮增生症病毒、鸡传染性贫血病毒、禽白血病病毒、禽呼肠孤病毒这四种蛋传性病毒引起的疫病在我国鸡群中普遍存在,对于SPF鸡及鸡胚生产单位来说尤其需要及早地准确诊断才能避免病毒垂直传播造成的进一步扩散污染。本文中所建立的四种鸡蛋传性病毒qPCR检测方法,能够检测到最低100个拷贝的病原量,比普通PCR的检测灵敏度提高了1个数量级,并首次将其应用于SPF鸡生产企业的疾病监测。在临床检测应用显示 SPF鸡 ARV、CAV和REV病毒均未检出,ALV检出率为2/60;普通鸡群ARV和 CAV病毒未能检出,REV检出率为2/70,ALV检出10/70,这些阳性感染样品的病毒拷贝数集中在100~500个之间,而且SPF鸡群体的阳性率及病毒拷贝数要远远低于普通鸡群,说明4种病毒的qPCR检测方法能应用于临床样品的病原检测。
3.3 从ARV和CAV的血清抗体检测
结果可以看出,普通鸡群感染了该病毒并产生了广泛的高抗体,这时可能存在病原的消失,应用qPCR方法不能检测到病原。REV、ALV感染鸡在群体中只有部分产生抗体,qPCR方法检测病原和ELISA方法检测抗体均有阳性结果,本研究中,ELISA抗体检测SPF鸡样品结果均为阴性,而qPCR检测方法检出两份 ALV阳性,但是,我们建立的方法还不能有效区分内源性和外源性ALV,病原检出率明显高于ELISA方法,因此,ALV-qPCR的检测方法还需要进一步优化,同时扩大检测样本量,与ELISA-Ab检测方法的联合使用进一步提高检测结果的准确性。
3.4 血清学抗体检测
血清学抗体检测能为动物群体是否污染病原微生物提供依据,SPF鸡是在屏障环境下隔离饲养、繁育的实验动物群体,血清抗体检测背景较低,结果大多为阴性结果,临床商品化ELISA检测试剂应用于SPF鸡血清抗体检测是否存在检测灵敏度不够的缺陷,对于生物制品原材料的 SPF鸡胚来说,SPF种蛋中携带病原的检测尤为重要,因此仅仅采用血清学检测方法来判断SPF鸡的微生物携带状况是不够的,应采取定期棉拭子采样、蛋清样品检测病毒核酸的方法来提高针对SPF鸡携带病原微生物的检测灵敏度。本研究中检测到的阳性样本病毒核酸拷贝数在100到500个拷贝之间,说明本检测方法灵敏度较高,有望应用于SPF鸡临床样品的病原检测。
[1]何海蓉,王正春,刘文峰,等.从兽用生物制品企业角度看我国SPF鸡质量控制现状[J].中国比较医学杂志,2011,21(10,11):99-102.
[2]姜世金,孟姗姗,崔治中,等.我国自然发病鸡群中MDV、REV和CAV共感染的检测[J].中国病毒学,2005,20(2):164-167.
[3]崔治中,孟姗姗,姜世金,等.我国白羽肉用型鸡群中CAV、REV和REOV感染状况的血清学调查[J].畜牧兽医学报,2006,37(2):152-157.
[4]康昭风,谢金防,韦启鹏,等.江西省主要养鸡地区4种鸡免疫抑制病的血清学调查[J].江西农业学报,2010,22(11):125-127
[5]胡北侠,黄艳艳,路希山,等.肉种禽网状内皮增生症、鸡传染性贫血和禽白血病血清学调查[J].广东畜牧兽医科技,2009,34(1):25-27.
[6]吴萍萍.四种蛋传性病毒病多重PCR检测方法的建立[D].硕士学位论文,安徽农业大学,2010:1-12.
[7]朱瑞良.种鸡垂直传播性疫病的危害及其控制[J].兽医导刊,2011,5:21-23.
Application of SYBR Green Fluorescent Quantitative Real-Time PCR in the Detection of Four Vertical Transmission Viruses in SPF Chickens
WANG Jing1,CHENG Dong-ni2,OU Zhi-hua2,YUAN Wen1,DEN Qing-li2,LU Yong-jun2ZHANG Yu1
(1.Guangdong Laboratory Animal Monitoring Institute,Guangzhou 510620,China 2.School of Life Sciences,Sun Yat-sen University,Guangzhou 510275)
Objective To apply SYBR green I fluorescent quantitative real-time PCR(QPCR)in detecting 4 vertical transmission viruses of chicken and to evaluate its application value for the quality control of SPF chickens.Method Quantitative real-time PCR technique was used to detect REV,ALV,ARV and CAV RNA,DNA or provirus DNA in 30 cloacal swab samples and 30 eggs of SPF chicken samples as well as 40 cloacal swab samples and 30 eggs of common chicken samples.Standard curve and melting curve analyses were conducted to obtain the quantitative result.Results Out of the SPF chicken samples,2/30(3.3%)were ALV-positive,and the three other viruses were negative.For the common chicken samples,2/70(2.9%)were REV-positive,and 10/70(14.3%)were ALV-positive.Conclusions These QPCR assays show better sensitivity and specificity for detecting the 4 viruses in SPF chickens with a detection limit of 100 copies of target DNA per-reaction,and have a bright prospect in clinical application.
Quantitative real-time PCR(QPCR);Reticuloendotheliosis virus(REV);Chicken infectious anemia virus(CAV);Avian leukemia viruses(ALV);Avian reovirus(ARV);SPF chicken
R33
A
1671-7856(2012)08-0006-09
10.3969.j.issn.1671.7856.2012.008.002
2012-06-10
广东省教育部产学研结合项目(2008B090500205),广东省实验动物重点实验室(2007B060101002)联合资助。
王静,女,助理研究员,研究方向实验动物遗传、分子生物学研究。
张钰,高级工程师。E-mail:zhangyugzh@hotmail.com。

