固体脂质纳米粒作为水杨酸经皮给药载体的研究
王爱萍 ,高大林 ,李 艳,戚元凯,慕宏杰,万 芳
(1.烟台大学药学院,山东 烟台 264005; 2.加卜吉中国品质管理中心,山东 青岛 266200)
近年来,微载体透皮给药研究取得了较大进展。固体脂质纳米粒(solid lipid nanoparticle,SLN)以生理相容性好、体内可降解、控释和靶向作用明确、毒性低、适宜工业化生产和长期保存等特点而日益受到重视[1]。固体脂质纳米粒用于经皮给药具有独特优势[2-3],如可通过穿透、水合和融合机制透皮转运,较高的包封率和载药量可保证药物经皮渗透时有足够的驱动力和透过量,以及具有封闭效应等。水杨酸临床上主要用于治疗皮肤浅部真菌病、脂溢性皮炎等,主要剂型为软膏剂。将水杨酸制成固体脂质纳米粒透皮给药系统,旨在提高生物利用度,增加药物在局部的储量,并通过其缓释特性获得一定时间稳定的血药浓度,从而提高治疗效能和患者依从性。笔者制备了水杨酸固体脂质纳米粒经皮给药系统,考察固体脂质纳米粒作为经皮给药载体的促渗作用,并与普通软膏比较,报道如下。
1 仪器与材料
RE-3000A型旋转蒸发仪(上海亚荣生化仪器厂);SK250HP型超声清洗器(上海科导超声仪器有限公司);UV-2550型紫外分光光度计(日本岛津公司);Angilent 1100型高效液相色谱仪;ZTY智能透皮试验仪(巩义市英峪予华仪器厂);LD5-2A型低速离心机(北京医用离心机厂)。水杨酸(北京益利精细化学品有限公司,批号为20070704);硬脂酸(天津市天大化工实验厂,批号为20050117);豆磷脂(上海太伟药业有限公司,批号为20070509);吐温-80(国药集团化学试剂有限公司,批号为F20060208);葡聚糖凝胶G-50(北京经科宏达生物技术有限公司,批号为17-0043-02)。Wistar大鼠,合格证号为 SCXK(鲁)2009-0009,购于山东绿叶制药有限公司。
2 方法与结果
2.1 水杨酸固体脂质纳米粒的制备
采用薄膜超声法制备。称取水杨酸5 mg,硬脂酸20 mg,豆磷脂40 mg,置茄形瓶中,加10 mL氯仿超声溶解,置旋转蒸发仪上,减压回收氯仿成膜,另取5 mL吐温-80水溶液(1%)加至已成膜的茄形瓶中,旋转,将膜洗下,超声处理40 min,超声后溶液于4℃保存,即得。
2.2 水杨酸含量测定方法
2.2.1 紫外分光光度法(水杨酸固体脂质纳米粒体外评价)
紫外吸收波长确定:精密称定水杨酸0.1 g,置量瓶中,以甲醇溶解并定容至刻度,精密量取0.2 mL溶液,定容至10 mL,以甲醇为空白对照,于200~400 nm波长处紫外扫描。另按2.1项下方法制备空白及含药固体脂质纳米粒,量取0.2 mL,置10 mL量瓶,用甲醇溶解,以甲醇为空白,在200~400 nm波长处紫外扫谱。结果见图1。可见在296 nm波长处,水杨酸有最大吸收峰,而空白固体脂质纳米粒无吸收,故选定296 nm作为水杨酸的测定波长。

图1 紫外扫描图
线性关系考察:精密称定水杨酸0.1 g,置100 mL量瓶中,甲醇溶解并定容,得质量浓度为1 g/L的对照贮备液,精密吸取不同体积的上述溶液,分别用甲醇稀释得质量浓度为8,12,16,20,24,28,32 μg/mL的系列溶液,于296 nm波长处测定吸光度(A)。以吸光度为纵坐标、质量浓度(C)为横坐标绘制曲线,线性回归方程为A=0.024 3 C+0.006 2,r=0.999 9(n=7)。结果表明,水杨酸质量浓度在8~32 μg/mL范围内与吸光度线性关系良好。
精密度试验:取质量浓度为20 μg/mL的对照品溶液,平行测定6次。结果吸光度的 RSD为0.2%(n=6)。
重复性试验:取同一批水杨酸固体脂体纳米粒样品(批号为20090507)5份各0.5 mL,置10 mL量瓶中,用甲醇稀释至刻度并测定吸光度。结果平均吸光度为0.589,RSD为1.1%(n=5),表明方法重现性良好。
稳定性试验:取质量浓度为20 μg/mL的对照品溶液,于不同时间点(0,2,4,8,24 h)测定。结果吸光度的 RSD 为 0.7%(n=5)。
回收率试验:精密量取空白固体脂体纳米粒0.5 mL 3份,置10 mL量瓶中,分别精密加入质量浓度约为32 μg/mL的对照品溶液 4,6,8 mL,用甲醇稀释至刻度,配成含水杨酸 12.8,19.2,25.6 μg/mL的样品溶液,依法测定,计算回收率。结果平均加样回收率为 101.4%(99.1% ~102.9%),RSD=1.5%(n=3)。
2.2.2 高效液相色谱法(动物体内试验样品含量测定)
色谱条件与系统适用性试验:色谱柱为ODS C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇 - 0.2% 磷酸水溶液(55 ∶45),流速为 1 mL/min,柱温 25 ℃,检测波长:230 nm,进样体积 20 μL。色谱图见图1,水杨酸出峰处无杂质峰干扰,表明该法可用于水杨酸的含量测定。
线性关素考察:精密吸取2.2.1线性关系考察项下对照贮备液,分别用甲醇稀释得质量浓度为 1,4,10,20,40,80,100 μg/mL的系列溶液,进样测定,以峰面积为纵坐标、质量浓度为横坐标绘制曲线并进行线性回归,线性方程为 Y=55.406 X-0.743 2,r=0.999 9(n=7)。结果表明水杨酸质量浓度在 1~100 μg/mL范围内与峰面积线性关系良好。
精密度试验:取质量浓度为10 μg/mL的对照品溶液,分别进样6次。结果峰面积的 RSD为0.03%(n=6)。
重复性试验:取同一水杨酸固体脂质纳米粒透皮试验样品5份,依法测定。结果样品中水杨酸平均质量浓度为15.02 μg/mL,RSD为1.0%(n=5),表明方法重现性良好。
稳定性试验:取质量浓度为10 μg/mL的对照品溶液,分别于0,2,4,8,24 h 时进样分析。结果峰面积的 RSD 为 0.3%(n=5)。
回收率试验:精密量取空白固体脂质纳米粒0.5 mL 3份,置10 mL量瓶中,分别精密加入质量浓度约为100 μg/mL的对照品溶液 2,4,8 mL,用甲醇稀释至刻度,配成含水杨酸 20,40,80 μg/mL的样品溶液,依法测定。结果平均加样回收率为100.9%(98.6% ~102.3%),RSD=1.1%(n=3)。
2.3 水杨酸固体脂质纳米粒包封率和粒径测定
采用葡聚糖凝胶微柱法[4]测定包封率。取5 mL注射器两支,去芯,分别加入4 mL葡聚糖凝胶制备微柱。分别精密量取0.2 mL水杨酸固体脂质纳米粒和水杨酸溶液,置葡聚糖凝胶微柱顶部,静置30 min后,以磷酸盐缓冲液进行洗脱,洗脱液以甲醇破乳并定容至10 mL,于296 nm波长处测定其吸光度,绘制曲线见图2。可见,洗脱体积至3 mL时,水杨酸可与水杨酸固体脂质纳米粒良好分离。
取 5 mL注射器,按上述方法制备葡聚糖凝胶微柱,加水杨酸固体脂质纳米粒0.2 mL后进行洗脱,收集洗脱液,甲醇破乳并定容;另精密量取水杨酸固体脂质纳米粒,甲醇破乳并定容。分别于296 nm波长处测定两者的吸光度,即 A1和 A2,计算包封率(%)=A1/A2×100%。
以电子显微镜观察,制备的水杨酸固体脂质纳米粒呈较均匀的球形,测定其载药量为 3.87%,包封率为46.4%,平均粒径为(380±35)nm。
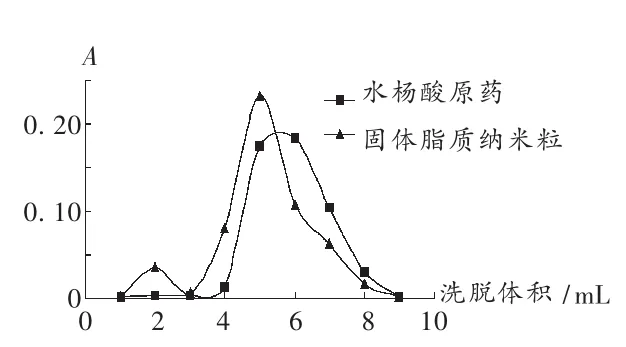
图2 不同体积洗脱液吸光度曲线图
2.4 体外透皮试验
大鼠乙醚麻醉后,用电动剃毛刀及剃须刀除去腹部毛,剥取腹部皮肤,除去皮下脂肪组织及黏连物,生理盐水冲洗干净,备用。将鼠皮固定在改良的Franz扩散池中间,角质层面向供给室。接受室中注入30%乙醇-生理盐水作为接受液,使液面恰好与皮肤内层接触。然后分别取水杨酸固体脂质纳米粒混悬液及水杨酸软膏,置皮肤表面,保持恒速搅拌和37℃的水浴恒温,分别在1,2,4,6,8,10,12,24 h时间隔取样2 mL,同时补充等体积释放液。采用高效液相色谱法测定水杨酸含量,计算累积渗透量。释药孔直径为1.3 cm,释药面积为 1.33 cm2,接受室体积为 17.5 mL。
取经透皮24 h后的大鼠皮肤,用生理盐水将皮肤表面洗净,以避免药液对试验结果的影响,沿有效透皮面积边缘剪下有效透皮皮肤。将皮肤剪碎,匀浆机绞碎,涡旋3 min后4 000 r/min离心30 min,取上清液,用乙醚进行萃取,共萃取3次,萃取液氮气吹干,甲醇溶解,离心后取上清液,采用高效液相色谱法测定残余药量。
水杨酸固体脂质纳米粒及软膏透过大鼠皮肤累积渗透量-时间动力学曲线图见图 3。可见,1)与软膏剂相比,固体脂质纳米粒显著增强了水杨酸的经皮透过率(P < 0.05),增渗倍数为5.87,水杨酸固体脂质纳米粒 24 h内累积透过量达 654.3 μg/cm2、透过率达34.8% ,而普通软膏 24 h 内累积透过量仅为 128.0 μg/cm2、透过率仅为6.2%,表明固体脂质纳米粒作为水杨酸经皮给药载体可有效促进药物的经皮吸收;2)水杨酸固体脂质纳米粒无突释现象,释药平稳,表明固体脂质纳米粒作为经皮给药载体有较好的缓释作用,从而使药物在较长时间内维持一定的有效浓度,可提高治疗效能和患者依从性;3)24 h透皮试验后,测定水杨酸固体脂质纳米粒的皮肤残余药量为22.99 μg,而软膏剂的皮肤残余药量仅为0.84 μg,说明固体脂质纳米粒作为水杨酸的载体可明显提高药物在大鼠腹部皮肤中的贮留量,增加了局部药物浓度,提高了皮肤靶向性,从而提高了药物治疗效能。
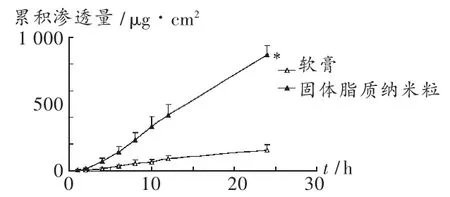
图3 水杨酸固体脂质纳米粒及软膏剂经皮渗透累积渗透量-时间曲线
3 讨论
本研究结果表明,与普通软膏剂相比,固体脂质纳米粒能显著增强药物的经皮透过率,并有明显的缓释效果,有效地提高了药物的治疗效能及患者用药的依从性;同时,固体脂质纳米粒还可增加药物在皮肤中的局部浓度,有利于对局部炎症和疼痛的治疗。
经皮给药系统常用的促渗方式为加入各种渗透促进剂。与促透剂作用机制不同,固体脂质纳米粒主要通过穿透、水合和融合机制透皮转运[5]。本研究结果表明,固体脂质纳米粒不仅能促进水杨酸透皮吸收,而且还可增加药物在局部的储量,这可能与固体脂质纳米粒经皮促渗机制有关。
常用的固体脂质纳米粒包封率测定方法有超速离心法[6]、葡聚糖凝胶柱法和超滤法[7]。由于脂质纳米粒的密度与水的密度非常接近,采用超速离心法时包封在纳米粒内的药物很难与游离药物分离;而超滤法的仪器较贵且不能反复应用,一般不作首选。本试验采用葡聚糖微柱离心法测定药物的包封率,结果表明,该法准确方便、操作简单,且重现性好。
[1]Hu FQ,Hong Y,Yuan H.Preparation and characterization of solid lipid nanoparticles containing peptide[J].Int J Pharm,2004,273(1 - 2):29 - 35.
[2]Li J,Dong AJ.Function of nanoparticles in transdermal and transmucosal drug delivery systems[J].Chin J Mater Med,2004,29(3):193 - 196.
[3]Wissing SA,Lippacher A,Muller RH.Investigations on the occlusive properties of solid lipid nanoparticles(SLN)[J].J Cosmet Sci,2001,52(5):313 -323.
[4]洪 慧,龙晓英,李力任,等.葡聚糖微型凝胶柱测定辣椒碱柔性脂质体包封率的条件探讨[J].广东药学院学报,2005,21(2):120-123.
[5]Mei Z,Chenh H,Weng T,et al.Solid lipid nanoparticle and microemulsion for topical delivery of triptolide[J].Eur J pharm Biopharm,2003,56(2):189-196.
[6]周学峰,张 娜,黄桂华,等.阿克他利固体脂质纳米粒的制备[J].中国药业,2006,15(10):30-32.
[7]李晨睿,蒋学华,袁 牧,等.口服葛根素固体脂质纳米粒的制备[J].华西药学杂志,2007,22(4):378 -380.

