活性污泥中Fe(Ⅲ)还原微生物的分离、鉴定及还原特性
任丽平,张 智,李柏林,谭 洪
1重庆大学城市建设与环境工程学院,重庆 400030;2西华师范大学生命科学学院,南充 637000
活性污泥中Fe(Ⅲ)还原微生物的分离、鉴定及还原特性
任丽平1,2,张 智1*,李柏林1,谭 洪2
1重庆大学城市建设与环境工程学院,重庆 400030;2西华师范大学生命科学学院,南充 637000
采用平板分离法和柠檬酸铁还原实验法相结合,从城市污水处理厂活性污泥中分离获得Fe(Ⅲ)还原菌F7,经形态观察、生理生化和16S rDNA序列分析及同源性比对鉴定为恶臭假单胞菌(Pseudomonas putida)。在不同柠檬酸铁浓度和不同pH条件下的实验表明,柠檬酸铁浓度为0.32 g/L时,菌株生长情况较好,柠檬酸铁浓度为0.16 g/L时,Fe(Ⅲ)异化还原比例较高;pH 6.5时,菌株生长情况较好,Fe(Ⅲ)异化还原量较多。
活性污泥;Fe(Ⅲ)还原微生物;系统发育分析;Fe(Ⅲ)异化还原
Fe(Ⅲ)还原微生物是具有Fe(Ⅲ)异化还原功能的一类微生物的总称,它与C、N循环,多种金属元素和非金属元素的转化紧密相关,能促进自然条件下难降解的有机污染物的氧化降解[1-6];还可以影响到除Fe(Ⅲ)之外的很多重金属以及放射性核素,使有毒的高价态还原为低价态或形成沉淀,使其毒性降低[7-9]。国内从2000年前后,逐渐关注了有关Fe(Ⅲ)还原微生物及其在环境污染治理中的作用[10-13],研究了Fe(Ⅲ)异化还原对水稻土壤中N、P、K、Si等营养元素的有效性和CH4,CO2及N2O形成的影响[14,15],而活性污泥中的Fe(Ⅲ)还原微生物的研究未见报道,其重要的生物修复功能未被开发。
随着我国城镇污水处理厂出水排放标准的进一步提高,水里的重金属的问题以及污泥的无害化处置面临更新、更高的要求。现今的城市污水厂多采用生物处理技术,对污水生物处理技术的改进从某种程度上依赖于高活性功能菌的获得及其性能的研究和开发利用,目前对于相关微生物的研究还不够成熟。由于Fe(Ⅲ)还原微生物具有强大的代谢功能和在生物修复中的强大优势,因而开展活性污泥中Fe(Ⅲ)还原微生物的分离和特性研究,具有重要的理论和现实意义。本实验从活性污泥中分离Fe (Ⅲ)异化还原菌,并对其进行生理生化特征、16S rDNA进化分析和Fe(Ⅲ)异化还原特性研究,旨在为丰富Fe(Ⅲ)还原微生物,充分利用含铁工业废水实现高效节能的污水处理、污泥处置和水体修复提供优质的菌种资源和理论基础。
1 材料和方法
1.1 材料
活性污泥取自城市污水处理厂厌氧段、缺氧段各2份,共4份。
1.2 培养基
PTYG培养基(每L):蛋白胨0.25 g,胰蛋白胨0.25 g,酵母膏0.5 g,葡萄糖0.5 g,MgSO4·7H2O 0.6 g,CaCl2·2H2O 0.07 g,琼脂粉10 g,pH 7.0。
LB液体培养基(每L):NaCl 10 g,酵母粉5 g,蛋白胨10 g,pH 7.0。
柠檬酸铁液体培养基(每L):柠檬酸铁0.34 g,NH4Cl 0.1 g,CaCl2·2H2O 0.007 g,MgSO4·7H2O 0.06 g,K2HPO4·3H2O 0.0733 g,KH2PO40.025 g,葡萄糖1g,pH6.5-7.0。
1.3 菌株的分离及纯化
分别取4份活性污泥原液逐级稀释至10-4,将稀释后的活性污泥分别加于PTYG液体培养基中,厌氧避光27℃培养2 d,然后涂布于PTYG固体培养基上,厌氧避光27℃培养,挑取单菌落纯化至菌落特征一致,无异常菌落出现者,然后于LB液体培养基厌氧避光27℃培养。将培养后的菌液各取750 mL于离心管3000 rpm离心15 min,弃去上清液,用无菌水洗2次,再用750 mL无菌水悬浮沉淀制得菌液,各吸取10 μL转入装有柠檬酸铁液体培养基中,厌氧避光27℃培养3 d。
挑取培养过程中柠檬酸铁液体培养基由黄绿色逐渐变为白色的菌株转接于LB液体培养基中,27℃厌氧培养1 d后,于4℃保存备用。
1.4 菌株的生理生化鉴定
观察菌株的菌落在培养基上的形状、大小、颜色、粘稠度、透明度、边缘和隆起情况,根据《常见细菌系统鉴定手册》、《伯杰氏细菌学鉴定手册》和《一般细菌常用鉴定方法》进行菌株生理生化鉴定。
1.5 菌株的16S rDNA分析
提取细菌总DNA[16],以总DNA为模板扩增其16S rDNA。PCR反应体系(50 μL):无菌去离子水37.5 μL,10×Buffer 5.0 μL,MgCl23 μL,10 mmol/L dNTPs 1.0 μL,10 μmol/L引物 1(5’-CCGAATTCGTCGACAACAGAGTTTGATCCTGGCTCAG-3’) 1.0μL,引物2(5’-CCCGGGATCCAAGCTTAAGGAGGTGATCCAGCC-3’)1.0 μL,Taqplus聚合酶(5 U/ μL)0.5 μL,模板DNA 2 μL。反应程序:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸10 min,30个循环,72℃继续延伸5 min,4℃保温2 h。PCR反应产物经1.0%琼脂糖凝胶电泳EB染色后,用紫外分析仪检测。用上海生工的 UNIQ-100DNA胶纯化试剂盒回收琼脂糖凝胶上的PCR产物,用TaKaRaPMD19-T载体试剂盒进行连接(操作方法按试剂盒说明),转化Escherichia coliDH5的感受态细胞,然后在含氨苄青霉素Amp/IPTG/Xgal的平板上筛选白斑,并进行菌体PCR初步检测,再经碱裂解法提取质粒,其产物进行电泳检测。16S rDNA的测序由上海生工完成。用BLAST软件,将测定得到的16S rDNA全序列递交于GenBank,并与GenBank/EMBL/DDBJ中的已知序列进行同源性分析。
1.6 不同Fe(Ⅲ)浓度菌株的生长及特性测定
活化菌株,分别接种于铁浓度为0.64、0.32、0.16 g/L的柠檬酸铁培养液(pH7.0)中,并设置无铁对照组,厌氧避光27℃静置培养,每5 h测定培养基中上清液Fe(Ⅱ)浓度和菌OD值。
1.7 不同pH条件下菌株的生长及特性测定
活化菌株,分别接种于pH为6.0、6.5、7.0、7.5、8.0的柠檬酸铁培养液(铁浓度均为0.32g/L)中,厌氧避光27℃静置培养,每5 h测定培养基中上清液Fe(Ⅱ)浓度和菌OD值。
2 结果与讨论
2.1 Fe(Ⅲ)异化还原菌的分离和鉴定
在4份样品中分离纯化出8个形态不同的菌落,其中3个菌落来源于厌氧段活性污泥,5个菌落来源于缺氧段活性污泥。柠檬酸铁液体培养基厌氧培养7 d,来源于缺氧段活性污泥、编号为F7的菌液的颜色完全变白,表明柠檬酸铁被还原,菌株F7具有还原Fe(Ⅲ)的功能。
菌株F7在PTYG固体培养基上培养,菌落特征为圆形,表面光滑,边缘平整,不透明,湿润。显微镜下观察菌体形态短杆状、稍有弯曲,运动活泼,成波浪式运动或翻转运动。革兰氏染色呈阴性,芽孢染色呈阴性。生理生化反应结果见表1,经biolog鉴定,菌株 AP3属于Pseudomonas putida,相似度为0.933,属于革兰氏阴性非肠道菌。
在GenBank上用Blast程序对菌株F7进行核苷酸同源性比对,菌株F7与Pseudomonas putidastrain J312的同源性为99.8%,将菌株F7序列和下载的16S rDNA序列通过ClusrerW进行聚类分析后,利用MEGA4.0软件以Neighbor-Joining计算方式生成系统发育进化树(距离计算采用Jukes-Cantor模式)如图1,可以看到菌株F7与菌株Pseudomonas putidastrain J312聚到一起,亲缘关系较近。根据生理生化实验和16S rDNA序列分析及同源性比对确定菌株F7为Pseudomonas putida。
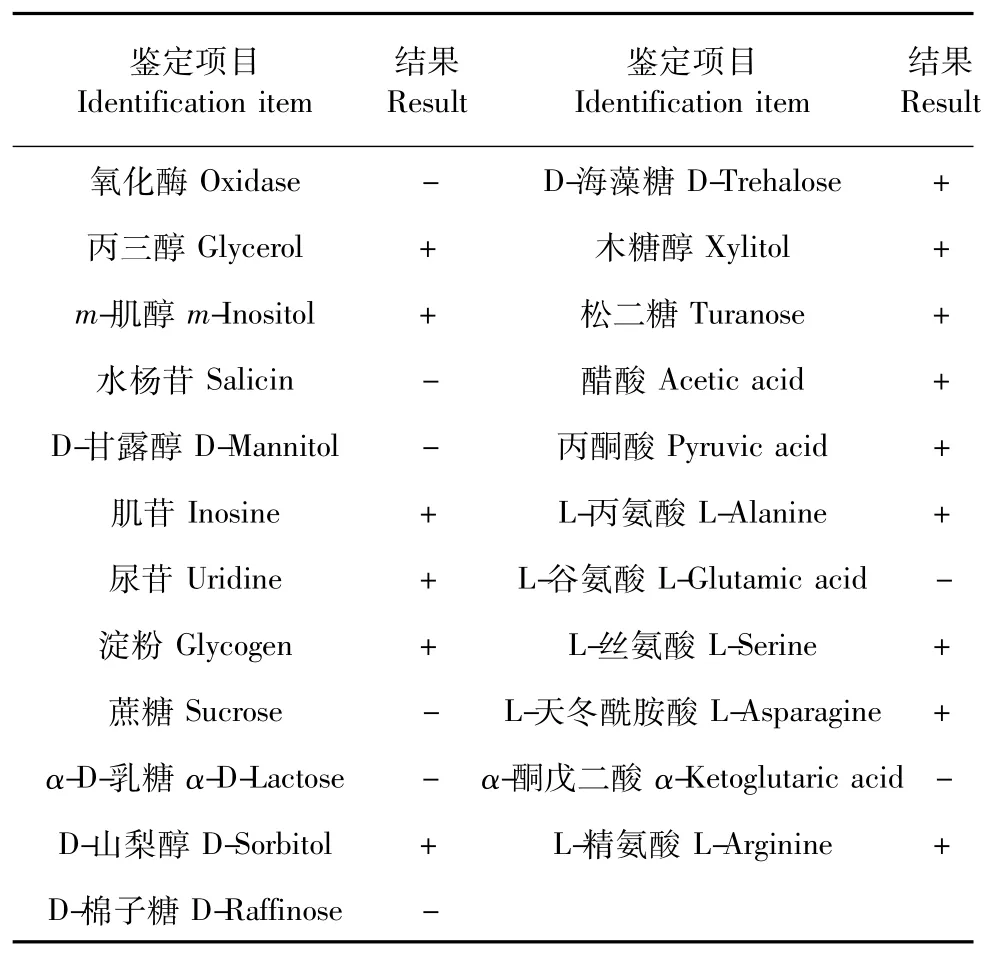
表1 BIOLOG细菌鉴定仪鉴定的菌株的生理生化特征Table 1 Physiological biological characteristics of strain by BIOLOG bacteria identification instrument
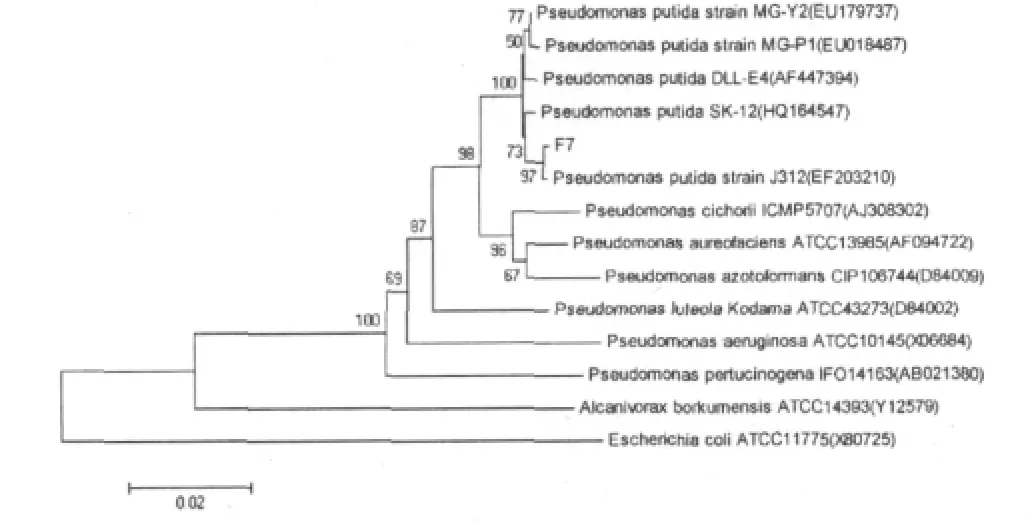
图1 基于假单胞菌属内16S rDNA序列同源性构建的系统发育树Fig.1 Phylogenetic tree based on 16S rDNA sequences homology ofPseudomonassp.
活性污泥中假单胞菌属(Pseudomonas)的菌株多次被分离鉴定,Brodishch[17]等的研究表明,除磷活性污泥中的优势菌是假单胞菌属和气单胞菌属,假单胞菌属是厌氧/好氧条件下的主要菌种之一,并在试验过程中一直保持着较为稳定的优势地位。人们主要关注了活性污泥中假单胞菌属的聚磷特性[18-20],而本实验筛选的恶臭假单胞菌F7具有Fe (Ⅲ)异化还原功能,以其作为研究对象,对进一步研究污水处理和污泥处置问题具有一定的代表性和创新性。
2.2 不同铁浓度条件下菌的生长曲线及Fe(Ⅲ)异化还原特性

不同铁浓度条件下的实验表明,柠檬酸铁浓度为0.32 g/L时,菌生长情况最好,其他次之(见图2);与无铁对照组比较,柠檬酸铁促进了菌的生长。如图3所示,Fe(Ⅱ)浓度经历了一个由缓慢变化到开始明显增长的过程,这与水稻土中铁的微生物还原特征相似[15],这主要是因为Fe(Ⅲ)成为厌氧条件下的主要电子受体和菌的生长以及铁还原活性的恢复都需要一定时间,即Fe(Ⅲ)的异化还原有一个启动期,本实验中,启动期约10 h。在之后的10~25 h快速还原期中,柠檬酸铁浓度为0.16 g/L时的Fe(Ⅲ)异化还原速率较柠檬酸铁浓度为0.32 g/L和0.64 g/L时的Fe(Ⅲ)异化还原速率低;以产生的Fe(Ⅱ)的浓度与Fe(Ⅲ)初始浓度之百分比作为Fe(Ⅲ)还原比例,见图4,Fe(Ⅲ)还原比例随Fe (Ⅲ)浓度的增加而下降。
由于城市污水处理厂往往添加以Fe(Ⅲ)为主要成分的化学药剂改善除磷效果,一些工业废水中也含有Fe(Ⅲ),使得Fe(Ⅲ)在活性污泥中大量存在,成为厌氧条件下有机物氧化最重要的电子受体。在铁还原微生物的异化作用中,Fe(Ⅲ)被用作电子受体,还原产生Fe(Ⅱ),能偶联多种有机物的氧化。因此活性污泥中高活性的铁还原微生物为污水处理和污泥处理中的生物修复提供了广阔的前景。
2.3 不同pH条件下菌的生长曲线及Fe(Ⅲ)异化还原特性

微生物有其最佳生长pH,酶促还原也要求有最佳的反应pH,因此环境中的pH会直接影响到Fe (Ⅲ)异化还原过程,同时pH还会影响到Fe(Ⅲ)的存在形态,在酸性条件下可存在大量可溶性的Fe (Ⅲ),增加了微生物利用Fe(Ⅲ)进行呼吸获能的优势。本实验表明,菌株F7在pH 6.5时生长得最好,随pH 7.0、pH 6.0、pH 7.5、pH 8.0顺序下降,见图5。如图6,Fe(Ⅲ)异化还原情况在pH 6.5时最佳,随pH 6.0、pH 7.0、pH 7.5、pH 8.0依次下降。
3 结论与展望
该实验从活性污泥中分离得到Fe(Ⅲ)还原微生物F7,根据生理生化实验和16S rDNA序列分析及同源性比对确定菌株F7为Pseudomonas putida。进一步实验表明,菌株F7有较强的Fe(Ⅲ)还原能力,柠檬酸铁浓度为0.16 g/L时Fe(Ⅲ)异化还原比例较高,柠檬酸铁浓度为0.32 g/L时,菌生长情况较好;pH 6.5时,菌株生长情况和Fe(Ⅲ)异化还原情况较好。
该研究初步揭示了活性污泥中的Fe(Ⅲ)还原微生物及还原特性,异化Fe(Ⅲ)还原在污染环境的生物修复中具有重要优势,国外在能源、环境等领域进行了具有重要应用价值的前沿性研究。国内的研究处于起步阶段,今后结合污水处理的运转特点,加强利用Fe(Ⅲ)还原微生物改良污水处理效果和污泥处置的研究具有重要的现实价值。
1 Lovley DR,Holmes DE,Nevin KP.Dissimilatory Fe(Ⅲ) and Mn(Ⅱ)reduction.Adv Microbial Physiol,2004,49:199 -286.
2 Michael McCormick,Michael Gerdenich,Lin-Shun Kao,et al.Geochemistry of Hydrous Ferric Oxide Reduction by Geobacter metallireducens:Implications for Sustained Dechlorination of Tetrachloro methane.Cambridge Publications:J Conference Abs,2000,5:685.
3 Lovley DR,Anderson RT.Influence of dissimilatory metal reduction on fate of organic and metal contaminants in the subsurface.Hydrogeology J,2000,8:77-88.
4 Nevin KP,Lovley DR.Mechanism for Fe(Ⅲ)reduction in sedimentary environments.Geomicrobiol J,2002,19:141-159.
5 Pearce CI,Lloyd JR,Guthrie JT.The removal of colour from textile wastewater using whole Bacterial cells:a review.Dyes Pigment,2003,58:179-196.
6 Stucki JW.Redox Processes In Smectite:Soil Environmental Significance.Adv.In GeoEcology.1997,30:395-406.
7 Lovley DR,Kashefi K,Vargas M,et al.Reduction of humic substances and Fe(Ⅲ)by Hyperthermophilic microorganisms.Chern Geol,2000,169:289-298.
8 Hoden JF,Adams MW.Microbe-metal interactions in marine hydrothermal environments.Curr Opin Chem Biol,2003,7: 160-165.
9 Bose P,Sharma A.Role of iron in controlling speciation and mobilization of arsenic in subsurface environment.Water Res,2002,36:4916-4926.
10 He JZ(贺江舟),Qu D(曲东),Zhang LL(张莉利).Dissimilatory Fe(III)reduction by microorganisms.Microbiology,2006,33:158-164.
11 Xu MY(许玫英),Guo J(郭俊),et al.Dissimilatory Fe (Ⅲ)reduction and its applications in contaminants treatment.Microbiology,2007,34:132-137.
12 Chi GY(迟光宇),Chen X(陈欣),Shi Y(史奕),et al.Environmental benefits of soil Fe(Ⅲ)dissimilatory reduction.J Agro-Environ Sci,2010,29:273-277.
13 Tan PY(谭佩盈),Zheng P(郑平),Jiang X(姜辛).Organic contaminants bio-degradation with Fe(Ⅲ).J ZhejiangUniv,2002,28:350-354
14 Cao N(曹宁),Qu D(曲东).The relationship between iron oxides reduction and inorganic phosphorus availability in four paddy soils of China.Chin J Soil Sci,2007,(3):504-507.
15 Qu D(曲东),He JZ(贺江舟),et al.Effect of iron oxide addition on inhibition of CH4,CO2and N2O in anaerobic paddy soil.J Northwest Sci-Technol Univ Agric Forest(Nat Sci Ed),2005,33:97-101.
16 Bastin DA,Reeves PR.Gene,1995,164:17-23.
17 Brodishch KEU,Joyner SJ.The role of microorganisms other than acinetobacter in biological phosphorus removal in activated sludge process.Water Sci Technol,1983,15:117-125.
18 Fu YG(傅以钢),Dai R(戴睿),Liu HB(刘洪波),et al.Influence of community structure of phosphorus removing bacteria under oxygen contain in processes for phosphorus removal.Environ Sci,2008,29:475-481.
19 Zhang B(张斌),Sun BS(孙宝盛),Ji M(季民),et al.A-nalysis and succession of microbial community structure in a membrane bioreactor.Acta Sci Circum,8(11):2192-2199.
20 Zhou YX(周岳溪),Chen FR(陈仿荣),Qian Y(钱易),et al.Study on the mechanism of uptake and release of phosphate byPseudomonassp.Chin J Ecol,14:212-215.
Isolation and Identification of Fe(Ⅲ)Reducing Bacteria from Activated Sludge and Their Reducing Characteristics
REN Li-ping1,2,ZHANG Zhi1*,LI Bo-lin1,TAN Hong2
1College of Urban Construction and Environmental Engineering,Chongqing University,Chongqing 400030,China;2College of Biolojical Sciences,China West Normal University,Nanchong 637000,China
A ferric reducing microorganism strain F7 was isolated from activated sludge taken from wastewater treatment plant through dilution-plate method and ferric citrate reduction.By means of the morphology,physiology and the 16S rDNA sequence analysis and homology comparison,strain F7 was identified asPseudomonas putida.Different ferric citrate fluid medium concentration and different pH experiments showed that strain F7 growed well with 0.32 g/L ferric citrate,and Fe(Ⅲ)reduction ratio was high with 0.16 g/L ferric citrate,and the bacteria growth and Fe(Ⅲ)reduction quantity were well with pH 6.5.
activated sludge;ferric reducing microorganism;phylogenetic analysis;dissimilatory Fe(Ⅲ)reduction
X172
A
1001-6880(2012)05-0627-05
2011-10-19 接受日期:2012-02-10
国家“十一五”科技重大专项——三峡库区城市污水处理厂功能提升与污泥处理处置技术研究与综合示范(2009ZX07315-002)
*通讯作者 Tel:86-013808350890;E-mail:zhangzhicq@126.com

