羌活药材活性成分的提取工艺研究
石海利,蒋舜媛,徐凯节,张艳侠,周 毅,宋美凤,彭树林*
1中国科学院成都生物研究所;2四川省中医药科学院中药材品质与创新中药四川省重点实验室,成都 610041
羌活药材活性成分的提取工艺研究
石海利1,蒋舜媛2,徐凯节1,张艳侠1,周 毅2,宋美凤2,彭树林1*
1中国科学院成都生物研究所;2四川省中医药科学院中药材品质与创新中药四川省重点实验室,成都 610041
选择提取次数、溶剂倍数、提取时间为考察因素,以提取浸膏量及三种主要活性物质(紫花前胡苷、异欧前胡素、羌活醇)含量为考察指标,探讨羌活药材活性成分的乙醇加热回流提取工艺。在首先考察单因素对提取效果影响的基础上采用正交试验法,优选出羌活药材活性成分的最佳提取工艺参数:加6倍量95% 乙醇,加热回流提取3次,每次提取时间为1 h。
羌活;提取工艺;正交试验;活性成分
羌活(Notopterygium incisumTing ex H.T.Chang)为我国特有的伞形科草本植物,其根茎及根为羌活药材的主要来源,具有解表散寒、祛风除湿、止痛的功效,主要用于治疗风寒感冒、头痛项强、风湿痹痛、肩背酸痛等症[1]。近代药理学研究表明,羌活药材具有明显的镇痛、抗炎、改善血液循环及增强肌体免疫功能的作用,其主要活性成分是以羌活醇、紫花前胡苷、异欧前胡素为代表的香豆素类化合物[2-4]。
目前国内外关于羌活提取工艺已有报道[3,5,6],但其在研究中仅以紫花前胡苷为考察指标,不能完全反映提取物的质量。所以我们考虑在此基础上对羌活药材的提取工艺进行改进。考虑到规模化生产中成本、效率、安全及产品质量等方面问题,本文采用加热回流的提取方法,选用乙醇为溶剂,以挥发油含量、羌活醇、异欧前胡素和紫花前胡苷为检测指标,进行正交实验优选工艺参数,从而为羌活提取物的工业化生产提供安全、环保、高效的工艺参数和方案,为羌活药材资源的高效利用提供技术支持。
1 材料与方法
1.1 材料与仪器
实验样品为从四川省小金县两河乡大板村收购的2010年秋季产野生晒干样品,经四川省中医药科学院蒋舜媛老师鉴定为羌活(N.incisum)。
METTLER AE 240电子天平;HHS电热恒温水浴锅(上海医疗器械五厂);BUCHI R-114旋转蒸发仪(德国);WP-15型循环水式真空泵(日本);Finnigan LCQDECA型液质联用仪;所用试剂均为分析纯。
1.2 实验方法
1.2.1 高效液相色谱条件及方法学考察
1.2.1.1 仪器条件
高效液相色谱仪部分为TSP公司Spectra system液相色谱仪(包括 SCM1000真空脱气机、ASM3000自动进样器、P4000四元梯度泵、UV6000LP二极管阵列紫外-可见检测器)。色谱柱:TIANHE kromasil C18(5 μm,250 mm×4.6 mm);流动相条件:甲醇和0.1%乙酸水溶液梯度洗脱(甲醇比例由35%到87.5%缓慢梯度变化)。柱温:35℃;检测波长:330 nm;流速:0.7 mL/min;进样量:20 μL。
1.2.1.2 对照品溶液制备
分别精密称取3个对照品各5 mg,分别置于5 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,配制对照品储备液。分别精密吸取适量对照品储备液混合并用甲醇定容至5 mL容量瓶中,制成混合对照品储备液。
1.2.1.3 标准曲线和线性范围
精密依次吸取混合对照品储备液8个不同质量浓度进行HPLC分析,在上述色谱条件下检测峰面积,同一质量浓度连续测定3次,3种成分均以质量浓度为横坐标(X),平均峰面积为纵坐标(Y)进行线性回归,相关系数与线性范围见表1,对照品储备液继续稀释,分别在信噪比为3和10时得到检测限(limit of detection,LOD)和定量限(limit of quantitation,LOQ),相应的数据见表1。
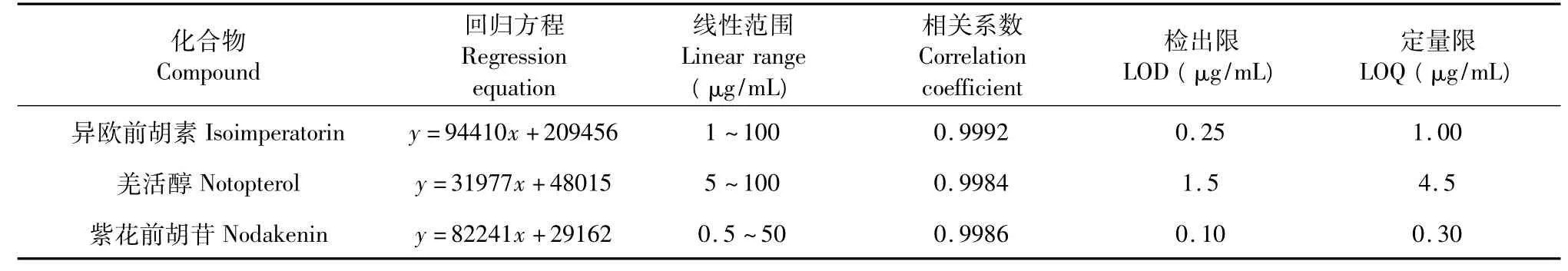
表1 标准品1~3的标准曲线方程、相关系数、线性范围、LOD和LOQTable 1 Regression equation,correlation coefficients,linearity ranges,LOD and LOQ for the three markers of N.incisum
1.2.1.4 精密度试验
日内精密度试验:在上述色谱条件下,将混标溶液在一天内共测定6次,计算得各标准品的保留时间和峰面积的 RSD分别在0.31% ~0.66%和1.01%~1.82%范围内。
日间精密度试验:在上述色谱条件下,将混标溶液连续三天,每天进样两次,计算得各标准品的保留时间和峰面积的RSD分别在0.32% ~0.75%和1.58%~2.22%范围内。
1.2.1.5 加样回收率试验
精密称取羌活粗粉5份,各0.5 g,分别加入一定量的对照品1~3,按上述提取方法和色谱条件平行提取和分析测定,被分析的对照品的总量由回归曲线求得,对照品1~3的平均加样回收率分别为93.7%、95.5% 和96.7%,RSD分别为3.39%、2.94%和2.65%。
1.2.2 单因素实验方法及结果
1.2.2.1 溶剂浓度的考察及结果
定量称取样品3份,每份80 g,分别用65%、80%和95%乙醇320 mL(料液比为1∶4)加热回流提取一次,时间为1.5 h,过滤,蒸干,称重,得浸膏。定量取出一部分浸膏用甲醇定容至25 mL容量瓶,取2 mL样品溶液用0.45 μm微孔滤膜滤过,得供试品溶液。HPLC定量测定异欧前胡素、羌活醇和紫花前胡苷的含量,水蒸气蒸馏法测定总浸膏中挥发油的含量,结果见图1和2。

1.2.2.2 提取次数的考察及结果
定量称取样品4份,每份20 g,用80 mL 95%乙醇分别提取1次、2次、3次和4次,每次时间为120 min,过滤,蒸干,称重,得浸膏。定量取出一部分浸膏用甲醇定容至25 mL容量瓶,取2 mL样品溶液用0.45 μm微孔滤膜滤过,得供试品溶液。HPLC定量测定异欧前胡素、羌活醇和紫花前胡苷的含量,结果见图3。

图3 三种主要成分的含量随提取次数变化曲线图Fig.3 Effects of times of extraction on the three main components
1.2.2.3 提取时间的考察及结果
定量称取样品5份,每份20 g,用95% 乙醇80 mL分别提取60、90、120、150和180 min,过滤,蒸干,称重,得浸膏。并定量取出一部分浸膏用甲醇定容至25 mL容量瓶,取2 mL样品溶液用0.45 μm微孔滤膜滤过,得供试品溶液。HPLC定量检测异欧前胡素、羌活醇和紫花前胡苷的含量,结果见图4。
1.2.3 提取工艺的优化
1.2.3.1 正交试验设计
在单因素实验的基础上,选择提取次数(A)、溶剂倍数(B)、提取时间(C)三个因素,每因素根据单因素实验结果各选三水平进行正交试验,以所得浸膏重量及浸膏中的羌活醇、异欧前胡素和紫花前胡苷三种主要成分含量为指标,采用L9(34)正交表安排试验,因素水平见表2。

图4 三种主要成分的含量随提取时间变化曲线图Fig.4 Effects of extraction duration on the three main components
1.2.3.2 正交实验中羌活的提取和测定指标方法
精密称取干燥的羌活粗粉20 g,加入95% 乙醇,加热回流提取,过滤,合并提取液,减压浓缩至干,称量所得干浸膏重量并用HPLC法对羌活醇、异欧前胡素和紫花前胡苷的含量进行测定,并计算三种物质的总量。
综合评分(F):根据实际情况将干浸膏重量(X)、三种物质总量(Y)的权重系数分别定为0.8、0.2。分别以X项、Y项中各自的最大值为80、20分作为比较,计算公式如下:综合评分(F)=(X/ Xmax)×80+(Y/Ymax)×20
2 结果与分析
2.1 正交实验结果
设计正交试验表头和实验结果见表2~4。

表2 正交试验因素与水平表Table 2 Factors and levels of orthogonal test

表3 羌活提取工艺正交实验结果Table 3 Results of orthogonal test

3 1 3 3 3 5.7636 0.2303 82.61 4 2 1 2 3 5.3868 0.2761 81.23 5 2 2 3 1 6.0981 0.2972 90.95 6 2 3 1 2 6.3678 0.3026 94.46 7 3 1 3 2 5.7895 0.1952 80.60 8 3 2 1 3 6.8419 0.2735 98.08 9 3 3 2 1 6.7615 0.1739 90.55 K1/3 75.837 76.263 86.500 82.820 K2/3 88.880 88.990 83.240 84.333 K3/3 89.743 89.207 84.720 87.307 R 13.906 12.944 3.260 4.487
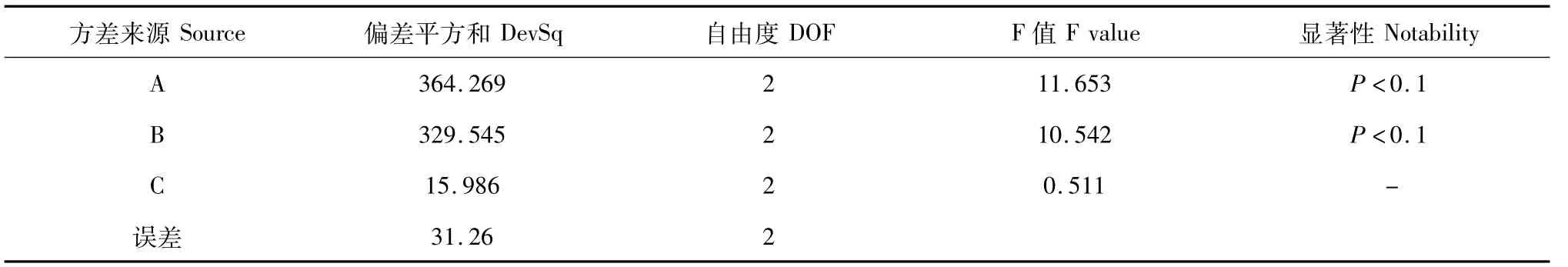
表4 提取工艺正交实验方差分析表Table 4 Analysis of variance
2.2 正交实验结果分析
通过正交实验结果的直观分析和方差分析,各因素对实验结果影响的程度依次为:A>B>C。即影响最大的是提取次数,A3为最优水平;其次为溶剂倍数,B3为最优水平,均对结果有较显著性影响(P<0.1);提取时间对结果影响不显著(P>0.1)。由以上数据得出最佳提取条件为:A3B3C1。即提取4次,乙醇用量8倍量,提取时间为1 h。本项研究的目的是使其能工业化生产,从工业规模化生产的效率、能耗、成本等综合考虑,A3与A2、B3与B2间的差异甚微,因此选择最佳的提取方案为A2B2C1。
2.3 验证实验
精密称取干燥的羌活粗粉20 g,加入95%乙醇,按最佳提取方案A2B2C1进行验证实验,实验结果得干浸膏6.8550 g;羌活醇、异欧前胡素和紫花前胡苷三种物质总量为0.3097 g。
3 结论与讨论
3.1 结论
通过正交实验,并结合工业规模化生产的效率、能耗、成本等因素,得出羌活提取物的最佳提取方案为A2B2C1。即:用6倍量95% 乙醇,加热回流提取3次,每次1 h。
3.2 讨论
3.2.1 羌活醇为羌活属植物的特征化合物,异欧前胡素和紫花前胡苷也是羌活中的主要成分,其中紫花前胡苷为常用鉴定指标。羌活醇和异欧前胡素以及挥发油含量在各类研究报道及我国药典中常被作为羌活药材品质检测的指标成分[1,6],因此以这三种物质的含量和所得浸膏量作为提取效果衡量的指标,可较为客观地评价羌活乙醇提取物的质量。
3.2.2 本项研究考虑了浸膏中挥发油的含量,且羌活醇和异欧前胡素均为脂溶性成分,结合单因素研究结果,在正交试验中没有对溶剂浓度进行考察,只用95%乙醇作提取溶剂。
1 Pharmacopoeia Commission of People’s Republic of China (中华人民共和国卫生部药典委员会).Pharmacopoeia of People’s Republic of China,Part I(中华人民共和国药典,一部).Beijing:Chemistry Industry Press,2010.170-171.
2 Li YX(李云霞),Gao CH(高春华).Progress in researches on the chemical constituents and pharmacological activities ofNotopterygium incisum.J Liaoning Coll Tradit Chin Med(辽宁中医学院学报),2004,6:22-23.
3 Wu YQ(吴亦琴),Chen MM(陈明明),Zhao ZH(赵宗惠),et al.Progress in researches onNotopterygium incisum.Chin J Lab Med Educ(检验医学教育),2005,12:33-35.
4 Zheng HZ(郑虎占),Dong ZH(董泽宏),She J(佘靖).Modern Study of Traditional Chinese Medicine(中药现代研究与应用).Beijing:Academy Press,1998.3005-3013.
5 Guo YH(郭晏华),Sha M(沙明),Meng XS(孟宪生),etal.The industrial research of the coumarin ofNotopterygium incisumextracted by supercritical CO2.China J Chin Mater Med(中国中药杂志),2002,27:384-385.
6 Zhang HP(张红萍),Tan Y(覃燕),Sun YF(孙友富).Orthogonal array design for optimizing extraction technique ofNotopterygium incisum.J Chin Med Mater(中药材),1996,19:370-371.
Study on Extraction Technology of Bioactive Components from Notopterygium incisum
SHI Hai-li1,JIANG Shun-yuan2,XU Kai-jie1,ZHANG Yan-xia1,ZHOU Yi2,SONG Mei-feng2,PENG Shu-lin1*
1Chengdu Institute of Biology,Chinese Academy of Sciences,Chengdu 610041,China;2Sichuan Key Laboratory of Quality and Innovation Research of Chinese Materia Medica,Sichuan Academy of Chinese Medicine Sciences,Chengdu 610041,China
To optimize the extracting procedure forNotopterygium incisum,orthogonal design was carried out.Taking the amount of solvent,times of extraction and extraction duration as the test factors and the amount of extract,nodakenin,isoimperatorin and notopterol as the test indexs,the L9(34)orthogonal design was used to optimize the extraction technology ofN.incisum.The results showed that the best extraction technology was as follows:refluxing extraction with 6 times of 95%alcohol for 3 times(1 h each time).
Notopterygium incisum;extracting procedure;orthogonal array design;bioactive component
R284.2;Q946.91
A
1001-6880(2012)05-0687-05
2011-07-01 接受日期:2011-11-23
科技部“重大新药创制”科技重大专项课题(2009ZX09308-002,2009ZX09103-439);四川省科技攻关项目(07SG003-006)
*通讯作者 Tel:86-28-85223843;E-mail:pengsl@cib.ac.cn

