地塞米松、FK-506和CX-659s对TARC产生的调控作用研究*
于 彬 ,方素萍 ,刘 翔 ,宋 坪 ,董茂盛
(1.中国中医科学院广安门医院国际医疗部,北京 100053;2.中国人民解放军第二炮兵总医院肝胆胃肠研究所,北京 100088)
趋化因子是一组由70~90个氨基酸组成的小分子量蛋白质,在免疫及炎性反应过程中对白细胞的正向趋化和浸润起到重要作用[1]。胸腺活化调节趋化因子(TARC/CCL17)基因位于人第16条染色体,归属于β趋化因子,简称为CC趋化因子,其N末端有2个连续排列的丝氨酸。TARC可与CD4+CD45RO+记忆T细胞的一部分——Th2细胞表达的CCR4受体结合,诱导Th2细胞向炎症部位趋化。树突状细胞[2]、角质形成细胞[3],成纤维细胞[4]等均可产生TARC。众所周知,异位性皮炎等过敏性皮肤疾病的病变部位存在Th2细胞的大量浸润,产生TARC等趋化因子,诱导CCR4介导的Th2细胞向炎症部位浸润[5]。临床常应用地塞米松、他克莫司(FK-506)[6]和CX-659s[7]治疗异位性皮炎等过敏性皮肤疾病,抑制皮肤局部炎性反应,抑制外周单核细胞TARC的表达。但是它们对皮肤的两种主要结构性细胞——皮肤角质形成细胞和成纤维细胞的作用机制尚不明了。本试验通过体外试验研究这几种临床常用药物对皮肤角质形成细胞和成纤维细胞产生TARC的调控作用,报道如下。
1 材料与方法
1.1 试药
TARC ELISA kit(R&D公司);白细胞介素4(IL-4)、干扰素γ(IFN-γ)均为Sigma公司产品,批号为200-04;肿瘤坏死因子α(TNF-α)为 PeproTech公司产品,批号为 300-01A);TARC(R&D公司,批号为277131);地塞米松(Sigma公司,批号为D1756);FK-506和CX-659s(日本藤泽药品工业株式会社、日本兴和株式会社,批号为D73003)。地塞米松、FK-506和CX-659s分别用丙酮、二甲基亚砜稀释。
1.2 细胞培养
人角质形成细胞株 HaCaT 细胞,由 Dr.N.E.Fusenig,DKFZ,Heidelberg转让;人成纤维细胞NG1RGB细胞从日本理化研究所购入,由协和发酵工业株式会社购买。HaCaT细胞及EL4细胞、NG1RGB细胞分别在含10%灭活牛胎儿血清、青霉素(100 U/mL)、红霉素(100 g/mL)的 DMEM、RITC80-7和 RPMI1640培养液中,5%CO2,37℃状态下培养。HaCaT细胞和NG1RGB细胞分别以4×105,2×106个/mL浓度播种在24、6孔培养皿中,培养24 h,更换全部培养液。HaCaT细胞中加入地塞米松(10-9~10-5mol/L)、FK-506(10-12~10-5mol/L)或 CX-659s(10-6~10-2mol/L),加入 IFN-γ(100 ng/mL)刺激,培养 48 h,取上清,15 000 r/min离心3 min,-80℃冻结保存,直至ELISA法检测TARC蛋白质浓度。NG1RGB 细胞中加入地塞米松(10-9~10-5mol/L)、FK -506(10-9~10-5mol/L)或 CX -659s(10-6~10-2mol/L),加入IL-4(10 ng/mL)、TNF-α(50 ng/mL)和/或 IFN-γ(100 ng/mL)刺激,培养48 h,取上清,余同HaCaT细胞操作。
1.3 统计学处理
采用SPSS 17.0统计软件进行统计学分析,用药前后及组间配对资料应用 t检验,疗效用 χ2检验,α=0.05为检验水准。
2 结果
2.1 对HaCaT细胞产生TARC的调控作用
HaCaT细胞培养48 h后,培养上清中产生117.01 pg/mL的TARC,10-9~10-5mol/L 的地塞米松表现出明显抑制作用,而FK506和CX-659s未见此作用(图1)。进一步用IFN-γ刺激HaCaT细胞,促使其产生TARC,3种药物的作用浓度分别为10-12~10-6mol/L(地塞米松),10-12~10-6mol/mL(FK -506)和 10-6~10-2mol/L(CX -659s),见图 2。
IFN-γ刺激下,HaCaT细胞产生TARC水平明显增加,与空白对照组相比,P<0.001;各种浓度的地塞米松作用效果虽然没有达到空白对照组水平,但IFN-γ刺激组均显示出抑制效果(**P <0.01,***P <0.001);各种浓度的 FK -506 作用效果虽然没有达到空白对照组水平,但IFN-γ刺激组显示出抑制效果(**P <0.01,***P <0.001);各种浓度的 CX -659s未见抑制效果,虽然10-2mol/L浓度作用下,TRAC产生明显减少,但无统计学意义。
2.2 对NG1RGB细胞产生TARC的影响
NG1RGB细胞在 IL-4,TNF-α,IFN-γ作用下产生 TARC。本试验证明,地塞米松在10-7mol/L浓度下表示轻度抑制作用(*P <0.05);FK506 在 10-9~10-5mol/L 浓度未见抑制作用;CX-659s在 10-5~10-2mol/L浓度时表现出抑制作用,随浓度增高,抑制作用相应增强。见图3。
3 讨论

图1 对HaCaT细胞TARC表达的影响

图2 IFN-γ刺激下,3种药物对HaCaT细胞TARC表达的影响
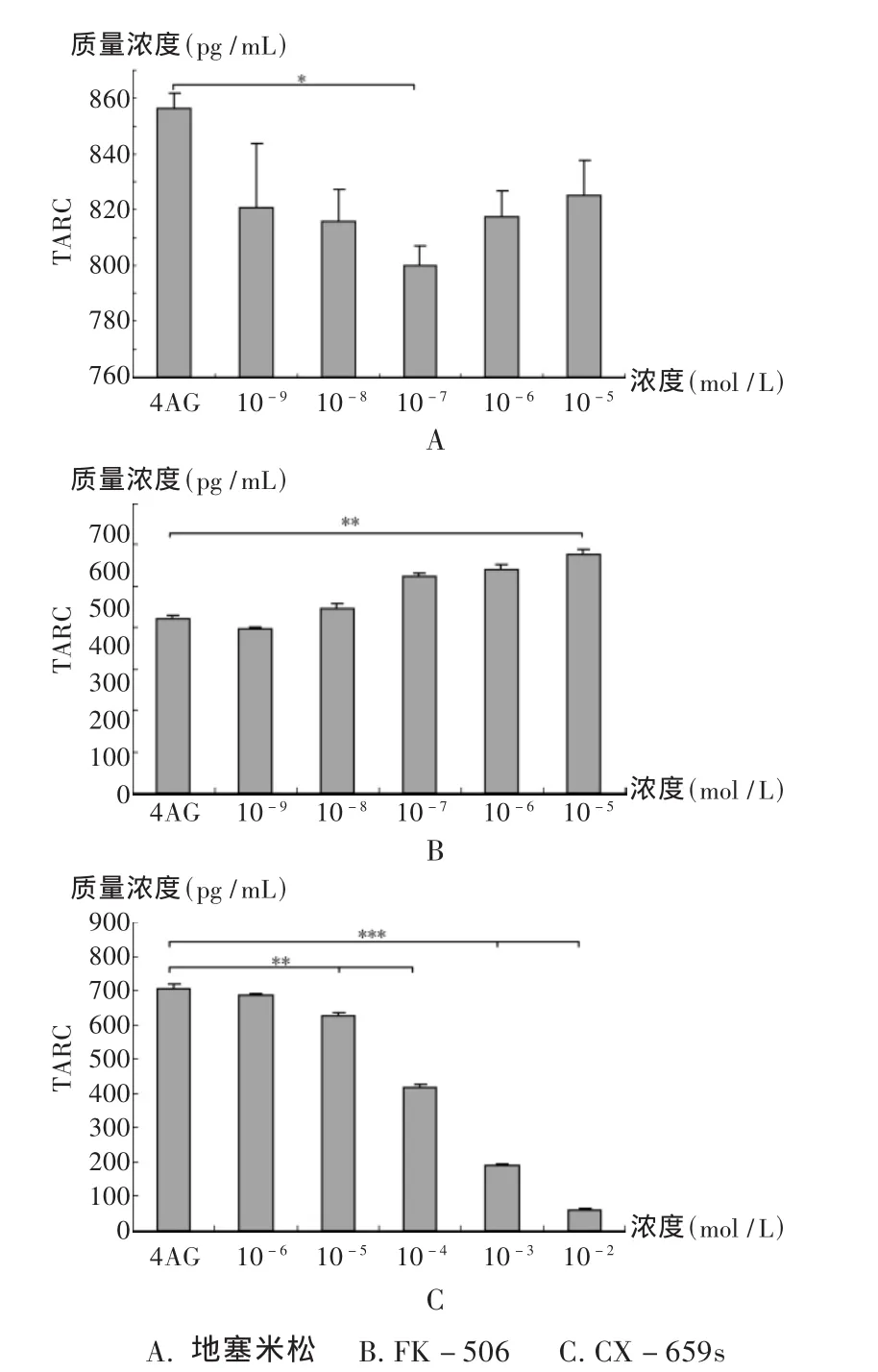
图3 IL-4,TNF-α,IFN-γ刺激下,3种药物对 NG1RGB细胞TARC表达的影响
本试验的目的在于研究3种免疫抑制剂抑制皮肤角质形成细胞和成纤维细胞的TARC表达的作用机制。研究结果表明,这些免疫抑制药物能明显地抑制TARC的表达,调节持续进行的免疫炎性反应。这些免疫抑制药物通过皮肤的两大结构性成分,即角质形成细胞和成纤维细胞,分别在不同条件下抑制TARC表达。笔者认为,皮肤角质形成细胞和成纤维细胞均可以诱导CCR4+T细胞趋向炎症部位,从而调节皮肤局部病理过程中的免疫炎性反应。
本研究结果表明,HaCaT细胞培养48 h后,培养上清中产生117.01 pg/mL的TARC蛋白;IFN-γ刺激HaCaT细胞,分别产生 957.25,1 001.5,96.31 pg/mL,前两组数据明显高于无刺激组(P<0.001);IL-4,TNF-α,IFN-γ 作用 NG1RGB 细胞,产生TARC 分别为 856.28,420.34 和 706.07 pg/mL,水平明显高于无刺激的细胞[4]。ELISA数据表明,各种浓度地塞米松和FK-506可不同程度地抑制HaCaT细胞中的TARC表达(P<0.01或 P<0.001);同样,CX-659s可抑制NG1RGB细胞中TARC蛋白质水平的表达(P<0.01或 P<0.001),且具有浓度依赖性;地塞米松除在10-7mol/L浓度下表现出轻度抑制作用外,其他浓度和各浓度FK-506未见抑制效果。
已有研究表明,皮肤角质形成细胞和成纤维细胞在IL-4,TNF-α,IFN-γ刺激下对TARC表达的影响,不论蛋白质,还是mRNA水平均得到一致结果[4]。本试验表明,3种免疫抑制剂分别在不同状态下抑制皮肤角质形成细胞和/或成纤维细胞的TARC表达,而这些细胞在不同病理条件下所产生的TARC,已经有试验报道[8-9]。
免疫抑制药物临床治疗效果显著,常常作为治疗异位性皮炎等过敏性皮肤疾病的一线药物。地塞米松通过含NF-AT转录区的RE-Ⅱ区域抑制白细胞介素5(IL-5)的表达[10],有试验证明地塞米松通过NF-B活性调控树突状细胞的分化与成熟。他克莫司受体结合蛋白(PEP-1-FK506BP)通过抑制异位性皮炎小鼠NF-B和MAPK活性,抑制细胞因子和趋化因子的表达,提示FK-506有可能为治疗异位性皮炎的有效药物[11]。CX-659s对HaCaT细胞TARC的抑制作用,是通过NF-B和STAT1的活性化起作用[12]。笔者认为,免疫抑制药物的抑制作用,FK-506和CX-659s通过抑制NF-B的DNA结合活性,从而抑制皮肤角质形成细胞和成纤维细胞的TARC表达。
由上可知,3种免疫抑制剂作用于角质形成细胞和成纤维细胞,对TARC表达的调控作用,能够抑制皮肤角质形成细胞和成纤维细胞的TARC蛋白质表达。角质形成细胞和成纤维细胞调控TARC启动子活性的作用机制尚需进一步研究证实。
[1]BaggioliniM.Chemokine and leukocyte traffic[J].Nature,1998,392(6676):565-568.
[2]Imai T,Nagira M,Takagi S,et al.Selective recruitment of CCR4 - bearing Th2cells toward antigen-presenting cells by the CC chemokine thymus and activation-regulated chemokine and macrophage-derived chemokine[J].Int Immunol,1999,11(1):81 - 88.
[3]Vestergaard C,Yoneyama H,Murai M,et al.Overproduction of Th2 CC chemokines TARC and MDC in the skin of the NC/Nga mouse correlates with exacerbation of atopic dermatitis skin[J].J Invest Dermatol,2000,115:640-646.
[4]Yu B,Koga T,Urabe K,et al.Differential regulation of thymus- and activation-regulated chemokine induced by IL-4,IL-13,TNF-alpha and IFN - gamma in human keratinocyte and fibroblast[J].J Dermatol Sci,2002,30(1):29 -36.
[5]Kaplan AP.Chemokines,chemokine receptors and allergy[J].Int Arch Allergy Immunol,2001,124(4):423 - 31.
[6]黄小玲,赖永珲,林渡娣,等.糖皮质激素与他克莫司软膏治疗成人特应性皮炎的不良反应对比分析[J].中国医药导报,2011(6):104-105.
[7]Kido M,Takeuchi S,Esaki H,et al.Scratching behavior does not necessarily correlate with epidermal nerve fiber sprouting or inflammatory cell infiltration[J].J Dermatol Sci,2010,58:130 - 135.
[8]Leung DYM.Atopic dermatitis:new insights and opportunities for therapeutic intervention[J].J Allergy Clin Immunol,2000,105:860 - 876.
[9]Grewe M,Walter S,Gyufko K,et al.Analysis of the cytokine pattern expressed in situ in inhalant allergen patch test reactions of atopic dermatitis[J].J Invest Dermatol,1995,105:407 - 410.
[10]Quan A,McCall MN,Sewell WA.Dexamethasone inhibits the binding of nuclear factors to the IL -5 promoter in human CD4+T cells[J].J Allergy Clin Immunol,2001,108(3):340 - 348.
[11]Kim SY,Sohn EJ,Kim DW,et al.Transduced PEP -1 -FK506BP ameliorates atopic dermatitis in NC/Nga mice[J].J Invest Dermatol,2011,131(7):1 477-1 485.
[12]Kwon DJ,Bae YS,Ju SM,et al.Casuarinin suppresses TARC/CCL17 and MDC/CCL22 production via blockade of NF-κB and STAT1 activation in HaCaT cells[J].Biochem Biophys Res Commun,2012,417(4):1 254-1 259.

