前表面荧光法在牛奶美拉德反应检测中的应用
杨晓倩,刘小鸣,周 鹏
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
前表面荧光法在牛奶美拉德反应检测中的应用
杨晓倩,刘小鸣,周 鹏*
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
在热处理中,牛奶中的乳蛋白容易与乳糖发生美拉德反应,使牛奶的色泽、风味、营养等发生变化。与传统化学检测法相比,前表面荧光法具有快速灵敏、前处理简便等优点。为了评估前表面荧光法在检测牛奶美拉德反应程度上的准确性和适用性,本文对比了不同热处理下牛奶的美拉德反应的荧光图谱和美拉德产物的含量,分析了指标间的相关性。并以前表面荧光法和羟甲基糠醛含量建立模型对商业乳品进行预测,结果良好,为荧光检测的工业应用提供理论依据。结果显示,前表面荧光法可应用于牛奶前中期美拉德产物的无损检测。
前表面荧光,美拉德反应,化学计量学,牛奶
Abstract:Milk proteins are liable to react with lactose during thermal processing,causing changes in color,flavor and nutritional function.In order to understand the accuracy and applicability of front-face fluorescence spectroscopy,the extents of Maillard reaction of the milk samples with various degrees of heat treatments were measured by three Maillard reaction tests and front-face fluorescence spectroscopy(FFFS) respectively.A strong correlation was found between FFFS,furosine and hydroxymethylfurfural.Moreover,a good prediction of hydroxymethylfurfural concentration was got in commercial milk samples using this model.This work indicated that FFFS had the reliability and sensitivity to monitor and control the thermal processing of milk.
Key words:front-face fluorescence spectroscopy;Maillard reaction;chemometrics;milk
热处理是液态乳制品常用的加工步骤,不仅可以延长货架期,还可以减少食源性微生物污染的可能性。虽然高强度的热处理可以保证乳制品的安全,但过度的热处理会对产品的品质带来负作用。液态牛奶中含有丰富的乳蛋白,易与乳糖发生美拉德反应,在高温下尤其剧烈。美拉德反应一方面会导致牛奶的色泽、风味变差,同时还会损失营养物质,增加有害物质。常见的牛奶中美拉德反应程度的检测方法包括采用HPLC法测定美拉德反应早期产物糠氨酸(Furosine)[1-3],HPLC或比色法测定中期产物羟甲基糠醛(HMF)[4]以及末期色素类产物浓度[5-6]和邻苯二甲醛法(OPA法)测定游离赖氨酸的含量[7-8]等。但这些方法存在前处理麻烦耗时和易受干扰等缺点。荧光是一种快速灵敏前处理简单的光谱技术,近年来人们尝试将其用来评价热处理对乳制品的影响方面,如直角荧光法检测牛奶在pH4.6下可溶性部分的色氨酸和美拉德高级产物的荧光信号[9]。近年来出现的前表面荧光技术可进一步简化前处理,在乳制品检测方面的研究包括预测乳品中糠氨酸和乳果糖含量[10],评价前表面荧光在UHT乳检测中的准确性[11],区别液态乳产地[12]等,这些都为荧光快速检测和评价乳制品的品质提供了理论基础。本实验采用不同热处理程度的牛奶,在美拉德反应前中后期中各选一个代表产物(糠氨酸、羟甲基糠醛、色素类),分别与前表面荧光进行相关性分析,来评价前表面荧光的准确性和适用性。
1 材料与方法
1.1 材料与仪器
巴氏杀菌全脂乳 光明乳业有限公司;商业巴氏奶、UHT奶 无锡各大超市;甲醇、无水乙醇 色谱纯;三氯乙酸、硫代巴比妥酸、草酸、三氟乙酸、氢氧化钠、盐酸 化学纯;0.22μm×25mm微孔滤膜 上海兴亚净化材料厂;羟甲基糠醛(5-(Hydroxymethyl)furfural)标准品 Sigma-Aldrich公司;糠氨酸(Furosine dihydrochloride)标准品 NeoMPS公司;碱性蛋白酶诺维信公司。
F-7000荧光光谱仪 日本日立公司;HWS26型电热恒温水浴锅 上海一恒科技有限公司;SPE 12孔真空固相萃取装置 EASTAK公司;UV-1200分光光度计 MAPADA公司;冷冻干燥机 LABCONCO公司;C18固相萃取柱 VARIAN公司。
1.2 实验方法
1.2.1 不同程度美拉德牛奶模型体系的制备 将牛奶按每管15mL加入耐热试管中,加密封盖,放入水(或油)浴锅,水(油)没过试管液面。加热的时间和温度见表1。
1.2.2 糠氨酸的测定[13]取2mL样品(蛋白含量约为60mg)至安瓿管,加入6mL 10.6mol/L盐酸混匀,加入4滴正辛醇消泡,真空泵抽真空5min后用酒精喷灯融管密封。110℃下消化23h后,将水解液转移至10mL容量瓶,定容,过滤。取滤液过0.22μm膜,向C18柱中加入1mL滤液,之前用10mL甲醇、10mL去离子水分别润洗,抽干。用3mL 3mol/L盐酸洗脱,洗脱液全部收集,避光保存。之后用Agilent 1100高效液相色谱仪进行分析。采用Ultimate AQ C18柱(250mm×4.6mm×5μm),进样量为5μL,流速为1.0mL/min,柱温设定为30℃。洗脱液采用乙腈/水/三氟乙酸(5∶95∶0.1),洗脱模式为等度洗脱。10min之后换为乙腈/水/三氟乙酸(60∶40∶0.1)冲洗柱子。检测器采用二极管阵列,检测波长为280nm。糠氨酸出峰时间在5.4min左右。色谱图用软件ChemStation积分得到峰面积。由糠氨酸的标准曲线(R2=0.9996)计算样品含量。每个样品做两次平行。
1.2.3 羟甲基糠醛的测定[14]取5mL样品,加入0.3mol/L草酸2.5mL,充分混匀。90℃水浴60min后,用冰水浴冷却至4℃,加入1.25mL 80%三氯乙酸,充分混匀,静置。4000r/min离心30min。取4mL上清液至10mL离心管,加入0.05mol/L硫代巴比妥酸1mL,充分混匀。之后40℃水浴30min,冷却至常温。以去离子水为空白,443nm下检测吸光度。由HMF的标准曲线(R2=0.9998)计算样品含量。每个样品做两次平行。
1.2.4 美拉德反应程度的测定[15]采用酶解比色法来测定美拉德反应程度。吸光度越高,美拉德反应的最终阶段生成的色素类物质越多,即美拉德反应越剧烈。取10mL样品,冷冻干燥后成干粉状。加入10mL pH8.0的磷酸缓冲溶液(10mmol/L),室温下磁力搅拌至溶解,转速为400r/min。加入15μL碱性蛋白酶,55℃恒温水浴振荡15min,加入2mL 80%三氯乙酸以沉淀蛋白和终止酶解反应。静置,过滤,以缓冲液为空白,420nm下测定吸光值。每个样品做两次平行。
1.2.5 前表面荧光检测 取5mL样品加入石英比色皿(10mm×18mm×45mm),放置于固体样品支架中。测定美拉德反应程度,激发波长设定为360nm,发射波长为400~600nm[12]。测定色氨酸荧光强度,激发波长设定为280nm,发射波长为310~400nm[12]。扫描速率均为12000nm/min,激发波长和发射波长的狭缝宽度均为5nm。光谱图由软件FL Solutions导出。
2 结果与讨论
2.1 化学检测法结果
糠氨酸、羟甲基糠醛含量和颜色的变化如图1所示。糠氨酸是美拉德反应初期的标志性产物,随着温度和时间增长,含量逐渐增多,在105℃后期样品中,出现了下降,可能是糠氨酸转化成了更高级的美拉德反应产物。羟甲基糠醛是中期标志性产物,其含量明显低于糠氨酸,在美拉德前期的增长速率缓于糠氨酸,而后期的增长率快于糠氨酸。酶解比色法所测得吸光度表征美拉德反应后期色素类物质,吸光度值与色素类含量呈正相关。在反应前期几乎没有变化,中后期呈现线性的增长趋势。
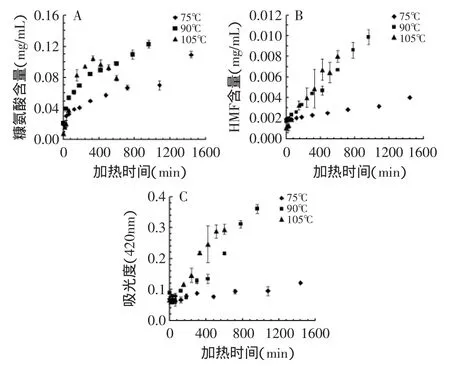
图1 体系在不同温度下加热时的糠氨酸、羟甲基糠醛含量酶解色素吸光度值Fig.1 The concentration of furosine,HMF and absorbance of final Maillard reaction products of different heating temperatures
2.2 荧光信号的变化
牛奶美拉德反应荧光图谱如图2所示。随着温度和时间的增长,样品中的美拉德反应程度越来越高。将荧光图谱标准化后,在发射波长400~600nm的扫描过程中,样品会出现两个峰,分别在430nm和520nm处。430nm处对应是美拉德反应中所产生的荧光物质的荧光信号,在0min的样品中,此处几乎没有荧光信号,随着反应进行,美拉德产物增多,信号逐渐增强。随着反应剧烈程度的增加,在90和105℃的后期,有荧光信号减弱并伴随最大发射波长红移的现象。520nm处对应是牛奶中核黄素的荧光信号[16],表征牛奶中维生素B2的含量。显示在三个温度下,核黄素在初始时在525nm处有比较明显的峰,但后期随着美拉德荧光信号的增强,峰型已不明显,但信号强度没有大的变化。这个现象符合核黄素具有较好耐热性。牛奶色氨酸荧光图谱(未图示)中荧光信号峰出现在340nm左右。在75℃下加热到8h才有比较明显的荧光信号下降,而在90℃下加热到2h荧光信号就开始明显下降,105℃下2.5h之后色氨酸的荧光信号只有初始的一半了。色氨酸的荧光信号表征乳蛋白受热后的变性程度。因为乳蛋白是由约20%乳清蛋白和80%的酪蛋白所组成,乳清蛋白的变性温度为70℃左右(beta-lactoglobulin>70℃,alpha-lactalbumin为65~70℃)[17],酪蛋白变性温度在75℃以上[17],所以在75℃下大部分的酪蛋白还能够保持活性。

图2 体系在不同温度下加热时的美拉德反应荧光谱图Fig.2 Fluorescence spectra of Maillard reaction products in different heating temperatures
将三个温度样品的荧光谱图用Unscrambler软件进行Normalize处理之后做PCA分析,其Score图很相似,以90℃为例,如图3(A)所示。通过Loading图(B)判定不同温度组中PC1所代表均为美拉德反应(430nm),且能解释99%以上的样品差别。在PC1上消极端代表美拉德程度低的样品,积极端代表美拉德程度越高的样品。PC1上,75℃样品荧光信号逐渐增加,而90和105℃的样品中,后期出现了信号的减弱,这可能是在剧烈的加热条件下,美拉德反应初期或中期产物转化成了更高级而没有荧光信号的物质。而PC2经过分析是未知的荧光信号(约在460~470nm),在90和105℃的样品中能解释1%的差别信息,虽然很微弱,但是说明在实验中剧烈的热处理条件下,荧光信号在此区间的物质会发生变化。同时能发现,三个温度组的样品在PC2上都经历了从积极端向消极端再回到积极端的过程。推测是多种荧光物质的生成增长转化的叠加作用。
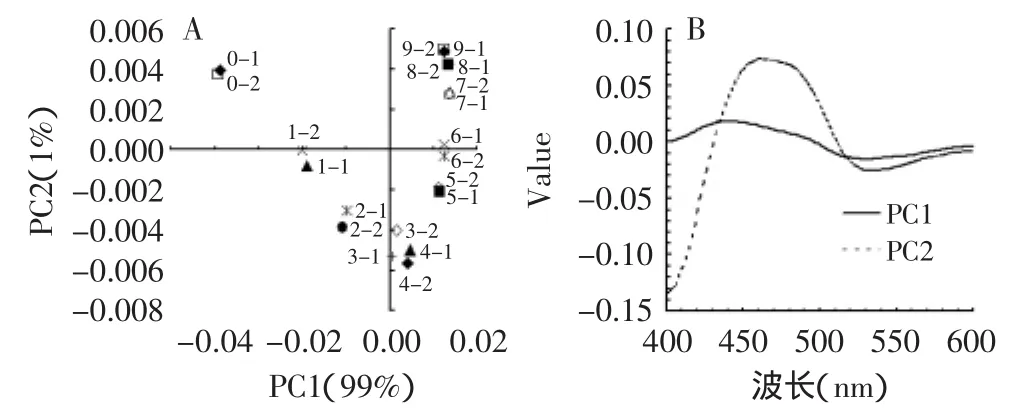
图3 90℃加热组的PCA分析Score图(A)和Loading图(B)Fig.3 Principal component analysis similarity map(A)and factor loading(B)of Maillard reaction products of milk samples heated under 90℃
2.3 相关性分析
将样品的荧光谱图和化学测定的数据导入Unscrambler软件,进行PLS分析,讨论糠氨酸、羟甲基糠醛、酶解吸光度值(末期色素)与荧光谱图的相关性。将由荧光图谱所得到的真实值和预测值导入SPSS软件,进行配对样本T检验。置信区间设定为95%,其结果如表2所示。表明三组数据的p值均远大于0.05,说明两样本间无明显差异,并且三组数据的均值差值和标准误都较小,也说明预测值和真实值之间的相关性较好。

图4 样品荧光图谱和糠氨酸,羟甲基糠醛含量和酶解色素吸光度值的相关性分析Fig.4 Predicted and observed furosine,HMF concentration and absorbanceofmilksamplesthatheatedunderdifferenttemperature

表2 测量值和预测值的配对样本T检验Table 2 Paired samples test of measured value and predicted value
此外,分别分析三个温度组的真实值和预测值之间的线性关系,可以得到好的线性关系(R2>0.9)。将所有样品共同分析,仍具有较好的相关性(R2>0.8),说明具有较好的预测能力。其与美拉德反应前期产物糠氨酸含量的对应性优于与中期后期产物的对应性,且和低浓度的中后期产物的对应性优于高浓度,在低浓度时呈现线性对应,在高浓度时对应性变差。因此在建立模型时,由软件自动除去离群点,糠氨酸模型中去除75℃ 24h、90℃ 16h、105℃ 5.5~10h加热点,HMF模型去除75℃18~24h、90℃ 7~16h、105℃ 4~10h加热点,色素类吸光度模型去除75℃12~24h、90℃ 4~16h、105℃ 10h加热点,均为各温度加热后期的实验点。图4为除去离群点后的相关性,排除差异较大的样品点使得模型更加可靠,同时也说明前表面荧光法对于检测前中期的美拉德反应程度具有更高的适用性。在实际工业生产中,经过热处理的液态乳制品都是处于前中期的美拉德反应阶段,因此,此法有较好的对应性和适用性。
2.4 商业奶验证实验
用Unscrambler软件所建立的前表面荧光法和HMF含量的模型来预测商业乳品中HMF含量,同真实值对比,探究此模型的商业应用性。此模型的RMSEP值为0.000819,相关系数为0.915。说明这个模型是具有较好的预测能力的。因此将其应用于国内6个品牌30种商业奶(巴氏奶、UHT奶等)检测,利用此模型进行预测,其HMF含量的预测值、偏差值和真实值如表3所示。
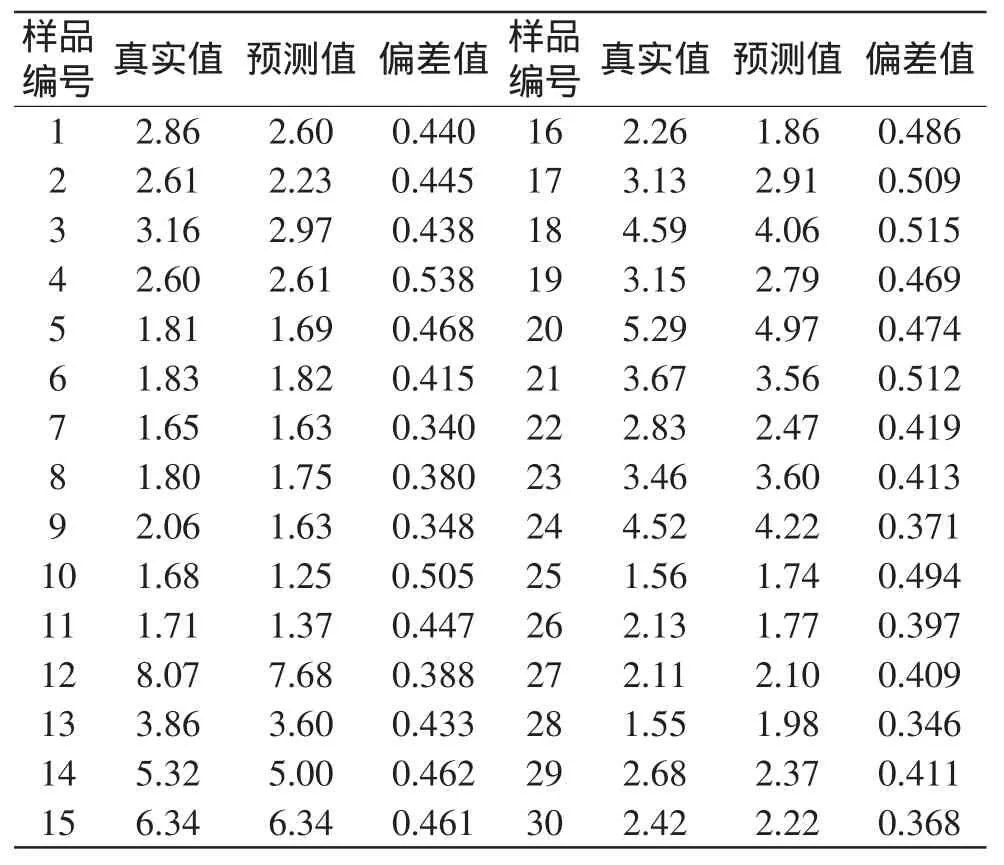
表3 商业奶HMF含量的预测值与真实值(μg/mL)Table 3 The predicted and measured HMF concentration of commercial milk samples(μg/mL)
真实值在预测值±偏差值范围内认为预测有效。由表3可知,除9号样品有些许预测偏差(0.082)之外,其余样品都可以利用荧光结果较好的预测其HMF的含量。因此可以初步证实前表面荧光法在商业乳品的检测中是有较好的适用性和可靠性的。进一步说明前表面荧光法在牛奶美拉德反应检测中是一种无需前处理、省时、准确性好的无损检测方法。
3 结论
本实验中,不同美拉德程度的牛奶分别用化学法和前表面荧光法进行检测,用以评估前表面荧光法在检测液态乳体系中美拉德程度的准确性。实验证实了前表面荧光法与前中期的美拉德程度有较好的对应性,且将建立的前表面荧光-HMF含量模型应用于预测商业乳品HMF含量有较好的初步结果。因此,此法具有应用于在工业乳制品检测的理论基础。同时此法相对其他化学方法具有无损无前处理、省时、灵敏度高等优点,是一种能推广应用的检测手段。
[1]Fenaille F,Parisod V,Visani P,et al.Modifications of milk constituents during processing:A preliminary benchmarking study[J].International Dairy Journal,2006,16:728-739.
[2]王加启,卜登攀,魏宏阳,等.NY/T 939-2005巴氏杀菌乳和UHT灭菌乳中复原乳的鉴定[S].北京:中华人民共和国农业部,2005.
[3]李广,段辉,张楠.反相离子对色谱法测定牛奶与奶粉中糠氨酸的含量[J].分析测试学报,2010,29(11):1207-1010.
[4]Emilia F,Amparo A,Rosura F.Effects of thermal processing and storage on available lysine and furfural compounds contents of infant formulas[J].Journal of Agriculture and Food Chemistry,2000,48:1817-1822.
[5]Thao T L,Bhesh B,Hilton C D.Chemical and physical changes in milk protein concentrate(MPC80) powder during storage[J].Journal of Agricultural and Food Chemistry,2011,59:5465-5473.
[6]Gujral H S,Khanna G.Effect of skim milk powder,soy protein concentrate and sucrose on the dehydration behaviour,texture,color and acceptability of mango leather[J].Journal of Food Engineering,2002,55:343-348.
[7]Vigo M S,Malec L S,Gomez R G,et al.Spectrophotometric assay using o-phthaldialdehyde for determination of reactive lysine in dairy products[J].Food Chemistry,1992,44:363-365.
[8]Fenaille F,Campos-Gimenez E,Guy P A,et al.Monitoring of β-lactoglobulin dry-state glycation using various analytical techniques[J].Analytical Biochemistry,2003,320:144-148.
[9]Birlouez-Aragon I,Sabat P,Gouti N.A new method for discriminating milk heat treatment[J].International Dairy Journal,2002,12:59-67.
[10]Kulmyrzaev A,Dufour E.Determination of lactulose and furosine in milk using front-face fluorescence spectroscopy[J].Lait,2002,82:725-35.
[11]Labuza T P,Schamberger G P.Evaluation of front-face fluorescence for assessing thermal processing of milk[J].Journal of Food Science,2006,71(2):C69-74.
[12]Ntakatsane M P,Yang X Q,Lin M,et al.Suitability of fluorescence spectroscopy for characterization of commercial milk of different composition and origin[J].Journal of Dairy Science,2001,94(11):5375-5380.
[13]周骁,薛晓锋,吴黎明,等.反相离子对色谱法测定蜂王浆中糠氨酸的含量[J].食品科学,2008,29(5):370-372.
[14]Keeney M,Bassette R.Detection of intermediate compoundsin the early stages of browning reaction in milk products[J].Journal of Dairy Science,1959,42:954-960.
[15]Labuza T P,Staltmarch M.Kinetics of browning and protein quality loss in whey powders during steady state and nonsteady state storage conditions[J].Journal of Food Science,1981,47(1):92-96.
[16]Becker E M,Christensen J,Frederiksen C S,et al.Frontface fluorescence spectroscopy and chemometrics in analysis of yogurt:Rapid analysis of riboflavin[J].Journal of Dairy Science,2003,86(8):2508-2515.
[17]Yada R Y.Proteins in food processing[M].Florida:CRC Press,2004:29-62,72-93.
Application of front-face fluorescence spectroscopy for determination of Maillard reaction in milk
YANG Xiao-qian,LIU Xiao-ming,ZHOU Peng*
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
TS252.2
A
1002-0306(2012)16-0157-05
2012-02-01 *通讯联系人
杨晓倩(1987-),女,硕士在读,研究方向:食品结构与物性。
国家自然科学基金项目(30901128)。

