强直性脊柱炎患者外周血TCR Vα CDR3谱系基因扫描分析研究①
魏克娜 余伍忠 徐新玉 张 璐 邹红云
(兰州军区乌鲁木齐总医院临床医学研究所,乌鲁木齐830000)
强直性脊柱炎(Ankylosing spondylitis,AS)是一种以骶髂关节和脊柱等中轴关节附着点炎症为主的自身免疫病,其发生与遗传、慢性感染、自身免疫功能紊乱等多种因素有关。遗传因素(尤其是人类白细胞抗原B27(Human leucocyte antigen B27,HLAB27))致病机理的研究一直是AS的研究焦点,但其确切病因和发病机制至今尚未完全明确。
近年来,T淋巴细胞在AS致病中的作用机制引起广泛关注。免疫组化研究发现[1,2],AS患者病变的骶髂关节及滑膜组织活检标本中,出现大量炎性T细胞、单核/巨噬细胞浸润,这些炎性T细胞参与了AS的发病过程,有可能是AS发病中的特定的反应性T细胞。目前,对AS相关免疫活性T细胞的研究报道十分有限。
T淋巴细胞通过T细胞受体(T cell receptor,TCR)的可变区(Variale,V区)识别外来抗原,抗原首先要被抗原递呈细胞处理为9~14个氨基酸的多肽(抗原肽),这些抗原肽和MHC分子一同在抗原递呈细胞分子表面表达,TCR分子识别并结合的是MHC肽复合物,从而引起一连串的免疫反应。TCR基因重排过程中,TCR α链的V区和结合区(Joint,J区)之间可存在不同数量的碱基对,称为N区,V区和J区结合的多样化和N区不同数量核苷酸的随机插入形成的高度可变区(VNJ区),称为互补决定区3(Complementarity determining region 3,CDR3),是TCR直接与抗原决定簇结合的部位,具有多态性。CDR3区的结构对于MHC抗原特异性识别至关重要,不同重排时CDR3长度不同,通过检测不同亚家族CDR3长度,可以了解TCR不同亚家族的克隆性特点[3]。近年来,T细胞TCR CDR3免疫扫描谱系分析技术广泛应用于自身免疫病的研究,但目前受到较多关注的是T细胞TCR Vβ CDR3谱系的多态性[4],而 TCR Vα 谱系特点的研究报道较少[5],本研究采用逆转录-聚合酶链反应(RT-PCR)和基因扫描技术来分析AS患者外周血单个核细胞(Peripheral blood monouclear cell,PBMC)中34个 TCR Vα亚家族的基因表达及其克隆增生情况,了解患者的细胞免疫功能,为探索T细胞在AS免疫发病中的作用机制提供基础。
1 材料与方法
1.1 病例选择 10例AS患者,男性8例,女性2例,其中HLA-B27阳性9例,HLA-B27阴性1例,均来自兰州军区乌鲁木齐总医院门诊和住院患者,均为初诊、未经治疗,或者停药后复发尚未经再次治疗的患者,年龄为17~42岁,均符合纽约1984年修订的诊断标准[6],并排除其他自身免疫性疾病和感染性疾病。5例正常健康人对照及所有入选病例均采集乙二胺四乙酸二钾(EDTA-K2)抗凝静脉血5 ml,取血前均征得本人及家属同意。
1.2 RNA提取和cDNA合成 按RNA提取试剂盒(Omega Bio-Tek,美国)提取10例AS患者和5例正常健康人PBMC(2×106细胞)中的RNA,按照cDNA Kit条件,用Olig dT作引物扩增cDNA(每样本合成3个反应体系)。
1.3 TCR Vα和TCR Cα家族引物设计和合成 参照文献[5,7],合成TCR Vα亚家族上游引物34条;TCR Cα下游引物1条(内侧端带FAM荧光标记),TCR Cα对照引物两条,引物均由英潍捷基(上海)贸易有限公司合成。
1.4 PCR扩增34个TCR Vα亚家族 PCR反应体积为 50 μl,含 cDNA 模板 2 μl,dNTP(2.5 mmol/L)4 μl,10 ×PCR Buffer(含 Mg2+)5 μl,TCR Vα 上游引物2 μl,下游共用TCR Vα引物(内侧端带FAM荧光标记)2 μl(所有上、下游引物浓度均为10 μmol/L),Taq DNA多聚酶1.25 U。反应条件为:95℃预变性5分钟;95℃ 30秒,60℃ 30秒,72℃ 90秒,35个循环;72℃延伸10分钟。PCR产物在2%的琼脂糖凝胶(溴乙锭染色)中进行电泳,余-20℃保存备用。
1.5 基因扫描分析(CDR3长度分析)T细胞克隆
取TCR Vα各家族带FAM荧光标记的PCR产物2 μl,加入去离子甲酰胺(Hi-Di Formamide,美国ABI公司)2 μl,0.5 μl标准品(美国 ABI公司,Genescan 500-Tamra,其中含有不同大小的荧光素Tamra标记的 DNA片段)及 0.5 μl上样缓冲液(25 mmol/L EDTA,50 mg/ml blue dextran),94℃变性4分钟后,每管取2 μl于6%变性聚丙酰胺凝胶中电泳2小时,并用373A DNA序列分析仪(ABI,Perkin Elmer公司)分析结果,通过分析软件GeneS-can672、激光扫描及计算机收集电泳过程中不同时间所出现的不同颜色和强度的荧光素而显示出不同位置、高度、颜色和形态的峰。
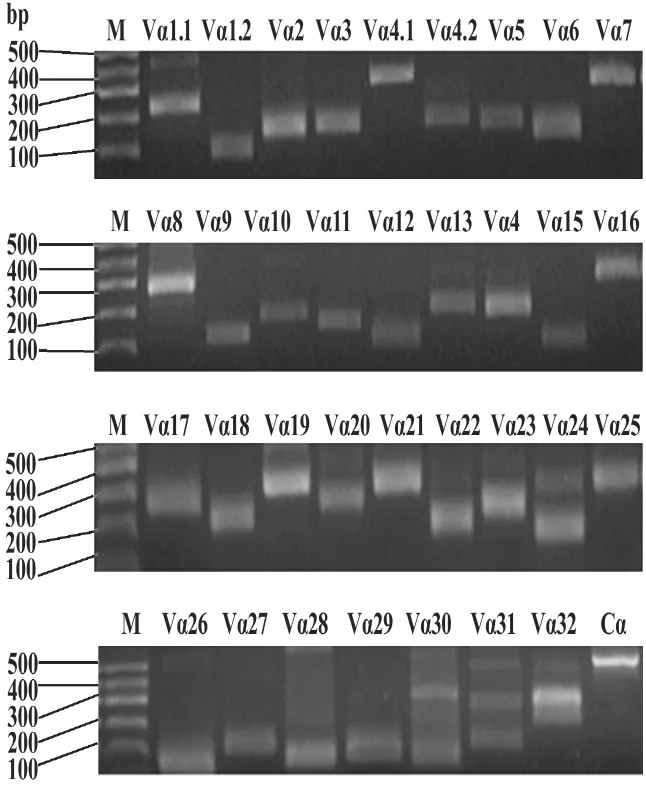
图1 正常健康人34个TCR Vα亚家族和TCR Cα对照RT-PCR产物2%琼脂糖凝胶电泳图Fig.1 2%agarose gel electrophoresis of the RT-PCR products of 34 TCR Vα subfamilies and TCR Cα in a normal control
2 结果
2.1 PBMC TCR Vα 34亚家族RT-PCR结果 正常健康人及AS患者的PBMC 34个TCR Vα亚家族及TCR Cα对照均有表达,RT-PCR产物在2%琼脂糖凝胶电泳图上预测相应大小处显示特异性的条带(见图1)。
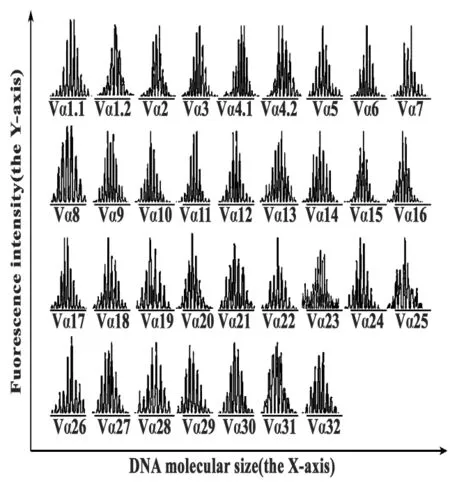
图2 正常健康人PBMC TCR Vα 34个亚家族CDR3谱型基因扫描分析图Fig.2 Spectratyping of CDR3 sizes for all 34 TCR Vα gene subfamilies in PBMC in a normal control
数患者中的扫描谱型呈单峰即单克隆增生,其中Vα19亚家族在3例患者中的扫描谱型均呈单峰,即单克隆增生;Vα32、Vα7 及 Vα1.2分别在2 例患者中出现单峰;仅在1例患者中呈现单峰的亚家族有:Vα31(1号患者)、Vα4.1 和 Vα9(3 号患者)、Vα8和Vα24(5 号患者)、Vα20 和 Vα28(6 号患者)、Vα30(7号患者)及Vα17(8号患者);寡峰/寡峰趋势出现频率较高的亚家族为 Vα5和 Vα13(均为50%,5/10);偏峰出现频率较高的亚家族为Vα18(为30%,3/10);不规则异常峰型出现频率较高的
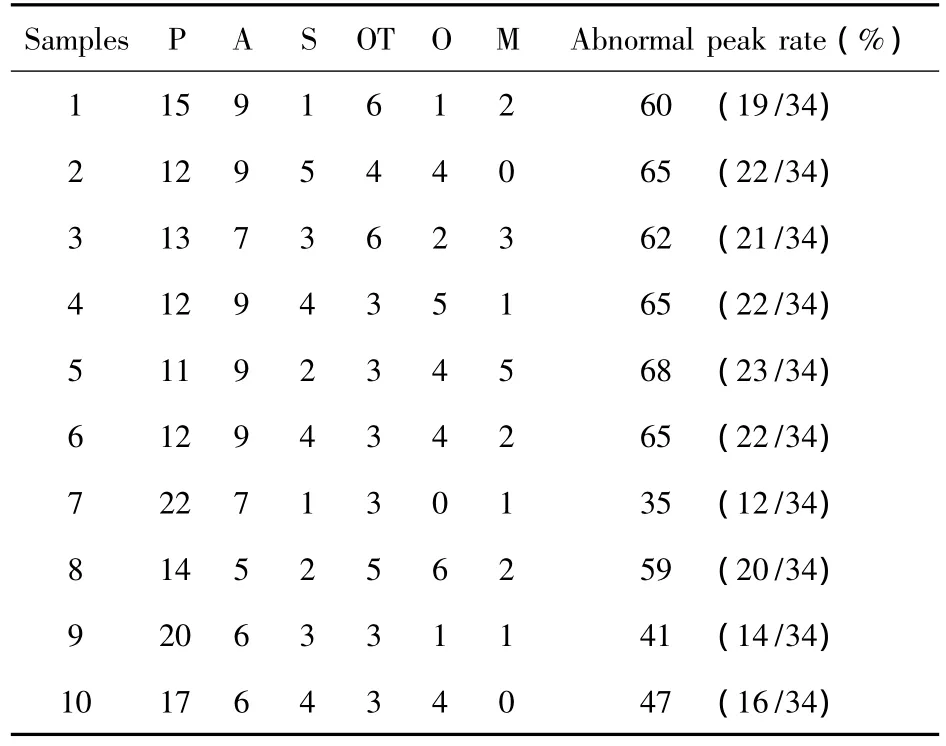
表1 不同AS患者TCR Vα亚家族的异常峰型率Tab.1 The abnormal peak rate of TCR Vα subfamilies in different AS patients
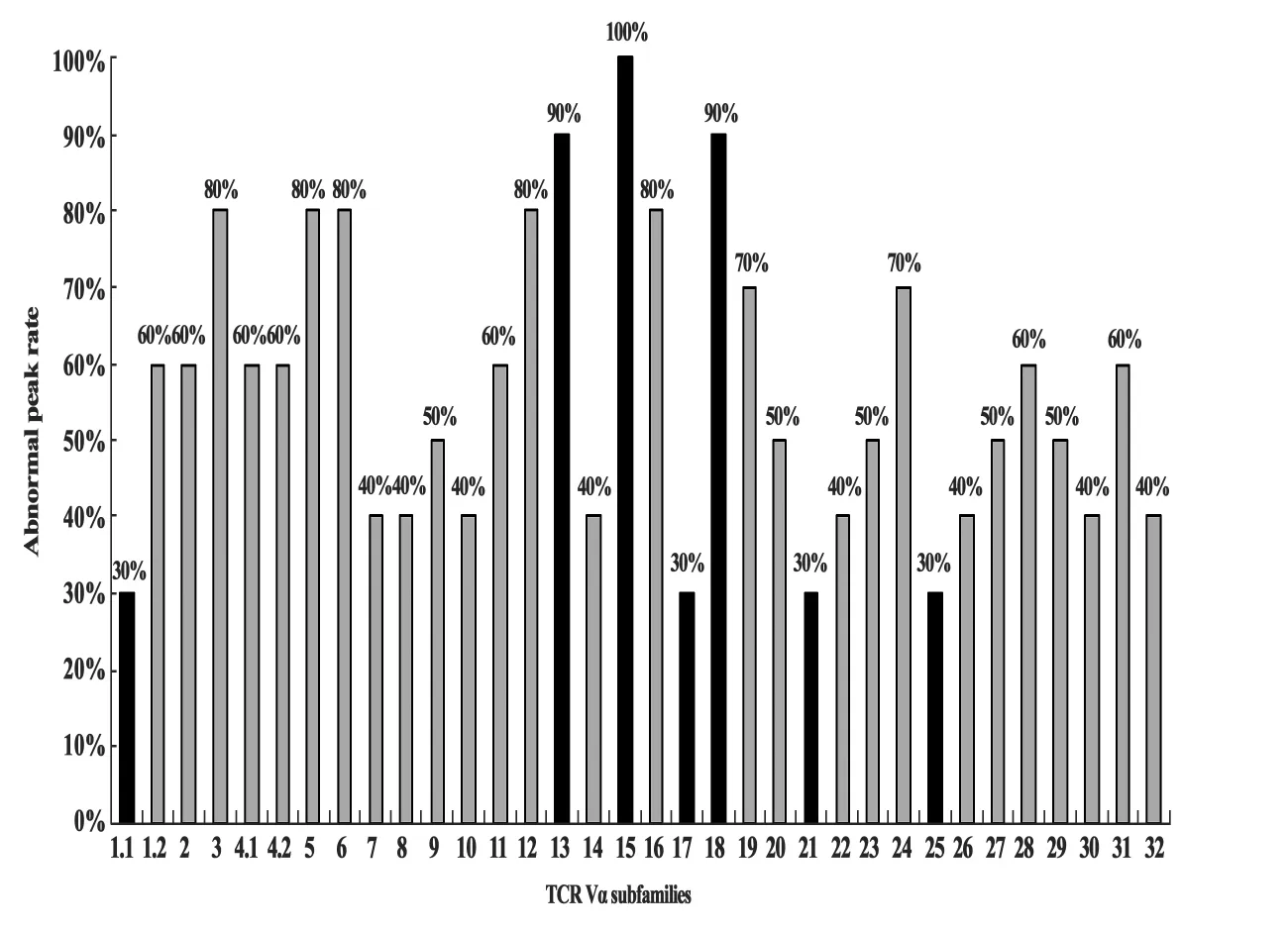
图3 AS患者34个TCR Vα亚家族的异常峰型率Fig.3 Abnormal peak rate for all 34 TCR Vα subfamilies in AS patients
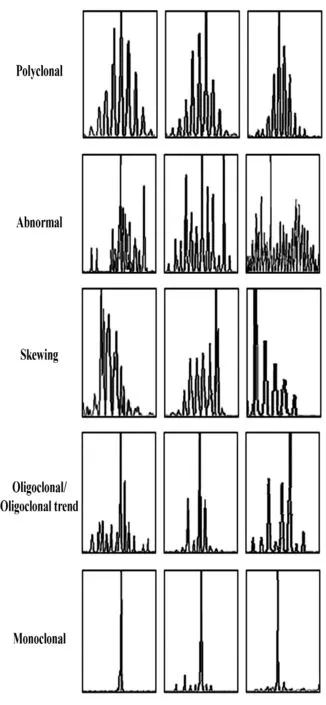
图4 部分AS患者TCR Vα亚家族RT-PCR产物基因扫描分析结果Fig.4 Analyse results of RT-TCR gene scanning for TCR Vα subfamilies in part of AS patients
2.2 TCR Vα亚家族基因扫描分析结果 基因扫描分析结果显示:5例正常健康人PBMC TCR Vα绝大多数亚家族谱型呈现8~10个中间高、两端低的钟型峰图,即呈正态分布或高斯分布(见图2)。
所有AS患者外周血T细胞均出现多个TCR Vα家族谱型的异常改变,异常峰型包括:单峰、寡峰/寡峰趋势、偏峰及不规则异常峰型。不同患者的TCR Vα亚家族的异常峰型率在35%(12/34)~68%(23/34)。其中HLA-B27阴性的1号患者,其TCR Vα亚家族异常峰型率为60%(19/34),见表1。
34个TCR Vα亚家族中,不同亚家族出现异常峰型的频率不同,其中TCR Vα15在全部患者中均出现异常峰型(异常峰型率为100%,10/10);其他亚家族中异常峰型率较高的有:Vα13和Vα18均为90%(9/10),Vα3、Vα5、Vα6、Vα12 和 Vα16 均为80%(8/10),而 Vα1.1、Vα17、Vα21 和 Vα25 亚家族异常峰型出现频率较低,为30%(3/10)。见图3。
34个TCR Vα亚家族中,共有17个亚家族在少亚家族也是Vα18(为50%,5/10)。患者部分TCR Vα亚家族的不同峰型扫描图见图4。
3 讨论
随着AS发病率的增高,其发病机制越来越得到广泛的关注。关于TCR CDR3的监测与分析有多种方法:定量PCR、PCR-DNA印迹(Southern blot)、PCR-单链构象多态性(Single strand conformation polymorphism,SSCP)和DNA-异源双链追踪分析(Heteroduplex tracking assay,HTA)等方法来判断T细胞可变区的变化。近年来,采用RT-PCR-免疫扫描谱型分析-测序技术分析TCR CDR3的表达频率和长度分布(即谱系漂移)已成为目前最为灵敏、精确的检测T淋巴细胞克隆的方法,成为很有前景的研究方向。相比其他检测方法,RT-PCR-免疫扫描谱型分析-测序技术的优点有:检测除了能在样本中找到单/寡克隆增生的T细胞,并提供T细胞应答库的组成信息(不同的亚家族出现异常峰型或表达频率的变化);不需要对样本进行其他特殊处理;能区分多基因V家族成员;经自动分析获得的直观图有利于去除混杂背景,具有特异性特点,适于处理大量标本。并且,此技术既可以作为一种定性、快速的筛选方法,也可以用于定量分析。本研究为该技术的进一步推广应用提供了更多的资料。
自身免疫病的中心环节是体内存在针对性自身抗体,其基础是自身反应性T淋巴细胞对特异性抗原的识别和激活。正常情况下,机体未受任何抗原刺激时,外周血T细胞TCR Vα重排是随机的,T细胞表现为多克隆性;疾病状态下,特殊的抗原刺激可引起某一个或几个亚家族的TCR针对性重排,出现异常克隆性增生[8-10],T细胞的选择性扩增表明该淋巴细胞是特异性的,受抗原的激发而产生特异性免疫应答,它们被认为是致病性 T细胞[11,12]。
TCR Vα基因由于不含有高变区(Diversity,D区),故仅有V区和J区发生重排[13]。有研究表明,TCR α链比TCR β链多样性更多,识别抗原肽主要依靠 TCR α 链[14,15]。由于 TCR α 链和 TCR β 链是以异源二聚体表达于T细胞表面的,为了全面了解特异识别抗原的TCR,需要同时了解TCR Vα和TCR Vβ亚家族的优势取用情况。本课题组在前期研究中发现,AS患者TCR Vβ CDR3扫描谱型具有显著多态性特点[16],在此基础上,我们进一步分析了AS患者TCR Vα亚家族的克隆性分布情况及特点,以期全面了解AS患者TCR CDR3谱系的多态性特点。目前有关AS患者 TCR Vα CDR3谱系及克隆性的研究尚未见报道。
TCR Vα亚家族的表达和克隆性分析方法与TCR Vβ亚家族相同,只是选用的亚家族特异性引物不同。本研究对10例AS患者TCR Vα亚家族的CDR3谱系和克隆性表达分析发现,所有AS患者外周血T淋巴细胞均出现多个TCR Vα家族谱型的异常改变,进一步表明AS患者T细胞存在异常。AS患者部分亚家族出现单克隆或寡克隆/寡克隆趋势增生的表达情况,以及不同患者不同家族呈现优势增生,提示在某些因素的作用下,患者体内的自身免疫平衡已被打破,可能产生了针对自身的T淋巴细胞;亦有可能是特定抗原刺激所引起的一种特异性免疫应答;或者是自身免疫紊乱而产生的多样单/寡克隆增生的T细胞。不同患者出现不同数量亚家族(4~11个TCR Vα亚家族)寡克隆/寡克隆趋势增生性T细胞,可能与不同患者其免疫状态、疾病病程及严重程度不同等因素有关,还有待于进一步探究;各TCR Vα亚家族在不同患者中表现的异常峰型亦有所不同,因病例数有限,尚未见有明显的规律性。不同的患者单/寡克隆性T细胞TCR Vα亚家族的个体特异性可能与不同个体的HLA-B27亚型或其他HLA遗传背景的差异性以及与抗原的多样性有关。目前对克隆性增生的T细胞在体内的功能意义值得进一步研究。
研究结果还显示,HLA-B27阴性的1号患者出现与其他HLA-B27阳性患者类似的异常峰型,且异常峰型率差别不大,但由于病例数较少,HLA-B27是否与AS患者TCR Vα亚家族异常峰型率有关还有待于进一步确证。
本研究发现了部分单克隆和寡克隆增生的TCR Vα亚家族,T淋巴细胞单/寡克隆性增生是疾病的病因,还是由该病造成的结果,我们将进一步在增加样本量的基础上,对这种单/寡克隆增生的亚家族CDR3进行基因序列及氨基酸序列分析,探讨是否存在有CDR3共同基序,再进一步结合生物信息学技术,筛选出与AS高度相关的克隆性增生家族,还有必要结合病情跟踪监测患者在不同时期TCR CDR3谱系的变化。为发现AS相关特异性抗原提供线索,并为以T细胞为靶点的特异性免疫治疗提供新的理论依据。TCR CDR3谱系克隆性特点与疾病的发病机制的具体关系是怎样的有待于进一步研究。
1 Fiorillo M T,Maragno M,Butler R et al.CD8+T-cell autoreactivity to an HLA-B27-restricted self-epitope correleates with ankylosing spondylitis[J].Clin Invest,2000;106(1):47-53.
2 Appel H,Kuhne M,Spiekermann S et al.Immunohistologic analysis of zygapophyseal joints in patients with ankylosing spondylitis[J].Arthritis Rheum,2006;54:2845-2851.
3 刘继华,朱 平.基因指纹图谱探索胚胎淋巴细胞克隆发生的规律[J].中国优生与遗传杂志,2002;10(3):1-3.
4 姚新生.TCR β链CDR3谱序与疾病研究概况及进展[J].国际免疫学杂志,2007;30(4):240-244.
5 姚新生,马 骊,邹红云et al.监测TCR CDR3漂移的免疫扫描谱型分析技术的建立与鉴定[J].中华微生物学和免疫学杂志,2006;26(6):571-573.
6 Vander L,Linden S,Valkenburg H A et al.Evaluation of diagnostic criteria for ankylosing spondylitis A proposal for modification of the New York criteria[J].Arthritis Rheum,1984;27(4):361-368.
7 Zou Hong-yun,Ma Li,Wang Xiao-ning.Expression of recombinationactivating genes and T cell receptor gene recombination in human T cell leukemia cell line Jurkat[J].Chin Med J,2007;120(5):410-415.
8 Miqueu P,Guillet M,Degauque N et al.Statistical analysis of CDR3 length distributions for the assessment of T and B cell repertoire biases[J].Mol Immunol,2007;44(6):1057-1064.
9 Long S A,Khalili J,Ashe J et al.Standardized analysis for the quantification of Vbeta CDR3 T-cell receptor diversity[J].Immunol Methods,2006;317(1-2):100-113.
10 Matsumoto Y,Matsuo H,Sakuma H et al.CDR3 spectratyping analysis of theTCR repertoire inmyasthenia gravis[J].Immunol,2006;176(8):5100-5107.
11 Scott M,Lieberman,Anne M et al.Identification of the β cell antigen targeted by a prevalent population of pathogenic CD8+T cells in autoimmune diabetes[J].PNAS,2003;100(14):8384-8388.
12 Theofilopoulos A N,Dummer W,Kono D H.T cell homeostasis and systemic autoimmunity[J].JCI,2001;108(3):335-340.
13 李扬秋.血液肿瘤免疫治疗学[M].北京:人民卫生出版社,2005:379-382.
14 Hennecke J,Carfl A,Wleyd C.Structure of a covalentil stabilized complex of a human α β T-cell receptor,influenza HA peptide and MHC classⅡ molecule,HLA-DR1[J].EMBO J,2000;19(21):5611-5624.
15 Reiser J B,Darnault C,Gumezanes A et al.Crystal structure of a T cell receptor bound to an allogeneic MHC molecule[J].Nat Immunol,2000;1(10):291-297.
16 魏克娜,张 璐,焦 敏et al.强直性脊柱炎外周血T细胞受体BV基因谱系多态性的初步研究[J].中华风湿病学杂志,2012;16(5):329-332.

